蛛丝蛋白/聚己内酯/壳聚糖复合纳米纤维支架与内皮细胞的相容性
赵 晋 周志华 李 敏
(福建师范大学生命科学学院,福州 350108)
引言
人工血管和自体血管是目前临床上小直径血管移植物的主要来源。在实践中,人工血管存在植入后容易引起血栓形成、内膜增生、远期通畅率不高等问题;自体血管受到来源、大小等限制,还无法满足小直径血管移植物的要求[1-2]。组织工程为小直径血管移植物的来源提供了有效途径,制备可支持细胞进行生命活动的支架是组织工程血管研究的重要领域。近年来,组织工程血管支架领域研究的重点是将不同材料共混构成复合材料,如胶原/聚己内酯(PCL)[3]、丝素蛋白/聚对二氧杂环己酮(PDO)[4]、胶原/弹性蛋白/聚乳酸-羟基乙酸(PLGA)[5],以同时发挥各材料的优点。应用静电纺丝技术可制备具有高孔隙率和比表面积的小直径管状支架,其纳米纤维可模拟细胞外基质的网架结构,利于细胞的粘附、生长及增殖。生物活性分子RGD短肽(精氨酸-甘氨酸-天冬氨酸)介导种子细胞与支架材料粘附,能够促进细胞的粘附和分化[6]。
前期根据蜘蛛丝结构及功能特性,利用基因工程技术构建并表达了RGD-重组蛛丝蛋白(命名为pNSR32)[7],并将 RGD-重组蛛丝蛋白与力学性能优良的PCL、血液相容性良好的壳聚糖(CS)共混,应用静电纺丝技术制备pNSR32/PCL/CS复合纳米纤维小直径血管支架。实验结果观察到所制备的小直径血管支架具有良好的血液相容性,适当的力学性能,其三维多孔网状结构模拟了细胞外基质的结构[8]。在此基础上,本研究应用体外细胞培养法,通过分析pNSR32/PCL/CS复合纳米纤维小直径血管支架浸提液毒性,观察种植在支架材料上体外培养的SD大鼠胸主动脉内皮细胞(简写为SDRAEC)粘附和增殖情况,结合细胞毒性MTT比色法和细胞免疫荧光染色方法,检测细胞生物学特性。通过评价支架的细胞相容性,分析该复合材料作为小直径血管组织工程支架的可行性,也为进一步的体内实验提供理论依据。
1 材料和方法
1.1 主要试剂与设备
JSM-7500 F型冷场发射扫描电子显微镜(日本电子株式会社)、ELx 800型酶标仪(Bio-tek instrument,美国)、HEARACell 150 i型 CO2细胞培养箱(Thermo Scientific,美国)、SW-CJ-2D型超净工作台(苏州净化设备有限公司)、BX51荧光显微镜(OLYMPUS,日本)、静电纺丝仪(自组装[9]),聚己内酯(PCL)(MW=80000,日本大赛潞化学公司)、壳聚糖(CS)(脱乙酰度91.18%,浙江玉环县海洋生物化学有限公司)、RGD-重组蛛丝蛋白(pNSR32)(相对分子货量 102KD,自制[10])、DMEM 高糖培养基(Gibco,美国)、胎牛血清(HyClone,美国)、青链霉素(HyClone,美国)、胰蛋白酶(Amresco,美国)、亚甲基亚砜(DMSO)(Sigma,美国)、四氮唑盐(MTT)(Sigma,美国)、兔抗鼠约为 DWF抗体(北京博奥森生物技术有限公司)、兔抗鼠CD31抗体(北京博奥森生物技术有限公司)、FITC标记山羊抗兔IgG(H+L)(Jackson ImmunoResearch Laboratories,美国)、Triton X-100(Genview,美国)、其他试剂均选用分析纯。
1.2 方法
1.2.1 pNSR32/PCL/CS复合纳米纤维支架的制备
在前期的报道中,已详细描述过PCL、pNSR32/PCL、p NSR32/PCL/CS复合纳米纤维支架的制备方法[8]。现简述如下:以甲酸为溶剂(电纺液浓度0.25 g/mL),制备 PCL 电纺液、m(pNSR32):m(PCL)为5:95的 p NSR32/PCL混合电纺溶液,以及m(pNSR32):m(PCL):m(CS)为 5:85:10 的pNSR32/PCL/CS混合电纺液。采用可转动轴柄作为接收器,通过静电纺丝技术制备所需的纳米纤维支架。
1.2.2 细胞培养
SDRAEC由SD大鼠胸主动脉组织贴块法获得,细胞免疫荧光法鉴定。选择含15%胎牛血清(FBS)的 DMEM高糖培养液,37℃、5%CO2培养箱培养,实验所用的内皮细胞为第3~5代。
1.2.3 体外浸提液毒性试验[11]
1.2.3.1 浸提液的制备
根据 ISO10993-12:2009,分别取 PCL、pNSR32/PCL及 pNSR32/PCL/CS纳米纤维支架,按0.1 g/mL比例加入DMEM培养液,37℃浸提24 h,过滤除菌,4℃备用。
1.2.3.2 体外浸提液毒性评价
SDRAEC按一定浓度接种于96孔板,培养1 d后弃培养液,加100 μL支架浸提液继续培养。每种浸提液设4孔,以单纯培养液培养细胞作为阴性对照组。于培养1、3、5、7 d后行 MTT比色法检测,检测波长570 nm,参比波长630 nm,根据吸光值绘制细胞生长曲线,并按以下公式计算细胞相对增殖度(relative growth rate,RGR)。RGR=(样品组吸光值A/阴性对照组吸光值 A)×100%。根据细胞RGR参考评价标准[12],对支架材料的细胞毒性进行分级。
1.2.4 SDRAEC粘附率的测定
将一定大小体积的 PCL、pNSR32/PCL及pNSR32/PCL/CS纳米纤维支架置于24孔板中,设3个复孔,另设细胞培养板(TCP)和盖玻片(coverslip)分别为阴性、阳性对照组。SDRAEC按一定浓度接种,37℃、5%CO2培养箱培养。分别于4、8 h MTT比色法检测,检测波长570 nm,参比波长630 nm,按以下公式计算初期粘附率。初期粘附率=实验组吸光值A/阴性对照组吸光值A×100%。
1.2.5 SDRAEC增殖力的测定
将一定大小体积的 PCL、pNSR32/PCL及pNSR32/PCL/CS纳米纤维支架置于24孔板中,设3个复孔,另设盖玻片(coverslip)为阳性对照组。SDRAEC按一定浓度接种,37℃、5%CO2培养箱培养。分别于1、3、5、7 d MTT比色法检测,检测波长570 nm,参比波长630 nm,绘制细胞在不同材料上的增殖曲线。
1.2.6 SDRAEC表型表达的检测
将一定大小体积的pNSR32/PCL/CS纳米纤维支架置于24孔板中,SDRAEC按一定浓度接种,5 d后免疫荧光染色。免疫荧光染色步骤简述如下:弃培养液,PBS洗涤,4%多聚甲醛固定;PBS洗涤,加入0.1%Triton X-100处理;PBS洗涤,5%山羊血清封闭1 h;PBS洗涤,分别加入一抗(兔抗鼠 CD31、vWF因子 1∶100),4℃ 孵育过夜;PBS洗涤,加入FITC标记的羊抗兔 IgG二抗(1∶50),37℃孵育30 min,DAPI复染细胞核。荧光显微镜观察,拍照。
1.2.7 统计分析
运用SPSS13.0统计软件,所有数据采用均数±标准差(x±S)表示;应用方差分析法,P<0.05为差异具统计学意义。
2 结果
2.1 浸提液毒性试验
细胞分别用 PCL、pNSR32/PCL和 pNSR32/PCL/CS材料浸提液培养,与阴性对照组类似,细胞保持正常形态,折光性强,贴壁、增殖良好。表1为MTT比色法测定 PCL、p NSR32/PCL和 pNSR32/PCL/CS支架材料浸提液毒性的结果。
结果显示,随着培养时间的延长,各组细胞数量逐渐增加,不同时间点吸光值有显著差异(P <0.05)。组间相比较,PCL组7 d、p NSR32/PCL组1、3、5 d、pNSR32/PCL/CS 组 1、3 d 的吸光值与对照组相比较具有统计学意义(P<0.05)。
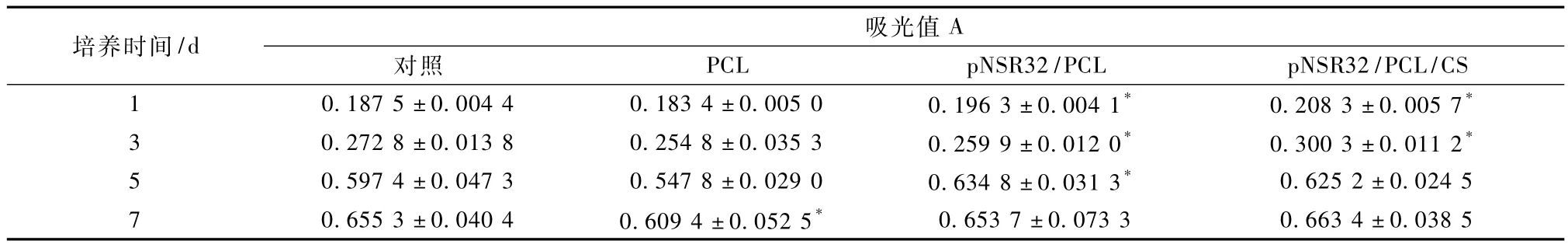
表1 MTT法检测不同支架材料浸提液毒性(A=OD570nm-OD630nm,x±S)Tab.1 Cytotoxicity test of extracts with various materials by MTT
细胞在各支架材料浸提液中的细胞生长曲线见图1。各实验组细胞的生长趋势均与对照组类似,1~3 d细胞生长缓慢,3~5 d细胞呈指数生长,5~7 d细胞生长又趋于缓慢,显示细胞生长状态良好。从细胞生长曲线分析pNSR32/PCL/CS、pNSR32/PCL组细胞未受抑制,但 PCL组略受影响。
细胞相对增殖度与毒性等级评价见表2。用RGR对细胞毒性进行分析,各支架材料毒级均低于1级,说明各材料浸提液均不显示细胞毒性,适合细胞生长,符合组织工程支架材料的应用要求。
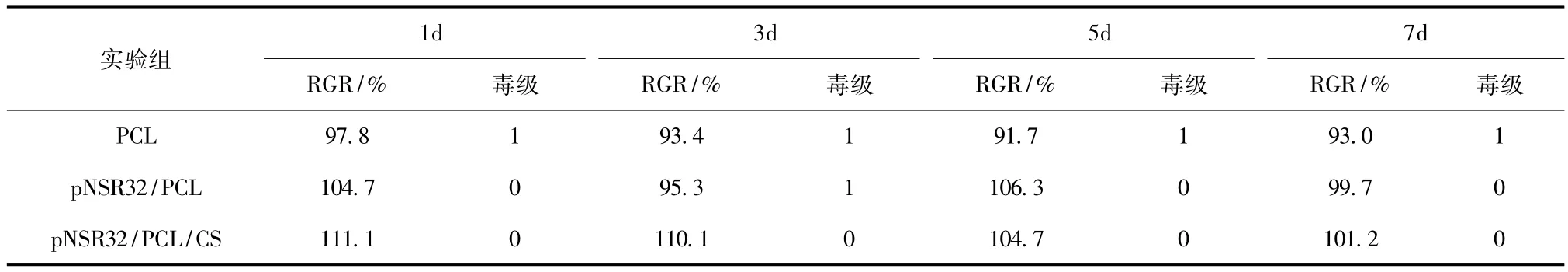
表2 不同支架材料浸提液的细胞相对增殖度与毒性等级评价Tab.2 The RGR and cytotoxicity test of extracts with various materials
2.2 细胞粘附情况
除了评价支架材料的细胞毒性,细胞与支架材料间作用最重要的方面是细胞粘附[13]。MTT法检测细胞粘附的结果如图2和表3所示。
图2所示为在考察的4 h内,SDRAEC可粘附到各实验组材料及对照组上。随培养时间延长,各组细胞粘附量均有所增加,其中 pNSR32/PCL及pNSR32/PCL/CS组4 h吸光值与8 h相比较具有统计学差异(P<0.05)。组间比较,4 h时 p NSR32/PCL/CS、pNSR32/PCL组及 TCP组细胞粘附量较多,PCL组及载玻片组粘附量较少。8 h时,pNSR32/PCL/CS、pNSR32/PCL组吸光值仍大于其他各组,与盖玻片组相比差异显著(P<0.05),与TCP组无显著性差异(P>0.05)。在考察时间内,作为阳性对照组的盖玻片组吸光值在各时间点均小于其他组,说明其细胞粘附能力较低。从表3中也可看出,无论4 h还是8 h,SDRAEC在 pNSR32/PCL/CS支架上的粘附率均超过100%,说明SDRAEC在该支架材料表面粘附性良好。
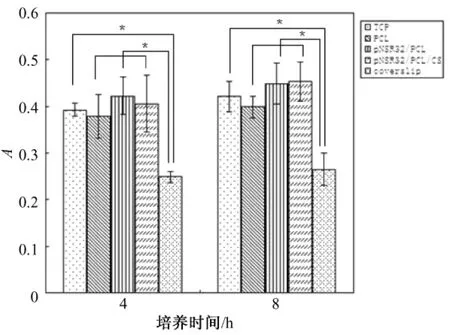
图2 SDRAEC在不同支架材料上的粘附趋势图(A=OD570nm-OD630nm)Fig.2 SDRAEC adhesion on various materials
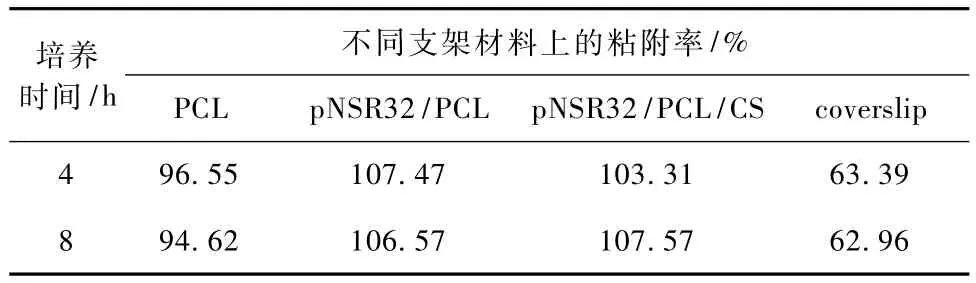
表3 SDRAEC在不同支架材料上的粘附率Tab.3 The rate of SDRAEC adhesion on various materials
2.3 细胞增殖情况
表4为MTT法测定SDRAEC增殖活力的结果。在培养的7 d内,随时间延长,各组细胞数量都有所增加:7 d>5 d>3 d>1 d。在各检测时间点,含有RGD蛛丝蛋白的 pNSR32/PCL/CS及pNSR32/PCL组与PCL及阳性对照组相比,细胞增殖活力差异显著(P<0.05),RGD蛛丝蛋白的添加明显促进了细胞增殖;含有壳聚糖的 pNSR32/PCL/CS组吸光值大于 p NSR32/PCL组,3、5、7 d吸光值差异显著(P<0.05),提示其细胞活性在实验组中最好,细胞代谢活力较高,说明壳聚糖对SDRAEC增殖有较好的支持作用。整体观之,3种支架材料对SDRAEC增殖能力的促进作用依次为pNSR32/PCL/CS>pNSR32/PCL>PCL。
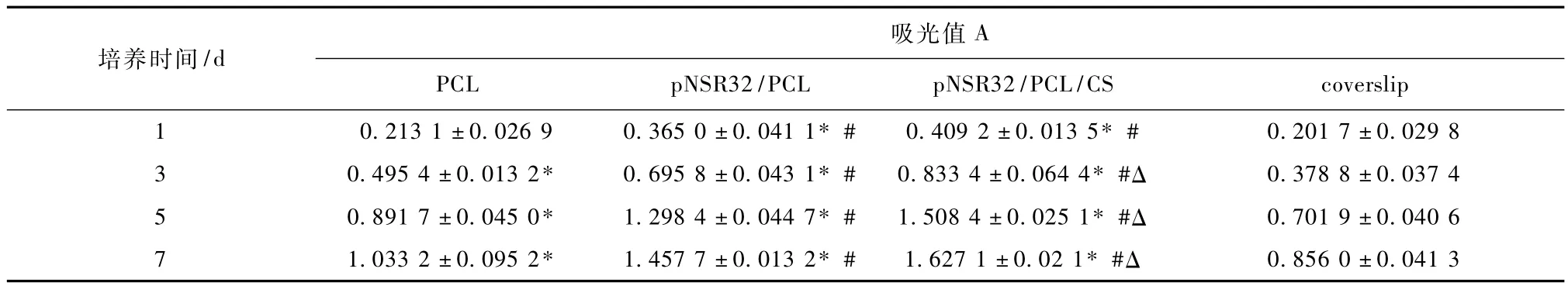
表4 SDRAEC在不同支架材料上的增殖状况(A=OD570nm-OD630nm,x±S)Tab.4 SDRAEC proliferation on various materials
图3所示是SDRAEC在各支架材料上的增殖曲线,细胞增殖速率及生长曲线形状因复合培养材料不同而异,但基本符合SDRAEC生长曲线。从第3 d起,p NSR32/PCL/CS及 p NSR32/PCL组细胞进入对数生长期,生长速率较快,生长曲线在该时段更为陡峭;5 d后,pNSR32/PCL/CS及 pNSR32/PCL支架材料上细胞生长速率降低,进入平缓期。同时,在平缓期又以 pNSR32/PCL/CS材料上的细胞数量居多,这说明 pNSR32/PCL/CS支架材料较适合内皮细胞增殖。
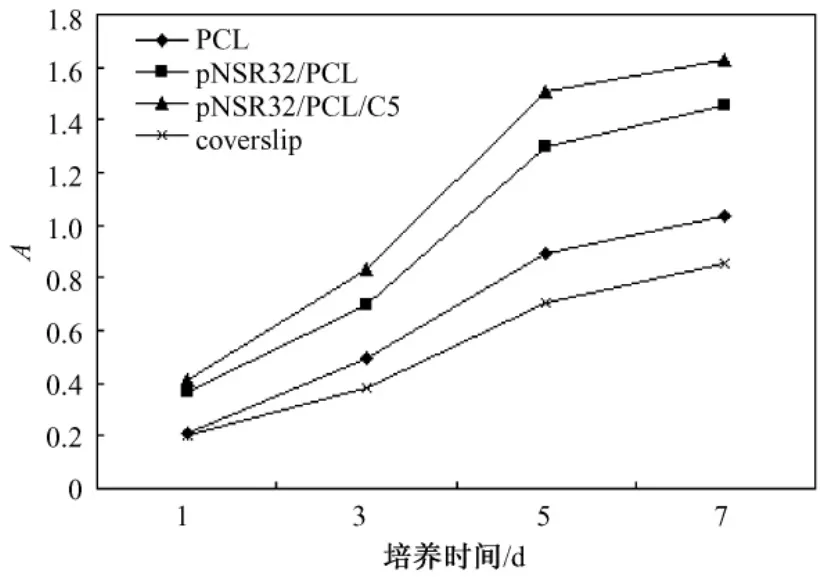
图3 SDRAEC在不同支架材料上的增殖曲线(A=OD570nm-OD630nm)Fig.3 SDRAEC proliferation curve on various materials
2.4 SDRAEC表型表达
如图4所示,荧光显微镜下观察到与p NSR32/PCL/CS支架共培养5 d的SDRAEC强烈表达内皮细胞标志物-vWF、CD31因子定位于细胞浆,可见其细胞生物学特性未受影响。
3 讨论
材料对宿主细胞生长的影响即细胞相容性,一直是评价支架材料生物相容性的关键指标之一[14]。为了评价本研究所制备的pNSR32/PCL/CS复合纳米纤维的细胞相容性,本研究选择体外细胞培养法,该法是医疗器械生物学安全性评价标准ISO10993中的规定项目,是生物材料进入临床前的必要评价[15]。通过材料与细胞体外复合培养,可直接观察细胞生长情况,利于对细胞与材料相互作用的了解,有助于组织工程支架材料的筛选[16]。实验采用MTT法检测了材料浸提液细胞毒性、细胞粘附及增殖状况,并通过免疫荧光染色法分析细胞表型表达,从而评价该材料是否适合SDRAEC粘附、生长、增殖和功能发挥。

图4 与pNSR32/PCL/CS支架共培养5 d的SDRAEC表型表达。(a)vWF;(b)CD31(200×)Fig.4 Phenotypic expression of SDRAEC on pNSR32/PCL/CS scaffolds at 5 days after cell seeding.(a)vWF;(b)CD31(200×)
ISO10993中推荐的四甲基偶氮唑盐(MTT)比色法以其简便迅速、敏感性强等特点在检测细胞毒性方面得到广泛应用。同时,本实验中采用内皮细胞用于细胞毒性试验,增加了材料毒性评价的敏感性,材料浸提液或材料与其特定植入部位的靶细胞(内皮细胞)相互作用,反映材料细胞毒性的同时还能反映材料对细胞增殖、分化等功能的影响[17]。结果显示pNSR32/PCL/CS浸提液对SDRAEC形态无明显影响,对细胞增殖无明显抑制作用,细胞毒性分级为0级,符合ISO10993中对体内植入材料的要求,表明这种材料无明显细胞毒性[18],为进一步进行动物体内实验奠定了基础。
细胞与支架材料的相互作用是组织工程研究的重要领域,相互作用的第一阶段正是细胞在材料上的粘附与铺展,而细胞增殖是相互作用初期的生物学行为之一。细胞粘附的差异将影响细胞的增殖、分化等功能,细胞增殖作为细胞粘附铺展与功能分化的中间纽带,会给材料与机体结合的长期效果带来十分巨大的影响[19]。细胞在材料表面的粘附、增殖差异是由生物材料的多种性质决定的,如材料表面形态、化学状态和元素组成等[20]。本研究中pNSR32所含RGD短肽是细胞粘附增殖的关键,其序列可被固有粘附蛋白受体特异性结合,在材料表面自发形成分子层,从而为种子细胞提供特异性位点,促进细胞粘附和分化[1]。同时壳聚糖带正电荷,有利于带负电荷的细胞吸附。此外,羧基、羟基、表面亲水性氨基以及多孔支架与细胞间的相互作用也是促进细胞粘附增殖的可能机理[21]。Healy等采用多种肽类活性因子修饰生物材料表面时发现,能够促进细胞粘附的修饰方法往往也会促进细胞在材料表面的增殖[22]。Liu等在研究由生物活性因子GRGDS五肽所修饰的聚(L-丙交酯-β-苹果酸)对人脐静脉内皮细胞的作用时,也发现了类似的结果[23]。本研究基于静电纺丝技术制备的 p NSR32/PCL/CS复合纳米纤维支架也能够支持SDRAEC在材料表面粘附,有效地促进其增殖,保持血管内皮细胞的生长规律。
内皮细胞能合成与代谢多种激素和血管活性物质,如血管性假血友病因子(von Willebrand Factor,vWF)、血小板内皮细胞粘附分子-1(platelet endothelial cell adhesion molecule,PECAM-1C D31)、前列腺素等[24-26]。其中 vWF为内皮细胞合成的依赖性因子之一,主要生理功能有介导内皮细胞粘附、迁移;携带凝血因子Ⅷ,促进其合成和分泌,保护其免受灭活;调节血小板粘附、聚集等[24]。CD31与Ca2+依赖性粘附分子共同构成内皮细胞的粘附连接,是血管内皮细胞层通透屏障的重要结构基础,同时CD31还介导内皮细胞运动,调节内皮细胞增殖及血管新生[25-26]。本研究应用细胞免疫荧光法,试图从细胞功能发挥方面评价材料的细胞相容性。试验中vWF、CD31因子的阳性表达说明其生物学特性未受影响。此外,实验结果显示的细胞形态及覆盖范围,说明该电纺支架具备粘附内皮细胞的能力,能为内皮重建提供一个适宜的生理生化环境。
4 结论
1)添加RGD-重组蛛丝蛋白及壳聚糖能够促进SDRAEC在材料表面的增殖,对组织工程中改善材料表面生物相容性及生物活性提供了新的思路和方法。
2)pNSR32/PCL/CS复合纳米纤维小直径血管支架对SDRAEC的生长无明显毒性,具有良好的细胞相容性,能够支持SDRAEC在材料表面粘附、增殖,保持表型表达,为该支架的基础研究及临床应用提供了生物学依据。
[1]Venkatraman S, Boey F, Lao LL, et al. Implanted cardiovascular polymers: Natural, synthetic and bio-inspired[J].Prog Polym Sci,2008,33(9):853-874.
[2]Sarkar S,Schmitz-Rixen T,Hamilton G,et al.Achieving the ideal properties for vascular bypass grafts using a tissue engineered approach:a review[J].Med Biol Eng Comput,2007,45(4):327-336.
[3]Ju YM,Choi JS,Atala A,et al. Bilayered scaffold for engineering cellularized blood vessels[J].Biomaterials,2010,31(15):4313-4321.
[4]Soffer L,Wang Xianyan,Zhang Xiaohui,et al.Silk-based electrospun tubular scaffolds for tissue engineered vascular grafts[J].J Biomater Sci Polym Ed.2008,19(5):653-664.
[5]Stitzel J,Liu Jie,Lee SJ,et al.Controlled fabrication of a biological vascular substitute[J].Biomaterials,2006,27(7):1088-1094.
[6]Shin H,Jo S,Mikos AG.Modulation of marrow stromal osteoblast adhesion on biomimetic oligo[poly(ethylene glyco1)fumarate]hydrogels modified with Arg-Gly-Asp peptides and a poly(ethyleneglyco1)spacer[J].J Biomed Mater Res,2002,61(2):169-179.
[7]阮超然,黄晶星,魏梅红,等.高分子量 RGD-蛛丝蛋白重组体构建、高密度发酵及纯化[J].生物工程学报,2007,23(5):858-861.
[8]薛正翔,陈登龙,李敏,等.静电纺丝制备小直径血管支架及其血液相容性的研究[J].功能材料,2009,10(40):1716-1719.
[9]李敏,陈登龙,吴钦缘.静电纺丝仪[P]. CN:200610125960.6,2006.
[10]郑剑,吴琳琳,李敏.乳糖诱导高分子量重组蛛丝蛋白发酵培养基优化[J].中国生物工程杂志,2008,28(12):41-46.
[11]魏梅红.RGD-重组蛛丝蛋白聚己内酯复合支架材料的研究[D].福建:福建师范大学,2009.
[12]干旻峰,杨惠林.丝素蛋白对可注射磷酸钙骨水泥细胞相容性的影响[J].中国组织工程研究与临床康复,2009,13(3):427-431.
[13]王培伟.基于静电纺丝技术组织工程支架的生物相容性研究[D].上海:东华大学,2007.
[14]郑琪,奚廷斐,陈艳梅,等.纳米羟基磷灰石/细菌纤维素复合材料及其降解物的细胞相容性评价[J].中国组织工程研究与临床康复,2010,14(3):405-409.
[15]Kirkpatrick CJ,Bittinger F,Wagner M,et al.Current trends in biocompatibility testing[J].Proc Inst Mech Eng H,1998,212(2):75-84.
[16]尚娟芳.成骨细胞与聚乳酸和改性聚乳酸材料相容性实验研究[D].重庆:重庆大学,2005.
[17]岳进,雷德林,郭大刚,等.组织工程骨支架的材料学:短棒状纳米羟基磷灰石的细胞毒性检测[J].中国临床康复,2005,9(2):32-33.
[18]石国华,丁诚,龚连生,等.壳聚糖/羟基磷灰石纳米复合材料修复骨缺损研究[J].中国现代医学杂志,2007,17(19):2322-2325.
[19]Lkada Y. Surface modification of polymers for modical applications[J].Biomaterials,1994,15(10):725-736.
[20]Wang Yingjun, Yang Chunrong, Chen Xiaofeng, et al.Development and characterization of novel biomimetic composite scaffolds based on bioglass-collagen-hyaluronic acid-phosphatidylserine for tissue engineering applications[J].Macromol Mater Eng,2006,291(3):254-262.
[21]唐晓军,归来,吕晓迎.天然羟基磷灰石/壳聚糖复合材料细胞相容性研究[J].中国美容医学,2008,17(6):855-858.
[22]Heaty KE,Rezania A,Stile RA.Designing biomaterials to direct biological responses[J].Ann N Y Acad Sci,1999,875:24-35.
[23]Liu Yuan,Wang Wei,Wang Jun,et al.Blood compatibility evaluation of poly(d,l-lactide-co-beta-malic acid)with the GRGDS sequence[J].Colloids and Surfaces B:Biointerfaces,2010,75(1):370-376.
[24]Ruggeri ZM.Von Willebrand factor[J].Curr Opin Hematol,2003,10(2):142-149.
[25]Brown S,Heinisch I,Ross E,et al.Apoptosis disable CD31-mediated cell detachment from phagocytes promoting binding and engulfment[J].Nature,2002,418(6894):200-203.
[26]Yun PL, Decarlo AA, Chapple CC, et al. Functional implication of the hydrolysis of platelet endothelial cell adhesion molecule-1(CD31)by gingipains of Porphyromonas gingivalis for the pathology of periodontal disease[J].Infect Immun,2005,73(3):1386-1398.

