一种水产养殖用微生物制剂的研究
朱将伟
当前,水产养殖行业中多采用集约化养殖方式,养殖水体水质恶化是目前所面临的迫切需要解决的问题之一。水质恶化不仅直接危害养殖对象,而且还可能诱发各种疾病而放大危害。随着养殖面积增加,养殖布局密集,水源不足和水源污染已大大限制了换水的频率和数量;用化学药物(如抗生素)在防治病害的同时也产生了诸如细菌耐药性、药物污染、药物残留以及生态系统受损等很多新的问题。Kozasa[1]于1986年首次将微生物制剂应用于水产养殖领域,他利用东洋芽孢杆菌(Bacillus toyoi)处理鳗鲡,降低了由爱德华菌引起的死亡率,该研究为解决水产养殖中所遇到的问题提供了一条新的路径。近年来,复合微生物活菌制剂以其安全、无毒副作用、环保、无残留等优越性愈来愈受到重视,应用微生物活菌制剂治理养殖污染、改善养殖环境、提高养殖质量成为研究的热点。本试验研制了一种复合微生物制剂,并将其应用于养殖水体的水质改良,取得了较好的效果。
1 材料与方法
1.1 材料
1.1.1 菌种
枯草芽孢杆菌(Bacillus subtilis)、干酪乳杆菌(Lactobacillus casei)、沼泽红假单胞菌(Rhodopseudomonas palustris)、啤酒酵母(Saccharomyces cerevisiae)。其中干酪乳杆菌和沼泽红假单胞菌菌株购自中国农业科学院,其余菌株为自行分离并保存的菌株。
1.1.2 试剂
碘化钾、碘化汞、氢氧化钠、重铬酸钾、硫代硫酸钠、碘、可溶性淀粉、抗坏血酸:分析纯,由国药集团化学试剂有限公司提供;氯化铵:优级纯,由Sigma-Aldrich生产;浓硫酸、浓盐酸:分析纯,由上海金山化工厂提供。
1.1.3 仪器
光照振荡培养箱(华美QHZ-98B,中国太仓制造),紫外可见分光光度计(岛津UV-2450,日本制造),冷冻干燥机 (Christ ALPHA 2-4 LSC,德国制造),鼓风干燥箱(DHG-9149A,上海生产),超净工作台(ESCO SCV-4A1,新加坡制造),离心机(Sigma 3K30,德国制造),pH计(梅特勒S20K,瑞士制造),溶氧仪(梅特勒SG6,瑞士制造)。
1.2 复合微生物制剂的制备
1.2.1 菌种的液体发酵
首先将各菌种在其适宜的培养条件下活化培养,再分别将其接种到培养基中扩大培养至对数生长期,调节OD600=1.5(若OD600>1.5,用培养液稀释至OD600=1.5;若OD600<1.5可先离心后移去部分上清液,再调整至OD600=1.5),最后取相同体积的各菌株培养液混合,待干燥。
培养液配方:牛肉膏2 g、蛋白胨3 g、酵母膏1 g、马铃薯全粉(粉末)10 g、葡萄糖 15 g、NaCl 2 g、醋酸铵 2 g、KH2PO40.5 g、MgSO4·7H2O 0.2 g、FeSO4·7H2O 0.01 g、水 1 000 ml,pH 值 7.0,121 ℃灭菌 30 min。
1.2.2 菌种的真空冷冻干燥
上述待干燥混合菌液在4℃下经5 000 r/min离心10 min,移去上清液,加入冻干保护剂(配方为:脱脂乳粉10%、甘油8%的生理盐水溶液),混匀制成菌悬液。-76℃预冻2 h,后将冻结样品移入真空冷冻干燥机中冷冻干燥,使菌粉含水量≤3%。
1.3 复合微生物制剂菌体部分的营养成分测试
取待干燥的混合菌液在4℃下经5 000 r/min离心10 min,移去上清液;然后加入与移去的上清液等量的蒸馏水,混匀后5 000 r/min离心10 min,再移去上清液,重复两次,以充分去除培养基成分。收集经过离心、洗涤的菌体,先将菌体在80℃下干燥1 h,后以105℃恒温保持3 h以上至恒重,然后迅速置于干燥器中冷却备用。准确称取烘干的菌体,按照张晓琦(2007)[2]所述方法测定其粗蛋白、粗脂肪及粗纤维等。
1.4 复合微生物制剂对养殖水体的改良
模拟养殖池塘的尺寸是1 m×1 m×1 m;水源来自上海郊区垂钓场鲫鱼养殖池的养殖用水;池水深70 cm,每池放养15条约250 g的鲫鱼,水温控制在20~25℃,每个池上方安装1只100 W白炽灯作为自然光的补充(灯光在晚上7点至次日早晨7点关闭)。模拟池塘共设4组,每组3个重复,其中对照组不添加微生物制剂,第1、2、3组为试验组,添加复合微生物制剂的浓度分别为2、4和6mg/l。每隔3 d在各池的表层、中层、底层取样,测定pH值、溶氧、氨态氮、亚硝态氮和硫化物含量,取平均值作为测定结果,连续测试12 d,比较水质的动态变化情况。水质监测中各项指标按水和废水监测分析方法[3]进行。氨氮(NH4+-N)采用纳氏试剂分光光度法;亚硝态氮(NO2--N)采用萘乙二胺分光光度法;硫化物采用亚甲基蓝分光光度法。
2 结果与讨论
2.1 微生物制剂菌体部分的营养成分
研究选用的4种微生物菌株均属于农业部第105号公告中允许使用的饲料级微生物,以保证所开发的微生物制剂不会对养殖动物产生有害影响,并且能对养殖动物起到一定的营养或保健作用。微生物制剂菌体部分的营养成分测试结果见表1,由表1中数据可以看出,其菌体粗蛋白含量高于大豆(大豆蛋白常是饲料中蛋白的主要来源),粗脂肪和粗纤维含量则与玉米相当,由此推断该微生物制剂菌体部分的营养成分十分丰富,可能对养殖动物有很好的营养作用。
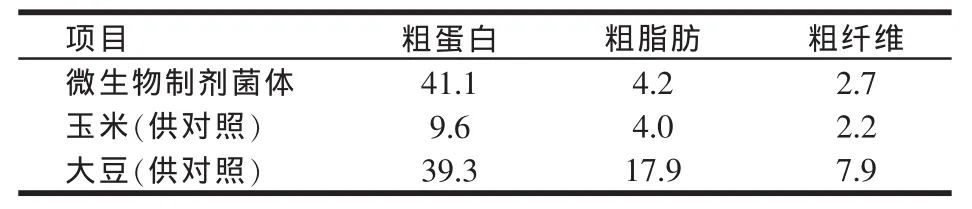
表1 复合微生物制剂菌体部分的营养成分(%)
2.2 复合微生物制剂对养殖水体水质的影响
2.2.1 复合微生物制剂对水体pH值的影响(见图1)
投加不同浓度的微生物制剂对pH值并没有产生显著影响(P>0.05),另外,各试验组与没有投加微生物制剂的对照组之间的差异也不显著(P>0.05)。在试验的12 d内,养殖水体的pH值在7.59~7.78之间,该pH值适宜于大多数水产品的养殖(鱼类能安全生活的pH值是7.0~8.5之间)。由此认为,在以上试验条件下,是否投加微生物制剂或者投加不同剂量的微生物制剂对于养殖水体pH值的改善没有明显意义。但是,在实际养殖过程中,其养殖周期要远远大于12 d,投加微生物制剂对于养殖水体pH值的后期改善是否会产生作用还有待进一步试验。

图1 不同浓度的微生物制剂对养殖水体pH值的影响
2.2.2 复合微生物制剂对养殖水体中溶解氧的影响(见图2)
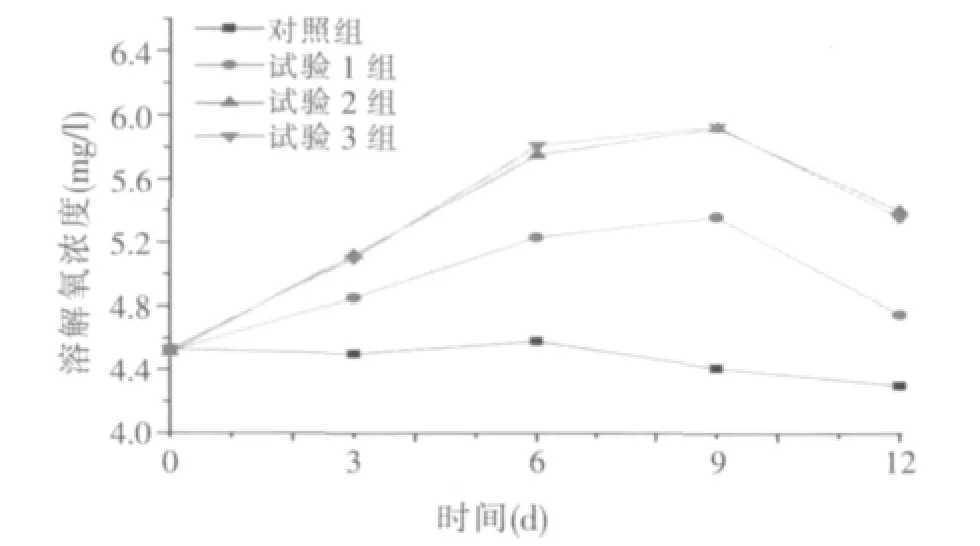
图2 不同浓度的微生物制剂对养殖水体中溶解氧的影响
由图2可知,投加微生物制剂后显著增加水中的溶解氧,各试验组比对照组均有显著增加(P<0.05),据此可以认为,微生物制剂使用后有增加养殖水体溶解氧的作用。当微生物制剂投加量为4mg/l或6mg/l时,其增加溶解氧的量会显著高于投加量为2mg/l时。但是投加量由4mg/l增至6mg/l时,水中溶解氧量没有明显变化,这可能意味着投加量为4mg/l时,该微生物制剂即能发挥其最大的增加溶解氧的功能。投加微生物制剂后溶解氧会持续增加到第9 d后开始下降,可能是由菌群中各种微生物数量比例因竞争或外界因素的影响而发生动态变化引起。
2.2.3 复合微生物制剂对养殖水体中氨氮的影响(见图3)
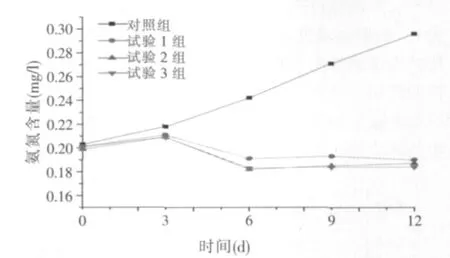
图3 不同浓度的微生物制剂对养殖水体中氨氮的影响
由图3可以看出,没有投加微生物制剂的对照组随着时间的推延,水中的氨氮含量持续上升,经历12 d后氨氮含量约增加50%。但是投加微生物制剂后,则可明显导致水中的氨氮含量减少并维持在一定范围。测试结果显示,各试验组比对照组均有非常显著差异(P<0.01),据此可以认为,该微生物制剂使用后有降低养殖水体中氨氮含量的作用。当微生物制剂投加量为4mg/l或6mg/l,其降低氨氮的作用会略高于投加量为2mg/l组,但差异不显著。另外,从图3中也能看出,使用微生物制剂后,水中氨氮含量并没有立即下降,开始3 d仍然呈升高趋势,这可能是由于投加微生物制剂后其中的一些微生物菌株有一个适应新环境的过程,还没有得到充分的生长繁殖,其发挥的降低氨氮的作用较小;经历一段时间后,微生物菌株的生长和繁殖将更加充分,显示出显著降低水中氨氮的作用,后期微生物菌株将进一步与水体环境相适应,形成一个相对稳定的平衡体系,最终将水中氨氮维持在一个较低的水平,这将有利于水中鱼类的正常生长。
2.2.4 复合微生物制剂对养殖水体中亚硝态氮的影响(见图4)
由图4可知,没有投加微生物制剂的对照组随着时间的推延,水中的亚硝态氮含量持续上升,持续升高12 d后亚硝态氮含量约增加150%左右;投加微生物制剂后,尽管水中的亚硝态氮含量仍有一个上升的过程,但其上升的幅度明显降低。测试结果显示,各试验组比对照组均有极显著差异(P<0.01),因此推测该微生物制剂使用后对降低水中亚硝态氮含量有一定作用。当微生物制剂投加量从2mg/l增加至6mg/l时,其降低亚硝态氮的作用会有一定变化,但统计表明差异不显著(P>0.05)。据报道,一些芽孢杆菌、光合细菌具有去除水中亚硝酸盐的作用,存在于微生物制剂中的枯草芽孢杆菌、沼泽红假单胞菌或者水体中的某些天然菌株可能具有降低水中亚硝态氮的作用[4-5]。另外,根据经验推测,某些具有降低水中亚硝态氮作用的天然菌株由于在原始环境中并不占优势,使其发挥的作用十分有限,但是在投加人工微生物制剂后,原有的微生物生态体系发生变化,使非优势菌株获得生长优势进而发挥其特有功能。

图4 不同浓度的微生物制剂对养殖水体中亚硝态氮的影响
2.2.5 复合微生物制剂对养殖水体中硫化物的影响(见图5)
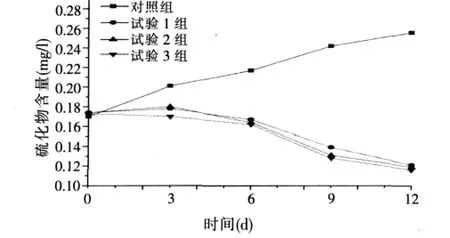
图5 不同浓度的微生物制剂对养殖水体中硫化物的影响
由图5可知,未投加微生物制剂的对照组随着时间的推延,水中硫化物含量持续上升,经历12 d后硫化物含量由0.170mg/l上升至0.256mg/l,约增加50%;但在投加微生物制剂后,则导致水中硫化物含量明显减少(12 d减少约30%)。测试结果显示,各试验组与对照组均有极显著差异(P<0.01),故该微生物制剂有减少水中硫化物的功能。据文献报道,枯草芽孢杆菌和沼泽红假单胞菌等一些细菌具有分解H2S的功能[6-7]。当微生物制剂投加量从2mg/l增加至6mg/l时,其降低水中硫化物的作用无显著变化,统计结果表明差异不显著(P>0.05)。使用微生物制剂后,水中硫化物含量下降到一个较低的水平,这无疑有利于水产品养殖。
3 小结
本研究中制备的复合微生物制剂获得了初步成功,主要表现在以下方面:①微生物制剂含有相当丰富的营养成分,能在水产养殖中起到营养水产动物的作用;②该微生物制剂能起到改善养殖水体水质的作用,能增加水中的溶解氧,显著降低氨氮、亚硝态氮、硫化物等不利于水产养殖的污染成分;③依据已经取得的水质改善的试验结果,结合相关文献资料推断[8-9],微生物制剂中所选用的菌株能对水产养殖动物起到一定的保健作用,并有利于改善水产养殖生态环境和水产品质量。尽管在该研究中获得了初步成果,但仍有一些问题需要进一步探讨,主要是:①各微生物的配比需进一步优化;②微生物制剂适用的环境条件需要探讨;③可否引入新的菌种来满足特异性需要;④微生物制剂性能的稳定性;⑤制剂中各微生物菌种之间的相互关系、与天然环境中的微生物之间的相互关系,以及产生相关功效的机理等。
[1]Kozasa M.Toyocerin(Bacillus toyoi)as growth promoter for animal feeding[J].Microbiologie Aliments Nutrition,1986,4(2):121-135.
[2]张晓琦.利用丝状真菌生产菌体饲料的初步研究 [D].哈尔滨工业大学,2007.
[3]国家环保局.水和废水监测分析方法[M]第三版.北京:中国环境科学出版社,1994.
[4]孟睿,何连生,席北斗,等.芽孢杆菌与硝化细菌净化水产养殖废水的试验研究[J].环境科学与技术,2009,32(11):28-31.
[5]汤保贵,徐中文,张金燕,等.枯草芽孢杆菌的培养条件及对水质的净化作用[J].淡水渔业,2007,37(3):45-48.
[6]张土保,许英梅,安立龙,等.养殖场中的恶臭及其营养控制措施[J].饲料工业,2009,30(7):48-52.
[7]雷爱莹,彭敏,曾地刚,等.高效净水沼泽红假单胞菌的分离和鉴定[J].广西农业科学,2005,36(1):57-58.
[8]丁丽,周维仁,章世元,等.益生菌在水产上的应用及其对鱼类肠道菌群的影响[J].饲料工业,2009,30(20):27-30.
[9]崔华平,林炜铁.固定化生物在水产养殖中的应用[J].水产科学,2008,27(4):213-216.

