MVP在口咽鳞癌中的表达及临床病理意义
邢海杰, 邓锦文, 卜平风, 王明静, 邓启华
主穹窿蛋白(major vault protein,MVP)在人体多种肿瘤细胞中表达水平较高[1],且与肿瘤化疗反应性及预后密切相关[2-3]。最近研究显示,MVP参与细胞间信号传导、细胞分化、免疫启动和细胞凋亡的调节[2,4],是肿瘤潜在的治疗靶标[5]。MVP 与口咽鳞癌关系的研究少见报道。本研究旨在检测
MVP在口咽鳞癌中的表达变化,分析其与口咽鳞癌的临床病理关系,为口咽鳞癌的临床诊治提供分子生物学依据。
1 资料与方法
1.1 一般资料 收集我院2000年4月至2009年5月收治的口咽鳞癌患者共73例,其中男69例,女4例。年龄27~73岁,中位年龄58.4岁。所有病例均经病理检查证实为鳞状细胞癌。按Broders分类,鳞癌Ⅰ级34例,Ⅱ级20例,Ⅲ级13例,未分级6例。根据UICC2002分期标准,T1 3例,T2 28例,T3 32例,T4 10例,N0 47例,N1 13例,N2 11例,N3 2例,所有病例无远处器官转移。
1.2 主要仪器及试剂 切片机及烤箱购自上海医疗仪器厂,鼠抗人MVP单克隆抗体(MVP-56)、二抗及染色剂均购自武汉博士德生物技术公司。
1.3 治疗方法 单纯手术治疗13例,其中根治切除11例,姑息切除2例;单纯放疗27例;单纯化疗4例;综合治疗29例,包括手术+放疗9例,手术+化疗3例,放疗+化疗7例,化疗+放疗10例。原发灶放疗剂量为58~70 Gy,平均剂量为66 Gy,术后放疗剂量为42~60 Gy,平均剂量为56.4 Gy。颈部放疗剂量为42~56 Gy,平均剂量为50.6 Gy,分割剂量均为2 Gy/d。化疗方案选择,DDP+5-FU+BLM方案化疗16例,DDP+5-FU方案化疗5例,泰素+DDP+5-FU方案化疗3例,化疗2~4个疗程。根据实体瘤化疗疗效评价标准,初治接受化疗的14例,完全缓解(CR)2例,部分缓解(PR)3例,化疗无效及进展9例。
1.4 MVP检测 收集所有病例组织蜡块,常规组织切片,厚度4 μm,脱水脱蜡。采用免疫组织化学法检测。操作步骤按试剂盒说明书进行,每批实验均设阴性对照,DAB显色,苏木素复染,树胶封片。
1.5 MVP表达结果判定 以细胞胞浆出现棕黄或亮黄色颗粒为染色阳性。高倍镜下任取5个视野进行计数,按阳性细胞比例分为:(-)无阳性细胞出现或阳性细胞数<10;(+)阳性细胞数10~25;(++)阳性细胞数 26~50;(+++)阳性细胞数 >50。
1.6 统计学处理 采用SPSS 10.0统计软件,应用非参数统计中独立样本检验、Spearman等级相关进行统计学分析,生存分析采用Log-Rank检验,多因素分析使用COX风险比例模型。P<0.05有统计学意义。
2 结果
2.1 MVP表达阳性率 73例患者中MVP表达阳性者49例,其中(+)14例,(++)17例,(+++)18例,MVP阳性表达率为67.1%(49/73)。阴性表达24例,阳性表达见图1。
2.2 MVP表达与口咽鳞癌临床病理关系 MVP表达水平与口咽鳞癌颈部淋巴结转移及放、化疗敏感性相关,P<0.05;MVP表达与口咽鳞癌性别、年龄、病理分化程度以及 T分期无相关性,P>0.05,见表1。患者的5年生存率分别为6.0% 和51.7%,差异有统计学意义(Log Rank=59.7,P < 0.001),见图2、3。
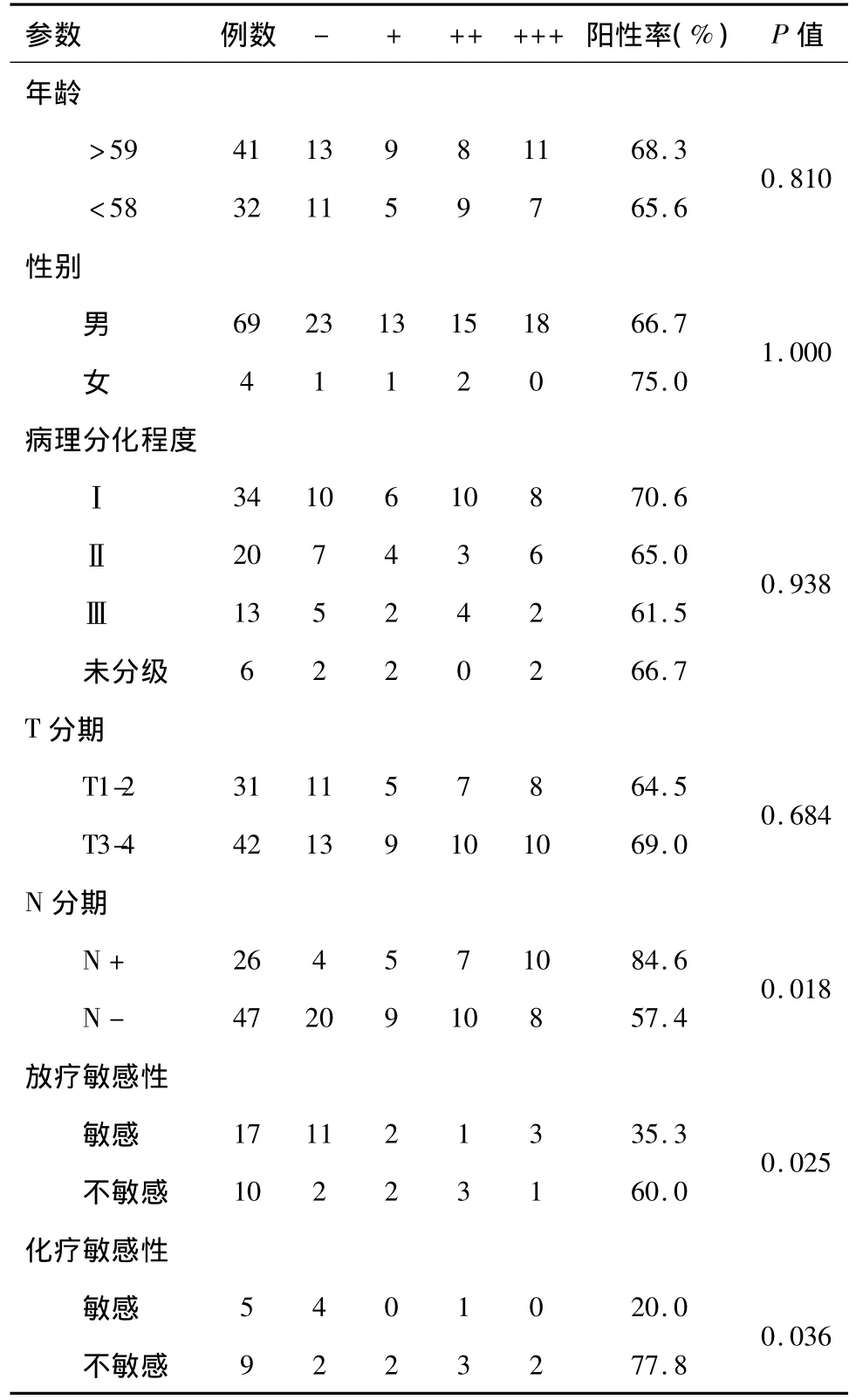
表1 MVP表达与口咽鳞癌临床病理参数的关系

图2 73例口咽鳞癌患者总生存率曲线

图3 73例MVP表达阴性和阳性患者生存率曲线
把年龄、性别、病理分化程度、肿瘤T分期、N分期、治疗方法以及MVP表达状态引入COX比例风险模型行多因素分析显示,MVP表达状态是口咽鳞癌生存的独立相关因素,P<0.001。见表2。
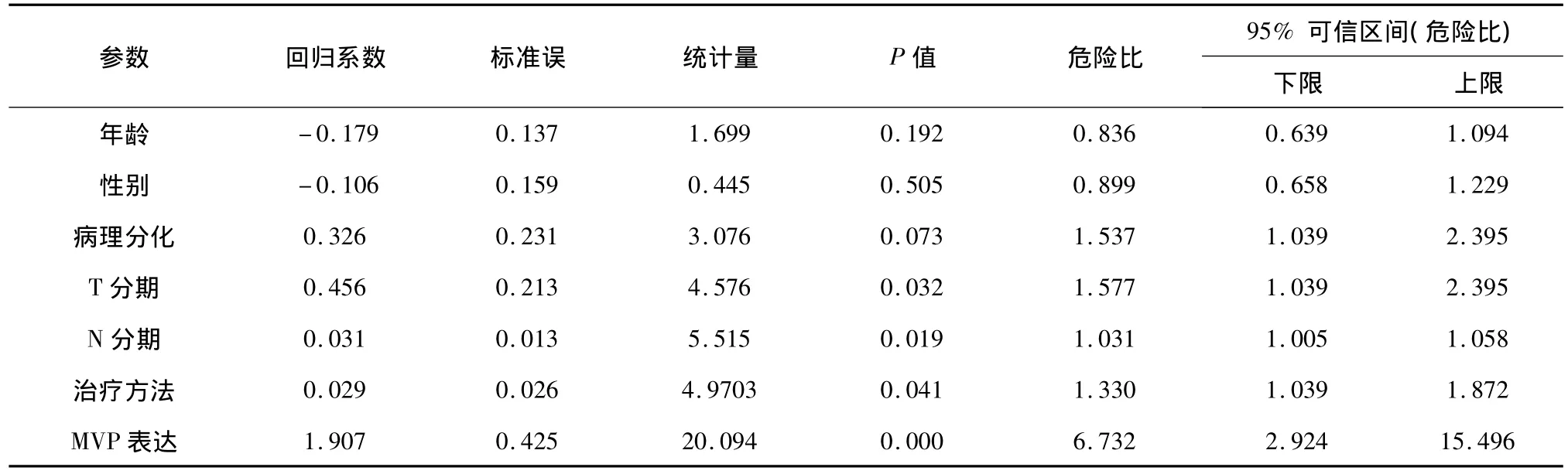
表2 MVP与口咽鳞癌预后的多因素分析结果
3 讨论
在人体多种肿瘤细胞中,MVP表达水平较高,表达阳性率为 68.6% ~ 96.7%[3,6]。本组资料中,MVP阳性表达率为67.1%,与有关报道相近,显示在口咽鳞癌细胞中,MVP的表达水平较高,MVP与口咽鳞癌的发生、发展可能存在密切关系。
3.1 MVP与肿瘤淋巴结转移 MVP表达与淋巴结转移的关系尚有不同结论。Zuo等[1]检测68例原发性乳腺癌中MVP的表达,结果显示MVP表达阳性的乳腺癌患者淋巴结转移的风险增高(P<0.05),表明MVP表达水平与淋巴结转移相关。但在食管鳞癌组织中,MVP表达水平的升高与淋巴结转移无显著相关性。
本组资料的结果显示,在颈部淋巴结转移病例中,MVP表达阳性率显著高于无颈部淋巴结转移病例(P<0.05),显示在口咽鳞癌中,MVP表达与颈部淋巴结转移存在相关性,与Zuo的结论较一致,同时也表明MVP表达与肿瘤细胞的侵袭性有关,MVP表达增高者肿瘤的侵袭性强,肿瘤转移的机率随之升高。这可能与MVP的细胞信号调节作用有关,MVP通过上调Bcl-2表达抑制细胞凋亡[7],同时,通过磷酸化途径调节上皮细胞生长因子信号,影响细胞的增殖[8],促进肿瘤细胞的转移,但其调节机制尚需进一步研究。
3.2 MVP与放疗敏感性 MVP与放疗敏感性关系的报道不多。Silva等[9]的研究显示,口咽癌中MVP表达水平变化与口咽癌放疗敏感性存在相关性,随着MVP表达水平的升高,患者的放疗敏感性降低(P<0.05)。本组资料显示,MVP表达水平较高的患者,对放疗的反应性较差,与Silva的结论较一致,但由于病例较少,无法进一步分析MVP表达水平与放疗反应性的关系。MVP表达水平影响口咽癌放射治疗敏感性的机制还不清楚。有学者认为MVP与PTEN(phosphatase and tensin homolog deleted on chromosome ten)的相互作用是重要机制之一,PTEN通过PI3K途径调节细胞生长,降低cyclin D1水平[10],高表达的MVP促进PTEN自胞浆转运至胞核,在 G0~G1期达峰值,S期下降,延长细胞周期[11],使放、化疗作用于分裂期肿瘤细胞,而处于静止期的肿瘤细胞易于出现放疗耐受[12]。
另一方面,放射线可增加MVP磷酸化,与COP1(photomorphogenic protein 1)分离,下调c-Jun转录,MVP与c-Jun作用进一步调节AP-1(activator protein-1)活性,抑制肿瘤细胞生长,有利于细胞修复潜在的致死性损伤,降低肿瘤细胞对药物和放射治疗的敏感性[13],同时,DNA损伤增强 MVP启动子活性,促进 MVP 水平的提高[14]。
3.3 MVP与化疗敏感性的关系 目前认为,MVP高表达肿瘤对化疗敏感性较差,主要与MVP的浆-核转运功能有关,MVP可把进入胞核内的细胞毒药物转输至胞浆,使细胞毒药物失去抗肿瘤靶标[15]。本组资料只有14例患者初治接受化疗,5例有效,虽然分析显示MVP与肿瘤的化疗敏感性有关(P<0.05),但仍需进一步积累资料观察。
在口咽鳞癌发生过程中致癌和抑癌因素的选择作用使MVP高表达的肿瘤细胞更易于存活并增殖,即MVP表达阳性的肿瘤细胞更易转运外源或内源性抑癌物质从而减轻对癌细胞核的毒性,使该癌细胞更易于存活和增殖,这也与MVP的生理功能相吻合。
3.4 MVP与口咽鳞癌预后 MVP表达与多种肿瘤的预后相关[16]。在卵巢癌和成人急性粒细胞白血病中,MVP表达可以作为独立的化疗反应性和预后的预测指标[3,17]。
本组患者5年总生存率为24.2%,MVP表达阳性和阴性患者的5年生存率分别为6.0%和51.7%(P < 0.001),与 Silva 等[9,18]的结论一致。随着MVP表达水平的升高,口咽鳞癌的放疗、化疗敏感性下降,临床疗效降低,预后变差。多因素分析结果也显示,MVP表达阳性是口咽鳞癌预后的独立预测因素(P<0.001),这一结果显示通过检测MVP的表达可评估口咽鳞癌的临床治疗效果和预后,值得进一步深入研究。
本研究显示,MVP与口咽鳞癌的淋巴结转移和放、化疗反应性以及预后密切相关,进一步探讨MVP与口咽鳞癌发生的关系,有利于弄清口咽鳞癌的发展变化,为口咽鳞癌早期诊断和有效治疗提供有意义的生物学评估指标。
[1] 左文述,魏玲,宋现让,等.浸润性乳腺癌组织中P-糖蛋白以及肺耐药蛋白和多药耐药相关蛋白表达的临床意义[J].中华医学杂志,2006,86(44):3142-3145.
[2] Steiner E,Holzmann K,Elbling L,et al.Cellular functions of vaults and their involvement in multidrug resistance[J].Curr Drug Targets,2006,7(8):923-934.
[3] Lloret M,Lara PC,Bordón E,et al.MVP expression is related to IGF1-R in cervical carcinoma patients treated by radiochemotherapy[J].Gynecol Oncol,2008,110(3):304-307.
[4] Ikeda R,Iwashita K,Sumizawa T,et al.Hyperosmotic stress upregulates the expression of major vault protein in SW620 human colon cancer cells[J].Exp Cell Res,2008,314(16):3017-3026.
[5] Ryu SJ,Park SC.Targeting major vault protein in senescence-associated apoptosis resistance[J].Expert Opin Ther Targets,2009,13(4):479-484.
[6] 李建辉,侯东祥,郭党学,等.MRP和LRP的表达与食管鳞癌临床病理特征的关系[J].西安交通大学学报(医学版),2005,26(4):377-380.
[7] Ryu SJ,An HJ,Oh YS,et al.On the role of major vault protein in the resistance of senescent human diploid fibroblasts to apoptosis[J].Cell Death Differ,2008,15(11):1673-1680.
[8] Kolli S,Zito CI,Mossink MH,et al.The major vault protein is a novel substrate for the tyrosine phosphatase SHP-2 and scaffold protein in epidermal growth factor signaling[J].J Biol Chem,2004,279(28):29374-29385.
[9] Silva P,West CM,Slevin N,et al.Tumor expression of major vault protein is an adverse prognostic factor for radiotherapy outcome in oropharyngeal carcinoma[J].Int J Radiat Oncol Biol Phys,2007,69(1):133-140.
[10] Chung JH,Eng C.Nuclear-cytoplasmic partitioning of phosphatase and tensin homologue deleted on chromosome 10(PTEN)differentially regulates the cell cycle and apoptosis[J].Cancer Res,2005,65(18):8096-8100.
[11] Chung JH,Ginn-Pease ME,Eng C.Phosphatase and tensin homologue deleted on chromosome 10(PTEN)has nuclear localization signal-like sequences for nuclear import mediated by major vault protein[J]. Cancer Res,2005,65(10):4108-4116.
[12] Lohrer HD.Regulation of the cell cycle following DNA damage in normal and Ataxia telangiectasia cells[J].Experientia,1996,52(4):316-328.
[13] Yi C,Li S,Chen X,et al.Major vault protein,in concert with constitutively photomorphogenic 1,negatively regulates c-Junmediated activator protein 1 transcription in mammalian cells[J].Cancer Res,2005,65(13):5835-5840.
[14] Shimamoto Y,Sumizawa T,Haraguchi M,et al.Direct activation of the human major vault protein gene by DNA-damaging agents[J].Oncol Rep,2006,15(3):645-652.
[15] Brugger D,Brischwein K,Liu C,et al.Induction of drug resistance and protein kinase C genes in A2780 ovarian cancer cells after incubation with antineoplastic agents at sublethal concentrations[J].Anticancer Res,2002,22(6C):4229-4232.
[16] Li XQ,Li J,Shi SB,et al.Expression of MRP1,BCRP,LRP and ERCC1 as prognostic factors in non-small cell lung cancer patients receiving postoperative cisplatin-based chemotherapy[J].Int J Biol Markers,2009,24(4):230-237.
[17] Izquierdo MA,Scheffer GL,Flens MJ,et al.Major vault protein LRP-related multidrug resistance[J].Eur J Cancer,1996,32A(6):979-784.
[18] Silva P,Slevin NJ,Sloan P,et al.Use of multiple biological markers in radiotherapy-treated head and neck cancer[J].J Laryngol Otol,2010,124(6):650-658.

