黑龙江省瓜类白粉病菌IGS-RFLP分析
魏尊苗 王学征 高 鹏 栾非时
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
白粉病是一种广泛发生的世界性病害,在甜瓜、西瓜、黄瓜、南瓜等葫芦科作物上均可严重发生。单丝壳白粉菌Podosphaera xanthii(原用名Sphaerotheca fuliginea)和二孢白粉菌Golovinomyces cichoracearum(原用名Erysiphe cichoracearum)(Cohen et al.,2004)是瓜类白粉病的主要病原菌(Davis et al.,2002),P. xanthii分化为11个生理小种,分别为小种0、1、2US、2France、3、4、5、N1、N2、N3 和 N4(Vakalounakis et al.,1994);G. cichoracearum分化为 2个生理小种(James & Creight,2002),分别为小种0和小种1。白粉病菌的种类多、分布广、形态特征复杂,传统的形态特征分类方法常引起诸多意见分歧。与传统鉴别寄主鉴定白粉病菌生理小种相比,利用分子生物学手段鉴定白粉病菌可以克服很多外界因素,使结果更科学准确。
核糖体DNA(rDNA)的编码区序列具有保守性而非编码区变异丰富,分析真菌核糖体基因是进行真菌分类鉴定和系统发育的有效方法(Bruns et al.,1991)。rDNA基因间隔区(IGS,intergenic spacer)被认为是rDNA中变异最快的区域(Paule & Lofquist,1996),是检测真菌种群或个体间遗传关系的有效变异序列,是真菌属内种间比较和种内变种遗传多样性分析的重要分子标记(Sugita et al.,2001)。近年来已逐渐用于微生物种水平以下的鉴定、分类,Sugita等(2003)利用IGS测序鉴定菌株并研究其亲缘关系;张金霞等(2004)、黄晨阳等(2005)利用IGS-RFLP对侧耳菌株进行鉴别;Bunyard等(1996)研究了栽培种双孢蘑菇、香菇和平菇的IGS,结果表明各个栽培种内不同菌株的IGS有丰富的多态性。应用 IGS-RFLP对瓜类白粉病菌菌株进行遗传学分析和菌株鉴定尚未见报道,本试验目的在于应用分子生物学技术对黑龙江省瓜类白粉病菌进行遗传多样性研究,在DNA水平上分析白粉病菌菌株的基因遗传学差异,以期对白粉病菌的鉴定提供稳定快速有效的技术方法。
1 材料与方法
1.1 供试菌株
于葫芦科作物白粉病盛发期(2010年7月中下旬)在黑龙江省的哈尔滨、绥化、齐齐哈尔、牡丹江、大庆、双鸭山、鹤岗、黑河、加格达奇 9个主要生态区不同设施不同寄主上采集新鲜感病严重的瓜类白粉病病叶。将采集菌株隔离保存,接种到感病植株上进行纯化,收集纯化白粉病菌于1.5 mL EP管中,置于-20 ℃冰箱中保存,以备提取 DNA,进行 IGS分析。供试菌株的生理小种类型由东北农业大学西甜瓜分子育种实验室鉴定(待发表)。分离纯化有代表性的16份菌株见表1。
1.2 白粉病菌菌株DNA的提取与检测
采用CTAB法(罗琼,2002)提取白粉病菌菌株DNA,研磨前在装有白粉病菌的EP管中放少许灭过菌的石英砂,有利于研磨。用1%琼脂糖检测DNA质量,将提取质量合格的DNA置于-20 ℃冰箱中保存。
1.3 白粉病菌菌株的IGS-PCR扩增与酶切
扩增体系:dNTP(2.5 mmol·Leach-1)2 μL,Primer各 1 μL(表2),ExTaqTMDNA polymerase 1 U,10×PCR buffer(mg2+)2.5 μL,DNA 模板 1 μL,用 ddH2O补齐至 25 μL。

表1 供试白粉病菌菌株
IGS-PCR反应条件:94 ℃ 5 min;94 ℃变性12 min,60 ℃复性1 min,72 ℃延伸2 min,共35个循环;72 ℃补齐7 min,4 ℃保存。1.5%琼脂糖凝胶电泳1 h,置于凝胶成像系统照相记录结果。
本试验采用 3种快速限制性内切酶,即MspⅠ、AsuⅠ、Hinp1Ⅰ(由 Fermentas公司提供)。15 μL 酶切反应体系:2 μL PCR 产物,1 μL 10×buffer,0.2 μL内切酶,6.8 μL无菌去离子水。反应体系:37 ℃,10 min。
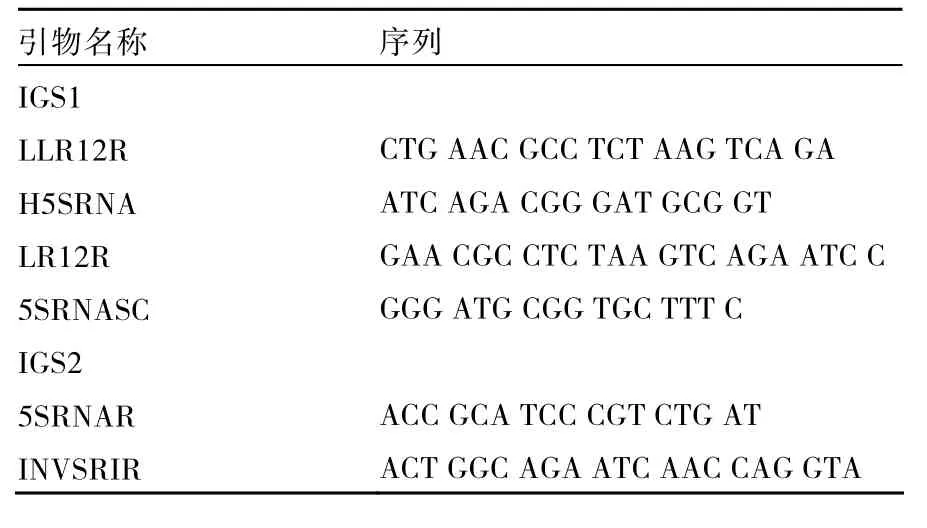
表2 IGS1、IGS2扩增反应的引物
1.4 电泳检测与数据分析
以100 bp DNA ladder Mark er(TransGen Biotech)为分子量对照,取5 µL PCR产物在2.0%的琼脂糖凝胶上电泳,经EB染色后,拍照记录图谱。电泳图谱中的每一条带均作为1个位点,按Nei和Li(1979)提出的方法记录酶切图谱上同一分子量处条带的有无,有条带者记为“1”,无则为“0”,制成0-1矩阵表用于数据处理。利用NTSYS-PC软件采用平均连锁法(UPGMA)进行聚类分析,自动生成遗传相似系数矩阵和树状图。
2 结果与分析
2.1 DNA的提取
采用CTAB法提取各菌株的总DNA,成功提取了16份白粉病菌的DNA,用1%含有EB的琼脂糖凝胶对16个菌株DNA样品进行电泳,结果所检测样本的DNA均无降解,无杂质,适合IGS扩增,如图1所示。
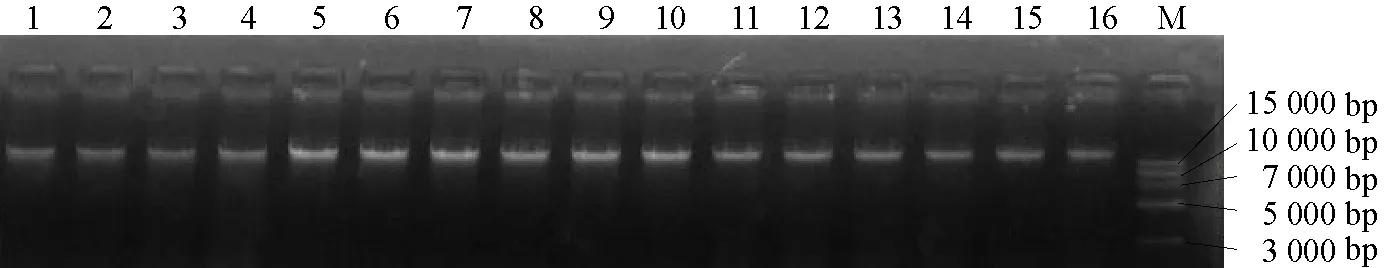
图1 16个白粉病菌菌株DNA
2.2 IGS-RFLP分析
IGS1扩增结果表明,两对 IGS1引物扩增结果相似,供试菌株间 IGS1片段大小和数量存在丰富的多态性,不同菌株间 IGS1片段的数量存在显著差异,除菌株md和菌株qq扩增出一条带外,其他菌株均为多条,片段长度在500~2 000 bp之间,供试菌株中有12株扩增出了IGS1片段(图2)。
IGS2扩增结果表明,供试菌株间IGS2亦存在较大差异但多态性较IGS1低,扩增条带数在1~4条之间,片段大小多在2 000 bp左右,较IGS1长。IGS1与IGS2均未发现小种间特异片段,供试菌株中只有8株扩增出了IGS2片段(图3)。
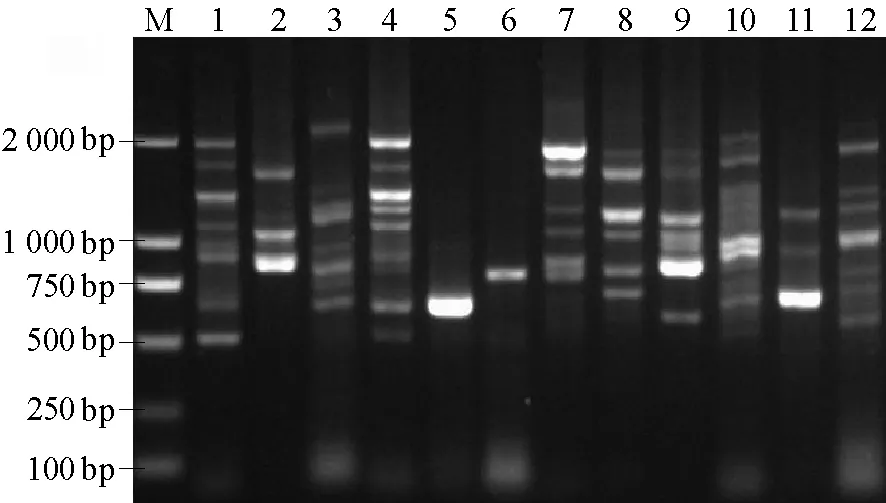
图2 供试菌株IGS1扩增图谱
应用MspⅠ、AsuⅠ、Hinp1Ⅰ3个限制性内切酶对供试菌株的IGS1和IGS2片段进行酶切,结果显示每个菌株的IGS1和IGS2均存在3个内切酶的酶切位点,不同菌株电泳后产生不同的带型图谱,呈现丰富的多态性,成为样本特有的DNA指纹,但并未发现小种间特异片段。以IGS1MspⅠ酶切图谱为例,如图4所示。
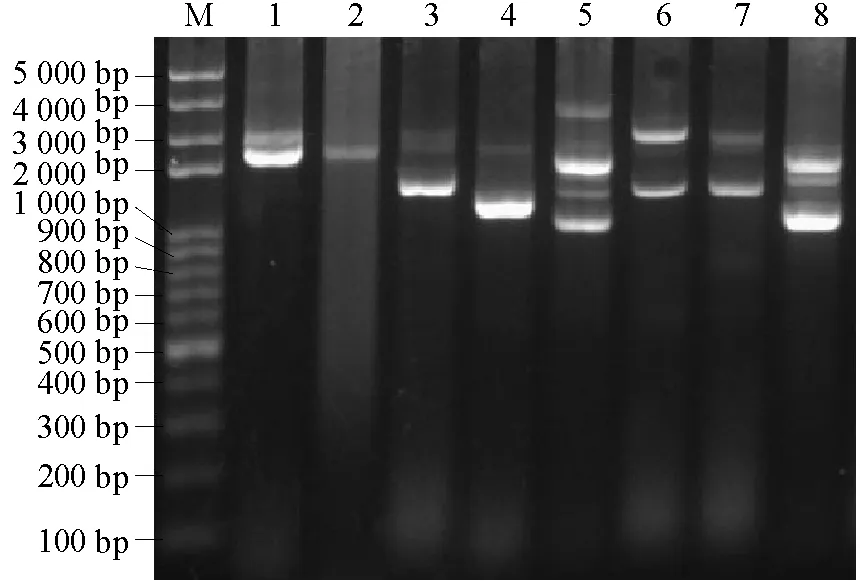
图3 部分供试菌株IGS2扩增图谱
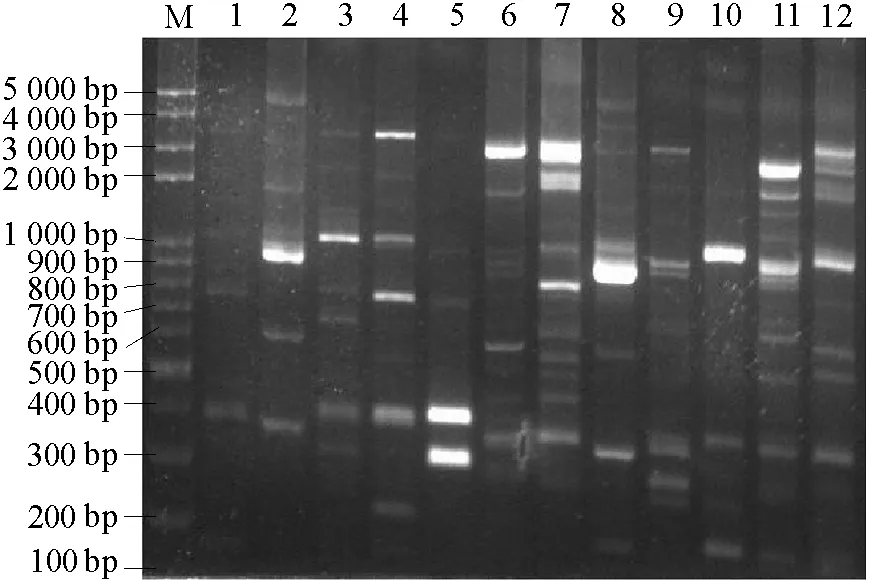
图4 供试菌株IGS1 MspⅠ酶切图谱
2.3 IGS1-RFLP聚类分析
用NTSYS-PC软件对其中酶切效果好的10个菌株IGS1-RFLP图谱进行分析,计算菌株的遗传相似系数,根据遗传相似系数用UPGMA法进行聚类分析,菌株遗传相似系数在0.460 0~0.800 0之间(表3),说明黑龙江省瓜类白粉病菌存在较丰富的遗传多样性,其中来自哈尔滨的菌株 hr-1与菌株 hr-2遗传相似系数最大,为0.80;来自鹤岗的菌株 hg与来自哈尔滨的菌株hr-3遗传相似系数最小,为0.460 0。以遗传相似系数0.60为阈值,可将供试菌株分为3类(图5)。
同为生理小种N1的菌株hg与菌株md遗传相似系数比较小,为0.52,分别被聚到了第Ⅲ类和第Ⅰ类,其他均为生理小种1的菌株被分别聚到了第Ⅰ类、第Ⅱ类和第Ⅲ类,相同菌株并未完全聚为一类,因生理小种的划分基于白粉病菌对鉴别寄主的致病性,由此可知白粉病菌群体基因型与致病性之间有一定相关性但不呈一一对应关系。
从寄主上看,第Ⅰ类包括甜瓜、黄瓜和西瓜,第Ⅱ类包括南瓜和甜瓜,第Ⅲ类只包含一个菌株,其寄主为黄瓜,初步确定供试白粉病菌群体基因型的划分与寄主来源不直接相关;从地域上看,来自鹤岗的hg菌株单独聚为第Ⅲ类;来自哈尔滨的菌株hr-4、佳木斯的菌株jm和齐齐哈尔的菌株qq聚为第Ⅱ类;其他菌株聚到第Ⅰ类。相同或相近地区的白粉病菌并未完全聚到一起,可知白粉病菌群体基因型的划分与菌株地理来源无直接关系。从设施上看第Ⅰ类包括大棚和温室,第Ⅱ类包括露地和温室,第Ⅲ类只包含一个菌株,其设施为大棚,可见白粉病菌群体基因型的划分与菌株来源设施类型之间无直接关系。
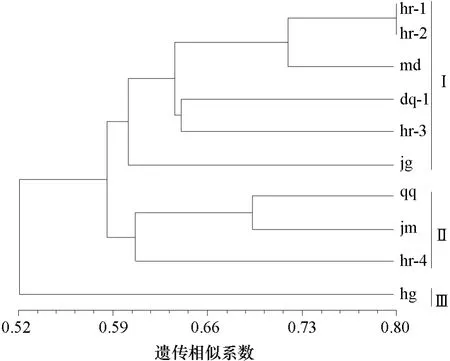
图5 10个白粉病菌基于IGS-RFLP分子标记
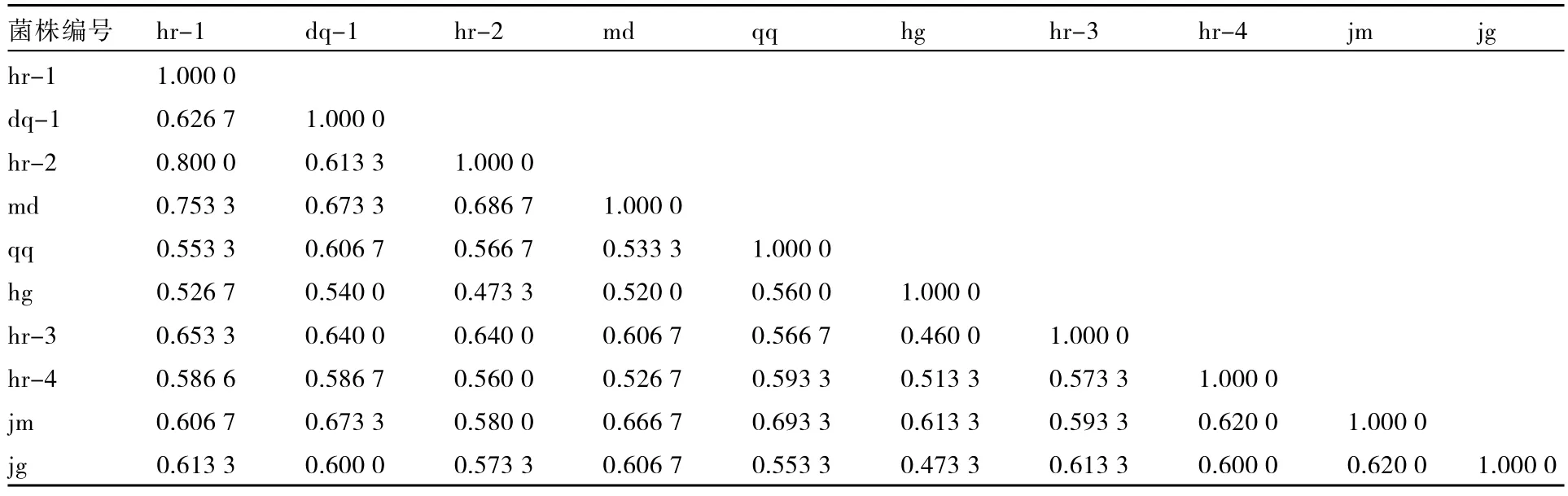
表3 10个供试菌株的遗传相似系数矩阵
3 结论与讨论
本试验应用 IGS-RFLP分析对黑龙江省瓜类白粉病菌进行遗传多样性研究和菌株鉴别,应用真菌IGS通用引物对黑龙江省瓜类白粉病菌进行扩增,菌株间表现出丰富的多态性,IGS1扩增片段长度较IGS2扩增片段小,但是多态性较IGS2高,采用3种快速限制性内切酶对白粉菌的IGS1和IGS2扩增产物进行酶切,结果显示均具良好的稳定性和可重复性,酶切图谱具丰富的多态性,菌株间有显著差异,IGS-RFLP可以将供试菌株有效地进行鉴别,但未发现小种间的特异片段,还有待进一步的研究。通过对IGS1-RFLP酶切图谱聚类分析,可知菌株间的相似系数在0.460 0~0.800 0之间,说明黑龙江省瓜类白粉病菌具有丰富的遗传多样性,与IGS扩增结果一致;本试验初步确定葫芦科白粉病菌致病性与DNA多态性不形成一一对应关系;菌株的遗传多样性与菌株地理来源、寄主来源及设施类型未呈现明显的相关性。此类结果的研究报道很多,段会军等(2007)对河北省西瓜枯萎病生理小种鉴定并进行AFLP分析,结果显示AFLP类群划分与致病性鉴定划分的生理小种之间存在一定相关性,但与菌株的地理来源无关;del Pino等(2002)认为西班牙葫芦科白粉病菌小种与致病性间没有明显相关性;Valerio等(2005)用RAPD和RFLP两种方法分析大麦炭疽病菌,发现致病性与分子标记之间没有相关性。
IGS中含有许多重复序列或亚重复序列,在有丝分裂时经常发生不均等交换,单位重复数目的变化造成IGS长度的变异(Martin et al.,1999),这种变异在电泳中表现为迁移率的不同,呈现多个条带。不同菌株的重复序列或亚重复序列的数量不同,造成了其长度异质性(Albee et al.,2006)。RFLP的产生是由于点突变,DNA的重排、插入或缺失引起的,利用RFLP进行分类鉴定时的一个重要问题就是根据不同的分类水平(属、种、株)研究选择不同的 DNA片段(Goodwin et al.,1992)。真菌的遗传学研究表明,几乎所有的担子菌IGS2比IGS1区长,变异性大,进化较快,可用于种间和种内遗传多样性研究,但本试验所测黑龙江省葫芦科瓜类白粉病菌的IGS区序列却不完全相同,IGS2区长于IGS1区,但IGS1区多态性更强,这和梁宏等(2006)的研究结果相同。
在对不同菌株的 IGS区的扩增过程中,大部分菌株均可得到成功扩增,但是也有部分菌株IGS2扩增不出来,虽然在实验过程中对PCR反应条件进行了一系列的调整,但是这些菌株仍扩增不出来,这与代玉梅等(2004)、岳海梅等(2010)对IGS区的研究结果一致,说明目前使用的PCR通用引物还不够保守,未必适合所有菌株,如果能有针对性的设计引物应该可以有更好的效果。取样过程中每一个菌样尽量多收集菌株以保证实验顺利进行,本试验只对黑龙江省瓜类白粉病菌进行了研究,如能扩大取样范围则更具有代表性且有说服力。
代玉梅,曹军,唐晓萌,张成刚.2004.高黎贡山旱冬瓜Frankia的IGS PCR-RFLP分析.应用生态学报,15(2):186-190.
段会军,张彩英,李喜焕,郭小敏,王省芬,马峙英.2007.河北省西瓜枯萎病菌生理小种鉴定与AFLP分析.中国农业科学,40(5):925-931.
黄晨阳,张金霞,郑素月,管桂萍,张瑞颖.2005.刺芹侧耳(Pleurotuseryngii)rDNA的IGS2多样性分析.农业生物技术学报,13(5):593-595.
梁宏,彭友良,张国珍,陈万权,刘太国.2006.腥黑粉菌属3种检疫性真菌rDNA-IGS区的扩增及其序列分析.植物病理学报,36(5):407-412.
罗琼.2002.小麦白粉菌群体多样性RAPD分析及无毒性遗传分析〔硕士论文〕.北京:中国农业科学院.
岳海梅,庄华,旺姆.2010.小孢子链格孢的IGS-RFLP分析.甘肃农业大学学报,45(5):83-87.
张金霞,黄晨阳,张瑞颖,管桂萍.2004.中国栽培白灵侧耳的RAPD和IGS分析.菌物学报,23(4):514-519.
Albee S R,Mueller G M,Kropp B R.2006.Polymorphisms in large intergenic spacer of the nuclear ribosomal repeat identifyLaccaria proximastrains.Mycologia,88:970-976.
Bruns J D,White T J,Tayor J W.1991.Fungal molecular systematics.Annual Review of Ecology and Systematics,22:525-564.
Bunyard B A,Nicholson M S,Royse D J.1996.Phylogeny of the genus Agaricus inferred from restriction analysis of enzymatically amplified ribosomal DNA.Fungal Genet Biol,20:243-253.
Cohen R,Burger Y,Katzir N.2004.Monitoring physiological races ofPodosphaeraxanthii(syn.Sphaerotheca fuliginea),the causal agent of powdery mildew in Cucurbits:factors affecting race identification and the importance for research and commerce.Phytoparasitica,32(2):174-183.
Davis A R,Thomas C E,Levi A,Bruton B D,Pair S D.2002.Watermelon resistance to powdery mildew race 1.Cucurbitaceae.Alexandria Virginia:ASHS Press:192-198.
del Pino D,Olalla L,Perez-Garcia A,Eugenia Rivera M,Garcia S,Moreno R,de Vicente A,Tores J A.2002.Occurrence of race and pathotypes of Cucurbit powdery mildew in Southeastern Spain.Phytoparasitica,30(5):459-466.
Goodwin S B,Drenth A,Fry W E.1992.Cloning and genetic analyses of two highly polymorphic,moderately repetitive nuclear DNA from phytophthora infestans.Curr Genet,22 (2):107-115.
James D,Creight M C.2002.Reactions of 20 melon cultigens to powdery mildew race 2 U.S. Cucurbitaceae.Alexandria Virginia:ASHS Press:72-77.
Martin F,Selosse M A, Le Tacon F.1999.The nuclear rDNA intergenic spacer of the ectomycorrhizal basidiomycete Laccaria bicolor:structural analysis and allelic polymorphism.Microbiology,145:1605-1611.
Nei M,Li W H.1979.Mathematical model for studying genetic variations in terms of restriction endonucleases.Proc Natl Acad Sci USA,76:5269-5273.
Paule M R,Lofquist A K.1996.Organization and expression of eukaryotic ribosomal RNA genes//Zimmerman R A,Dahlberg A E. Ribosomal RNA:structure,evolution,processing,and function in protein biosynthesis.Boca Raton:CRC Press:395-420.
Sugita T,Ikeda R,Shinoda T.2001.Diversity among strains ofCryptococus neoformansvar.gattii as revealed by a sequence analysis of multiple genes and a chemotype analysis of capsular polysaccharide.Microbiol Immumol,45(11):757-768.
Sugita T,Tanaka N,Shinzawa T.2003.Characterization of subrepeat regions with rDNA intergenic spacers of the edible basidiomycete Lentinula edodes.Biosci Biotechnol Biochem,66(10):2125-2133.
Vakalounakis D J,Klironomou E,Papadakis A.1994.Species spectrum,host range and distribution of powdery mildews on Cucurbitaceae in Crete.Plant Pathology,43(5):813-818.
Valerio H M,Resende M A,Weikert-Oliveira R C B,Casela C R.2005.Virulence and molecular diversity in Colletotrichum graminicola from Brazil.Mycopathologia,159(3):449-459.

