5-羟甲基糠醛与牛血清白蛋白相互作用的光谱特性研究Δ
张轶,杨丽娟,王倩倩,张金莲,孙祥德#(1.新乡医学院医学检验系,新乡市453003;.新乡医学院药学院,新乡市 453003)
5-羟甲基糠醛(5-hydroxymethyl-2-furaldehyde,5-HMF)是葡萄糖等单糖化合物在高温或弱酸等条件下脱水产生的一种醛类化合物,广泛存在于含有糖类物质的中药材和食品中。研究[1]表明,5-HMF一方面具有神经毒性,对人体横纹肌及器官组织有损害,但另一方面具有抗氧化、抗心肌缺血等对人体有益的作用[2]。因此,深入开展包括5-HMF与生物大分子相互作用等方面的研究,可为阐明相关中药及复方制剂的药理、毒理作用提供试验依据。
生命体内普遍存在着竞争性反应,其中活性小分子与生物大分子的相互作用就是这种竞争反应的表现。这种相互作用使得血清白蛋白能与许多内源性和外源性物质结合,从而起着载体蛋白的运输作用[3]。在生命科学的研究中,了解蛋白质与其他物质的结合特性等信息,可以有助于对疾病的诊断和治疗提供有价值的信息。因此,关于小分子与大分子相互作用的研究一直是生命科学领域的研究热点之一。其中药物和蛋白质相互作用的机制研究近年来引起了广泛关注[4~7]。
目前,人们对5-HMF研究多集中在其药理毒理方面[8],与牛血清白蛋白(BSA)的相互作用尚未见报道。鉴于此,笔者运用荧光光谱法和紫外光谱法对5-HMF与BSA的结合机制进行了探讨,计算了结合常数K和结合位点数n,并基于Förster的能量转移理论,计算了供体与受体间的距离,从而得到了5-HMF与BSA相互作用的若干信息,以期对全面了解5-HMF的体内过程提供更多的理论参考。
5-HMF化学结构式见图1。
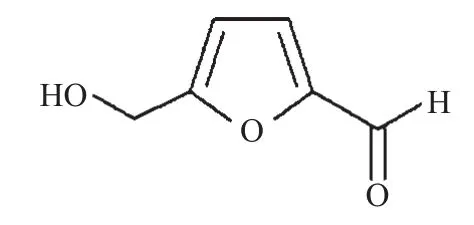
图15 -HMF的化学结构式Fig 1 Chemical structure of 5-hydroxymethyl-2-furaldehyde
1 仪器与试药
1.1 仪器
FP-6500型荧光光谱仪、UV-2550紫外-可见分光光度计(日本岛津公司)。
1.2 试药
BSA(美国Sigma公司,批号:D0009,纯度:98.0%,使用时用缓冲溶液溶解制备成相应浓度);5-HMF(成都曼思特生物科技有限公司,批号:A0298,纯度:99.0%,使用时用缓冲溶液溶解制备成相应浓度);磷酸盐缓冲溶液(临用前制备,内含0.5 mol·L-1NaCl,pH=7.4);试验用水为二次蒸馏水;所用试剂均为分析纯。
2 方法
2.1 试验设计
本试验以荧光光谱和紫外光谱研究5-HMF与BSA相互作用的光谱特性,先测定二者作用后体系的荧光强度,根据Stern-Volmer方程和结合常数表达式求出猝灭速率常数、结合位点数和结合常数;通过热力学参数分析二者的相互作用机制;当5-HMF和BSA的摩尔浓度为1∶1时,5-HMF的紫外吸收光谱和BSA的荧光光谱有重叠现象,按照Förster能量转移理论,计算重叠积分,求出5-HMF与BSA之间的结合距离r;测定5-HMF、BSA及二者作用后体系的紫外光谱,根据光谱的变化进一步证明二者之间的相互作用。
2.2 荧光光谱分析
移取2.0 mL BSA工作液(浓度为1×10-6mol·L-1)于1 cm石英池中,加入适量5-HMF溶液(浓度为1×10-4mol·L-1),制得5-HMF的最终浓度分别为0、0.25×10-6、0.5×10-6、1.0×10-6、1.5×10-6、2.0×10-6、2.5×10-6、3.0×10-6、3.5×10-6、4.0×10-6、4.5×10-6、5.5×10-6mol·L-1的各混合溶液(记为溶液1→12)。设定激发波长为278 nm,在300~450 nm波长范围内分别扫描27℃和37℃时溶液的荧光光谱,并记录346 nm波长处的荧光强度,绘制BSA的荧光猝灭图。
取5-HMF和BSA的摩尔浓度为1∶1混合溶液(浓度均为1.0×10-6mol·L-1),分别进行紫外扫描和荧光扫描,对二者光谱重叠部分计算重叠积分。
2.3 紫外吸收光谱分析
移取2.0 mL磷酸盐缓冲溶液于1 cm比色皿中,加入20 μL 5-HMF溶液,其终浓度为1.0×10-6mol·L-1,体系混合均匀后,用上述磷酸盐缓冲溶液作参比,分别扫描27℃时5-HMF在250~350 nm和300~450 nm波长范围内的紫外吸收光谱,记录吸光度。
移取2.0 mL BSA工作液(浓度为1.0×10-6mol·L-1)于1 cm比色皿中,加入 5-HMF溶液(浓度为1.0×10-4mol·L-1)适量,得5-HMF的最终浓度分别为0、2.0×10-6、4.0×10-6mol·L-1的混合溶液。用磷酸盐缓冲溶液作参比,扫描27℃时溶液在250~350 nm波长范围内的紫外吸收光谱,记录吸光度。
3 结果与分析
3.1 5-HMF与BSA结合反应的荧光猝灭机制
BSA的荧光猝灭光谱图(27℃)见图2;混合溶液的紫外、荧光扫描光谱图见图3。
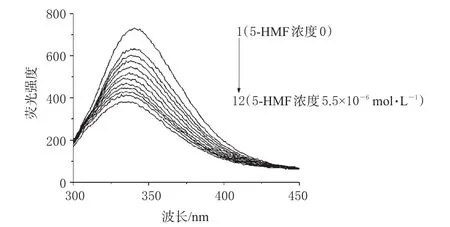
图2 5-HMF对BSA的荧光猝灭光谱(27℃)Fig 2 Fluorescence quenching spectrum of BSA as 5-HMF is added at 27℃
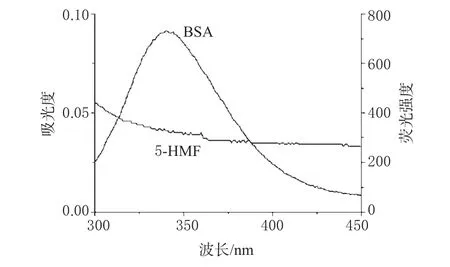
图3 5-HMF的吸收光谱与BSA的荧光发射光谱的重叠图Fig 3 Spectral overlap of 5-HMF absorption spectrum with BSAfluorescence spectrum
从图2中可看出,随着5-HMF浓度的升高,BSA的荧光强度明显减弱,表明BSA荧光发射峰出现了明显的猝灭现象,可见,5-HMF对BSA有猝灭作用。
荧光猝灭机制主要有动态猝灭、静态猝灭和非辐射能量转移等。动态猝灭是由蛋白质激发态分子与药物由于热运动而发生碰撞引起的,其过程符合Stern-Volmer方程[9]:

式中,F0和F分别为BSA与5-HMF作用前、后的荧光发射强度;Kq为双分子猝灭过程速率常数(L·mol-1·s-1);τ0为未加猝灭剂时荧光体的寿命,对于生物大分子,其值约为10-8s[10];c为5-HMF浓度(mol·L-1);KSV为Stern-Volmer常数(L·mol-1),可通过猝灭曲线斜率得到。分别测定27℃和37℃时5-HMF与BSA作用的荧光光谱。假设5-HMF对BSA的荧光猝灭属于动态猝灭,以F0/F对c作Stern-Volmer曲线。根据KSV=Kqτ0处理试验数据,可分别求得不同温度下的猝灭速率常数Kq,结果见表1。
由表1可见,5-HMF对BSA猝灭过程速率常数(Kq)远大于各种猝灭剂对生物大分子的最大扩散猝灭常数2.0×1010L·mol-1·s-1[11]。因此动态猝灭不是BSA荧光猝灭的主要原因。而且随温度升高,BSA的KSV降低,说明5-HMF对BSA猝灭过程为静态猝灭。

表1 结合反应常数和热力学参数测定结果Tab 1 Binding constants and thermodynamic parameters
3.2 结合常数与结合位点数的计算
静态猝灭是由蛋白质基态分子与药物形成了不发射荧光的配合物引起。设药物在蛋白质分子上有n1个相同且独立的结合位点,则荧光强度与猝灭剂浓度的关系可由荧光分子与猝灭剂分子之间的结合常数表达式求出[11]。

式中,n1和K分别表示结合位点数和结合常数。计算结果见表1。
由表1可见n1约为1,说明1个BSA分子结合1个药物分子。
3.3 5-HMF与BSA的能量转移
按照Förster能量转移理论[12]:转移效率E与给体-受体之间的结合距离r和临界能量转移距离R0有关。

式中,F′为能量给体和受体为1∶1时能量给体的荧光强度,F0′为未加入受体时给体的荧光强度,R0是能量转移效率为50%时的临界距离。

式中,F(λ)为荧光给体在波长λ处的荧光强度,ε(λ)则为受体在波长λ处的摩尔消光系数,Δλ为计算重叠积分时分割的波长跨度。将图3中光谱重叠部分采用矩形分割法按式(5)得J=1.11×10-13cm3·L·mol-1,根据式(4)得R0=4.7 nm。由式(3)可得r=5.6 nm。r<7 nm说明二者之间发生了非辐射能量转移[13]。

式中,K2为偶极空间取向因子(K2=2/3),ΦD为给体(BSA)的光量子产率(ΦD=0.118);n2为介质折射指数(n2=1.336),J为供体的荧光发射光谱与受体的吸收光谱间的重叠积分,可表示为:
3.4 5-HMF与BSA的主要作用力的类型
药物与生物大分子之间的结合力主要包括氢键、静电引力、疏水作用力和范德华力等,不同药物与蛋白质结合力的类型是不同的。当温度变化不太大时,反应的标准焓ΔH可以看作常数,根据以下热力学方程[11]:



式中,R为气体常数,T为绝对温度。通过结合常数,计算标准焓ΔH、自由能ΔG和标准熵ΔS,结果见表1。
结合表1数据再根据热力学参数与作用力之间的关系可知,由于ΔH>0、ΔS>0,因此5-HMF与BSA之间主要靠疏水作用力结合[14]。
3.5 紫外吸收光谱
5-HMF及与BSA混合后紫外吸收光谱见图4。
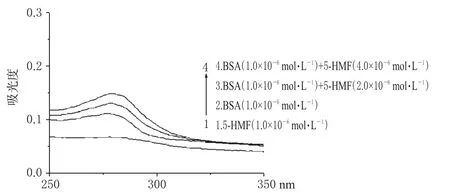
图4 紫外吸收光谱图Fig 4 UV absorption spectrum
从图4可见,BSA在278 nm波长处有吸收峰,当加入5-HMF后,随着药物浓度从2.0×10-6mol·L-1增大到4.0×10-6mol·L-1,二者作用后吸光度升高,进一步证明5-HMF与BSA之间存在着相互作用,形成了复合物[5]。
4 讨论
本研究结果表明,5-HMF对BSA的内源荧光具有较强猝灭作用,这种猝灭特征主要为静态猝灭和非辐射能量转移机制。从5-HMF与BSA的结合常数、结合位点、结合距离和热力学参数等数据可知,二者主要靠疏水作用力相结合,因此,5-HMF可以BSA为载体进行贮存和运输。
[1] 周福富,廖爱国,刘风景,等.不同因素对5-羟甲基糠醛含量的影响[J].中国药业,2008,17(19):44.
[2] 曹延杰,李 飞,谭 鹏,等.女贞子炮制前后5-羟甲基糠醛的含量变化[J].时珍国医国药,2009,20(12):2 929.
[3] 苏 忠,谢孟峡,李建东,等.3,3′,4′,7-四羟基黄酮醇与人血清白蛋白结合的光谱学表征[J].光谱学与光谱分析,2008,28(1):125.
[4] 薛灵伟,彭勤龙,韩永军,等.二硒卟啉的合成及其与牛血清白蛋白的相互作用[J].应用化学,2009,26(8):909.
[5] 王 蓓,魏传晚,李 霞,等.Fc-Arg(NO2)-Gly-Asp(OMe)-OMe的合成及其与牛血清白蛋白的相互作用[J].化学学报,2008,66(3):349.
[6] Subramanyam R,Gollapudi A,Bonigala P,et al.Betulinic acid binding to human serum albumin:A study of protein conformation and binding affinity[J].Journal of Photochemistry and Photobiology B:Biology,2009,94(1):8.
[7] Khan SN,Islam B,Yennamalli R,et al.Interaction of mitoxantrone with human serum albumin:Spectroscopic and molecular modeling studies[J].European Journal of Pharmaceutical Sciences,2008,35(5):371.
[8] 丁 霞,王明艳,余宗亮,等.山茱萸中5-羟甲基糠醛的分离鉴定及生物活性研究[J].中国中药杂志,2008,33(4):392.
[9] Zhou N,Liang YZ,Wang P.18β-Glycyrrhetinic acid inter-action with bovine serum albumin[J].Journal of Photochemistry and Photobiology A:Chemistry,2007,185(2-3):271.
[10] Wang WP,Tang JH,Peng XH,et al.A laser light scattering study of the interaction between human serum albumin and ampicillin sodium[J].Science in China SeriesB---Chemistry,2006,49(4):332.
[12] 安道利,李建晴,郭文奎.孔雀石绿与牛血清白蛋白作用的光谱研究[J].化学研究与应用,2008,20(11):1 410.
[13] Gharagozlou M,Boghaei DM.Interaction of water-soluble amino acid Schiff base complexes with bovine serum albumin:fluorescence and circular dichroism studies[J].Spectrochim Acta A Mol Biomol Spectrosc,2008,71(4):1 617.
[14] 王 欣,贾丽华,郭祥峰,等.α-硫辛酸与牛血清白蛋白的相互作用[J].应用化学,2007,24(7):761.

