新氟喹诺酮类抗菌药物贝西沙星在眼科的应用
张志叶,杨彦彪,张 华,张成安(兰州市第一人民医院药剂科,兰州市 730050)
贝西沙星(Besifloxacin)是新一代氟喹诺酮类抗菌药,它是由美国博士伦公司(Bausch&Lomb Inc.)开发,并于2009年5月28日被美国食品与药物管理局(FDA)批准的第1个专门为眼科用药开发的非全身用氟喹诺酮类药物[1,2],主要用于细菌性结膜炎的治疗。博士伦公司已经申请了世界专利(WO 2008091752)和美国专利(US 2008176834)对该药物进行了保护,并且已在美国上市。贝西沙星的中文化学名称为:(+)-7-[(3R)-3-氨基-六氢-1H-氮杂-1-基]-8-氯-1-环丙基-6-氟 -4-氧 代 -1,4-二 氢 喹 啉 -3-羧 酸 盐 酸 盐[3];分 子 式 为 :C19H21ClFN3O3·HCl;相对分子量为:430.30;结构式见图1。
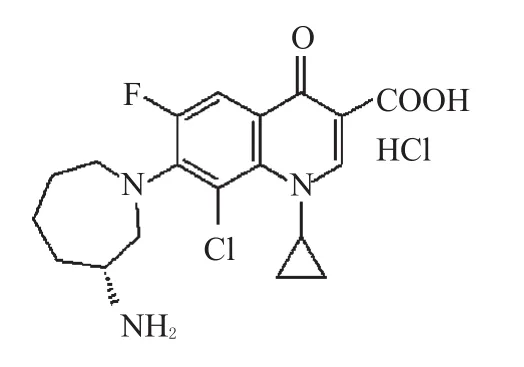
图1 贝西沙星盐酸盐结构式
1 作用机制
1.1 药理作用
作用机制:氟喹诺酮类药物是通过特异性地抑制细菌解旋酶和拓扑异构酶的功能,阻断细菌遗传物质的复制与转录过程而达到杀菌目的[4]。研究表明,贝西沙星是一个由二氢喹啉母环1位N上接环丙基、008位C上接氯原子的喹诺酮类抗生素,它主要通过抑制细菌DNA的回旋酶和拓扑异构酶Ⅳ的活性,从而阻断革兰阳性(G+)菌和革兰阴性(G-)菌DNA的复制、转录和修复,达到杀菌的目的[5,6]。对贝西沙星人角膜上皮细胞感染抗炎作用的研究结果表明,贝西沙星主要是通过抑制核因子kappaB(NFkappaB)的易位和破坏原活化蛋白激酶(MAPK)的活化,达到体外抗炎的作用[5]。
1.2 毒理作用
1.2.1 遗传毒性。有报道[7]称,分别对贝西沙星做了沙门氏菌回复突变试验(Ames试验)、体外CHO细胞染色体畸变实验、大鼠肝细胞DNA复合实验和小鼠体内微核实验。试验结果显示:Ames试验为阴性,说明贝西沙星在本实验条件下,对Ames试验菌株鼠伤寒沙门氏菌TA98、TA100、TA1535、TA1537和大肠埃希氏菌WP2uvrA等无致突变性,而其他喹诺酮类药物的Ames试验结果显示,对Ames试验菌株鼠伤寒沙门氏菌TA102及大肠埃希氏菌WP2(pKM101)有致突变性,可能与相关的拓扑异构酶被抑制有关;口服剂量高达1 500 mg·kg-1·d-1时,贝西沙星体外CHO细胞染色体畸变实验结果呈阳性,说明贝西沙星在该剂量下对细胞染色体有一定的诱变性;口服剂量高达2 000 mg·kg-1·d-1时,大鼠肝细胞DNA复合实验结果为阴性,说明贝西沙星可能不是通过损伤DNA机制而致染色体畸变;口服剂量高达1 500 mg·kg-1·d-1时,小鼠体内微核实验结果呈阳性,表明贝西沙星在该剂量下对小鼠有诱发骨髓嗜多染红细胞微核的效应。
1.2.2 生殖毒性。对大鼠生育率和早期胚胎发育进行研究的结果显示,大鼠妊娠前及妊娠初期口服给药剂量高达500 mg·kg-1·d-1(超过人眼用最大推荐剂量的10 000倍)时,对雌、雄大鼠的生殖能力均未见影响。
1.2.3 致癌性。长期研究表明,贝西沙星尚未发现对动物有致癌作用。
2 抗菌活性
贝西沙星主要是对假白喉杆菌(Corynebacterium pseudodiphtheriticum)、纹带棒杆菌(Corynebacterium striatum)、流感嗜血杆菌(Haemophilus influenzae)、结膜炎摩拉克菌(Moraxella lacunata)、金黄色葡萄球菌(Staphylococcus aureus,S.aureus)、表皮葡萄球菌(Staphylococcus epidermidis,S.epidermidis)、人葡萄球菌(Staphylococcus hominis)、克氏葡萄球菌(Staphylococcus lugdunensis)、缓症链球菌群(Streptococcus mitis group)、口腔链球菌(Streptococcus oralis)、肺炎链球菌(Streptococcus pneumoniae)和唾液链球菌(Streptococcus salivarius)等十多种细菌具有抗菌活性。贝西沙星、莫西沙星(Moxifloxacin)和加替沙星(Gatifloxacin)对耐甲氧西林金黄色葡萄球菌性角膜炎的疗效研究报道,贝西沙星对耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcus aureus,MRSA)的最小抑菌浓度(MIC)为1 μg·mL-1,莫西沙星和加替沙星对MRSA的MIC为8 μg·mL-1[8,9];贝西沙星对肺炎链球菌、金黄色葡萄球菌和大肠杆菌(Escherichia coli,E.coli)的MIC为1 mg·L-1[10]。有关贝西沙星、莫西沙星和加替沙星3种氟喹诺酮类药物对194株金黄色葡萄球菌和110株表皮葡萄球菌的MIC值的研究报道,贝西沙星对葡萄球菌(Staphylococcus)的MIC明显低于其他2种氟喹诺酮类药物,见表1[11]。
贝西沙星对G+菌、G-菌的50%菌株抑菌浓度(MIC50)、90%菌株抑菌浓度(MIC90)均低于莫西沙星、加替沙星、环丙沙星(Ciprofloxacin)、左氧氟沙星(Levofloxacin)、阿奇霉素(Azithromycin)、妥布霉素(Tobramycin)、苯唑西林(Oxacil-lin)、青霉素(Penicillin)和头孢他啶(Ceftazidime)等抗菌药[12,13]。
贝西沙星对厌氧菌的MIC(MIC50、MIC90)明显低于莫西沙星、加替沙星、克林霉素(Clindamycin)和甲硝唑(Metronidazole)等药物,见表2[13]。
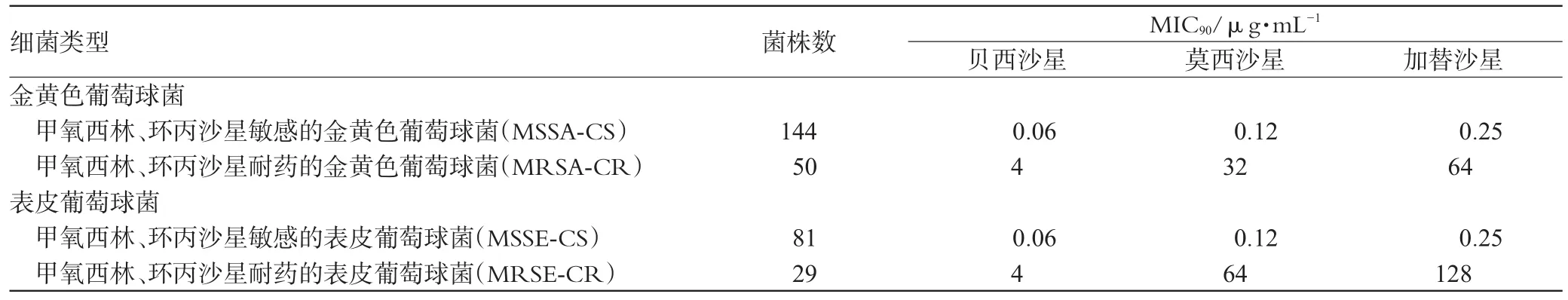
表1 贝西沙星、莫西沙星和加替沙星对葡萄球菌的MIC90

表2 贝西沙星和其他抗生素对厌氧菌的活性
3 眼内通透性研究
Proksch JW等[14]对贝西沙星滴眼液(0.6%)(BesivanceTM)在家兔、猴和人眼内组织分布及其药动学的研究显示,贝西沙星在家兔、猴眼内的通透性良好,眼内的药效浓度可维持24 h以上。经测定,贝西沙星在家兔、猴的结膜、角膜和房水各组织中最大药物浓度分别为6.43、2.10 μg·g-1和0.796 μg·mL-1,消除半衰期(t1/2)在5~14 h之间,在人泪液中的最大药物浓度为610 μg·g-1,24 h后浓度降至1.6 μg·g-1。在人泪液中贝西沙星对肺炎链球菌、金黄色葡萄球菌、表皮葡萄球菌、流感嗜血杆菌的MIC90分别为0.125、0.25、0.5、0.06 μg·mL-1。对上述泪液中存在的病原菌,测定结果显示:峰浓度(cmax)/MIC90≥1 220,药-时曲线下面积(AUC)0~24h/MIC90≥2 500。贝西沙星用于治疗细菌性结膜炎,tid,在血液中的cmax低于0.5 ng·mL-1。
4 临床研究
一项198例细菌性结膜炎患者(1~98岁)参加的随机、双盲、多中心临床对照试验,患者随机分组,tid,为期5 d,考察了贝西沙星的临床有效性及细菌清除率。贝西沙星和对照药95%置信区间比较,贝西沙星和对照药的临床有效率分别为45%(90/198)、33%(63/191),细菌清除率分别为91%(181/198)、60%(114/191),其95%置信区间分别为3%~22%、23%~40%。
一项269例急性细菌性结膜炎患者参加的随机、双盲、多中心临床对照试验,Karpecki P等[15]考察了BesivanceTM治疗细菌性结膜炎的有效性及细菌清除率。其中符合试验要求的患者118例(60例使用BesivanceTM治疗,58例选用其他药物治疗),临床观察结果显示:贝西沙星和对照药比较,临床治疗有效率分别为73.3%(44/60)、43.1%(25/58)(P<0.001),细菌清除率分别为88.3%(53/60)、60.3%(35/58)(P<0.001)。
平均消除半衰期的考察。对患有细菌性结膜炎的成人患者给予BesivanceTM治疗,双眼给药,tid,为期6 d,测定不同时间点的血药浓度。研究结果显示:对第1天和第6天给药后的cmax进行统计,每位患者的cmax均小于1.3 ng·mL-1,平均最大血药浓度第1天为0.37 ng·mL-1,第6天为0.43 ng·mL-1,经多剂量给药后,平均消除半衰期约为7 h。
BesivanceTM和莫西沙星滴眼液(0.5%)用于治疗细菌性结膜炎的随机对照研究[16]结果显示,BesivanceTM的临床疗效优于莫西沙星滴眼液(0.5%)。
5 安全性评价
5.1 不良反应
Karpecki P等[15]有关BesivanceTM治疗细菌性结膜炎不良反应的报道中,BesivanceTM治疗组与对照组不良反应发生率无显著性差异,发生率分别为50.4%(69/137)、53.0%(70/132)。最常见的不良反应为眼痛,发生率分别为10.5%(20/190)、6.9%(13/188);视物模糊发生率分别为10.5%(20/190)、11.7%(22/188);眼涩发生率分别为 7.4%(14/190)、12.2%(23/188)。贝西沙星最常见的不良反应为眼结膜发红,发生率约2%。
5.2 安全性
5.2.1 妊娠。贝西沙星为妊娠C类口服药,在一项大鼠胚胎及胎儿发育的研究中显示,口服剂量为100 mg·kg-1·d-1时,在大鼠体内的cmax(5 μg·mL-1)不低于最高推荐人眼用剂量血药浓度的11 000倍,未观察到致畸作用;当口服剂量达到1 000 mg·kg-1·d-1时,在大鼠体内的cmax(约20 μg·mL-1)不低于最高推荐人眼用剂量血药浓度的45 000倍,未观察到损害大鼠胚胎及胎儿的内脏或影响骨骼形成。大鼠围产期及产后研究,口服剂量为100 mg·kg-1·d-1时,对胎儿及产后大鼠均无致畸作用;而剂量为1 000 mg·kg-1·d-1时,可引起胎儿的体重下降、新生儿成活率降低、性成熟延迟,但在这一剂量组中幸存的幼鼠在行为和生殖能力方面均表现正常。目前尚无贝西沙星对妊娠妇女进行控制性研究的相关报道,因此对于妊娠妇女,只有判断药物的潜在利益大于对胎儿的潜在风险时,才能使用本品。
5.2.2 哺乳期妇女。贝西沙星在乳汁中可能有少量排泄,因此哺乳期妇女应慎用。
5.2.3 婴幼儿。贝西沙星对1岁以下婴儿的安全性和有效性尚未确定。
喹诺酮类药物可影响动物软骨发育[17],表现为对幼龄动物关节软骨具有毒性,主要发生在负重关节上,其中膝关节受累明显,典型症状是关节疼痛,肿胀僵硬,但对成年动物无影响。目前尚无证据表明眼科用喹诺酮类药物有上述不良反应发生。
5.2.4 青少年。一项有关447例(1~17岁儿童和青少年)细菌性结膜炎的随机、多中心、双盲、对照、平行临床试验[18],结果显示,贝西沙星对儿童和青少年的眼科疾病的治疗安全、有效。
5.2.5 老年人。贝西沙星对老年人和年轻人的安全性和有效性没有明显的区别。
6 耐药性
贝西沙星与氨基糖苷类、大环内酯类、β-内酰胺类耐药无交叉耐药性,而体外研究表明,贝西沙星与其他喹诺酮类药物存在交叉耐药性。
7 注意事项
贝西沙星仅用于眼部疾病治疗,禁止直接向眼睛内部、眼球和前庭注射;本品不宜过度使用,否则易导致非敏感菌微生物的过度生长,一旦发生由于过度使用而导致的耐药菌二次感染、经皮试有皮疹或其他过敏反应的症状,应立即停止用药,变更治疗方案。用药期间应避免佩戴隐形眼镜。
8 禁忌证
目前尚无报道。
9 小结
贝西沙星是新一代氟喹诺酮类抗菌药物,与其他氟喹诺酮类抗菌药物相比,明显增强了抗G+菌、G-菌的活性,对厌氧菌也有很强的活性。其眼内通透性良好,为急性细菌性结膜炎以及其他感染性眼病的治疗,提供了更好的选择。作为新一代专门为眼科用药开发的非全身用氟喹诺酮类药物,期盼广大眼科医师根据患者的临床诊断合理地使用。
[1] 佚 名.细菌性结膜炎新药Besivance美国获批[J].中国处方药,2009,7:42.
[2] Chang MH,Fung HB.Besifloxacin:a topical fluoroquinolone for the treatment of bacterial conjunctivitis[J].Clin Ther,2010,32(3):454.
[3] 李 伟,宫 平.贝西沙星(Besivance)[J].中国药物化学杂志,2010,20(1):78.
[4] 崔生辉,李景云,马 越.细菌对氟喹诺酮类药物的耐药机制[J].中国药房,2007,18(2):148.
[5] 佚 名.美国FDA批准治疗细菌性结膜炎的新药Besifloxacin上市[J].中国执业药师,2009,7:54.
[6] Haas W,Pillar CM,Hesje CK,et al.Bactericidal activity of besifloxacin against staphylococci,Streptococcus pneumoniae and Haemophilus influenzae[J].J AntimicrobChemother,2010,65(7):1 441.
[7] Zhang JZ,Cavet ME,Ward KW.Anti-inflammatory effects of besifloxacin,a novel fluoroquinolone,in primary human corneal epithelial cells[J].Curr Eye Res,2008,33(11):923.
[8] Sanders ME,Norcross EW,Moore QC 3rd,et al.Efficacy of besifloxacin in a rabbit model of methicillin-resistant staphylococcus aureus keratitis[J].Cornea,2009,28(9):1 055.
[9] Sanders ME,Moore QC 3rd,Norcross EW,et al.Efficacy of besifloxacin in an early treatment model of methicillin-resistant Staphylococcus aureus keratitis[J].J Ocul Pharmacol Ther,2010,26(2):193.
[10] Cambau E,Matrat S,Pan XS,et al.Target specificity of the new fluoroquinolone besifloxacin in Streptococcus pneumoniae,Staphylococcus aureus and Escherichia coli[J].J Antimicrob Chemother,2009,63(3):443.
[11] Torkildsen G,Proksch JW,Shapiro A,et al.Concentrations of besifloxacin,gatifloxacin,and moxifloxacin in human conjunctiva after topical ocular administration[J].Clin Ophthalmol,2010,26(4):331.
[12] Haas W,Pillar CM,Zurenko GE,et al.Besifloxacin,a novel fluoroquinolone,has broad-spectrum in vitro activity against aerobic and anaerobic bacteria[J].Antimicrob Agents Chemother,2009,53(8):3 552.
[13] Karpecki PM,Morris TW,Zhang JZ.Besifloxacin:a novel anti-infective for the treatment of bacterial conjunctivitis[J].Clin Ophthalmol,2010,26(4):215.
[14] Proksch JW,Granvil CP,Siou-Mermet R,et al.Ocular pharmacokinetics of besifloxacin following topical administration to rabbits, monkeys, and humans[J].J Ocul Pharmacol Ther,2009,25(4):335.
[15] Karpecki P,Depaolis M,Hunter JA,et al.Besifloxacin ophthalmic suspension 0.6%in patients with bacterial conjunctivitis:A multicenter,prospective,randomized,double-masked,vehicle-controlled,5-day efficacy and safety study[J].Clin Ther,2009,31(3):514.
[16] Bertino JS,Zhang JZ.Besifloxacin,a new ophthalmic fluoroquinolone for the treatment of bacterial conjunctivitis[J].Expert Opin Pharmacother,2009,10(15):2 545.
[17] 陈新谦,金有豫,汤 光主编.新编药物学[M].第16版.北京:人民卫生出版社,2007:103.
[18] Comstock TL,Paterno MR,Usner DW,et al.Efficacy and safety of besifloxacin ophthalmic suspension 0.6%in children and adolescents with bacterial conjunctivitis:a post hoc,subgroup analysis of three randomized,double-masked,parallel-group,multicenter clinical trials[J].Paediatr Drugs,2010,12(2):105.

