肝苏对CCl4肝纤维化大鼠氧化应激和胶原表达的影响*
曲 颖宗 蕾沈 镭王 燕徐铭益刘 梅窦爱霞陆伦根#
上海交通大学附属第一人民医院消化内科1(200080)
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所2
肝苏是中药扯根菜的成方制剂,具有清热利湿、解毒活血、平肝健脾等作用,对黄疸性肝病、慢性病毒性肝炎等慢性肝病有一定治疗作用[1,2]。本课题组的前期研究[3]发现肝苏可促进人肝细胞增殖,保护肝细胞和肝星状细胞(HSC)免受氧化应激损伤,且可抑制HSC分泌透明质酸(HA)、层黏连蛋白(LN)、转化生长因子-β1(TGF-β1),提示其具有肝细胞保护、抗氧化、抗肝纤维化作用。本研究以四氯化碳(CCl4)诱导大鼠肝纤维化模型,旨在观察肝苏对实验性大鼠肝纤维化的防治作用并进一步探讨其中的机制,为肝苏临床应用于抗肝纤维化提供理论和实验依据。
材料与方法
一、实验动物、主要试剂和仪器
健康雄性SPF级Sprague-Dawley(SD)大鼠 63只,体质量约220 g,购自上海西普尔-必凯实验动物有限公司,饲养于上海交通大学医学院实验动物科学部。所有动物自由进食、饮水,温度、湿度符合标准,明暗12 h/12 h循环。
肝苏无糖型颗粒(四川古蔺肝苏药业有限公司),3 g/袋,相当于16.7 g生药,分别以蒸馏水配制成浓 度为 0.1 g/ml、0.2 g/ml、0.4 g/ml 的 溶液 。ALT试剂盒购自上海罗氏制药有限公司,AST试剂盒购自上海北加生化试剂有限公司,ALP试剂盒购自上海科华生物工程股份有限公司,血清HA检测试剂盒购自Gentaur公司,丙二醛(MDA)、超氧化物歧化酶(SOD)测定试剂盒购自南京建成生物工程研究所。大鼠α-平滑肌肌动蛋白(α-SMA)抗体、Ⅰ型胶原抗体、Ⅲ型胶原抗体购自Abcam公司,免疫组化二抗和DAB试剂盒购自福州迈新生物技术开发公司。
ADVIA 1650全自动生化分析仪购自Bayer公司,Mat-3000酶标仪购自DRG公司,Ultraspec 2000型紫外/可见分光光度计购自Pharmacia Biotech公司。
二、动物分组和模型制备
所有大鼠适应性喂养1周,随机分成5组,分别为正常对照组(7只)、肝纤维化模型组(14只)、低剂量肝苏干预组(1 g/kg,14只)、中剂量肝苏干预组(2 g/kg,14 只)、高剂量肝苏干预组(4 g/kg,14只)。后四组大鼠先予皮下注射40%CCl4溶液(纯橄榄油配制)0.5 ml/100 g,随后予0.2 ml/100 g,2次/周×8周,建立大鼠肝纤维化模型[4]。正常对照组予相同剂量橄榄油皮下注射。肝苏干预组于建模同时予相应剂量肝苏溶液灌胃,正常对照组和肝纤维化模型组予相同剂量饮用水灌胃,1次/d×8周。
每周记录大鼠体质量,观察精神状态、活动情况、皮毛光泽度等。
实验过程中,低、中、高剂量肝苏干预组分别有4、2、4只大鼠因灌胃溶液呛入气管而死亡。8周末,动物于麻醉状态下抽取下腔静脉血5 ml,贴壁注入试管,室温静置 3 h,2500×g离心 10 min,吸取上清液待检。处死动物,称量肝湿重后留取肝组织待检。
三、血清学指标检测
取 0.5 ml血清送检验科行 ALT、AST、ALP等血清肝生化指标检测。另取200μl血清行HA检测,酶标仪450 nm处读取数据。
四、肝组织MDA和SOD检测
按试剂盒说明书检测肝组织MDA含量和SOD活性。
五、组织病理学检查
取大鼠肝组织,4%甲醛溶液固定,石蜡包埋,切片,常规HE和Masson染色,光学显微镜下观察肝组织纤维化程度[5]。
六、免疫组化染色检测肝组织α-SMA、Ⅰ型、Ⅲ型胶原
石蜡切片常规脱蜡、水化,3%H2O2阻断内源性过氧化物酶,行抗原修复,封闭。分别滴加α-SMA抗体(工作浓度1∶500)、Ⅰ型胶原抗体(工作浓度1∶400)、Ⅲ型胶原抗体(工作浓度 1∶500),4 ℃过夜。PBS冲洗,二抗孵育,PBS冲洗,DAB显色,苏木精复染,中性树胶封片。以已知阳性切片作为阳性对照,以PBS代替一抗作为阴性对照。
结果判断:以细胞质(α-SMA)或纤维(Ⅰ型、Ⅲ型胶原)呈棕黄色为阳性。随机选取10个高倍视野(×400),Image-Pro Plus 6.0 软件计算阳性染色面积占整个视野面积的百分比,取均值。
七、统计学分析
应用SPSS 11.0统计软件,计量资料以x±s 表示,检验方差齐性,多组间均数的比较采用单因素方差分析,肝纤维化分期半定量资料的比较采用多样本比较的秩和检验(Kruskal-Wallis检验),P<0.05为差异有统计学意义。
结 果
一、各组大鼠基本情况比较
正常对照组大鼠生长状况良好,肝纤维化模型组大鼠一般情况差,精神萎靡,皮毛光泽度欠佳,体质量增长速度明显减慢,肝指数(肝湿重/体质量×100%)明显升高。各剂量肝苏干预组大鼠体质量增长较正常对照组稍缓慢,肝指数亦明显升高,干预组与模型组间体质量增加值和肝指数差异无统计学意义(见表1)。
表1 各组大鼠基本情况和血清学指标比较(±s )
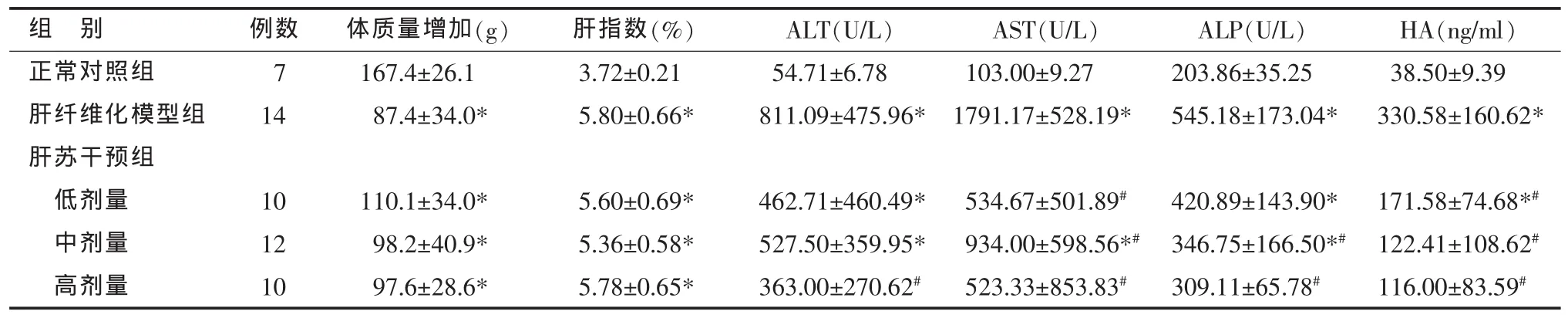
表1 各组大鼠基本情况和血清学指标比较(±s )
*与正常对照组比较,P<0.05;#与肝纤维化模型组比较,P<0.05
组 别 肝指数(%) ALT(U/L) AST(U/L) ALP(U/L) HA(ng/ml)正常对照组 3.72±0.21 54.71±6.78 103.00±9.27 203.86±35.25 38.50±9.39肝纤维化模型组 5.80±0.66* 811.09±475.96* 1791.17±528.19* 545.18±173.04* 330.58±160.62*肝苏干预组低剂量5.60±0.69* 462.71±460.49* 534.67±501.89# 420.89±143.90* 171.58±74.68*#中剂量 5.36±0.58* 527.50±359.95* 934.00±598.56*# 346.75±166.50*# 122.41±108.62#高剂量 5.78±0.65* 363.00±270.62# 523.33±853.83# 309.11±65.78# 116.00±83.59#例数7 14体质量增加(g)167.4±26.1 87.4±34.0*10 12 10 110.1±34.0*98.2±40.9*97.6±28.6*
二、各组大鼠血清学指标比较
肝纤维化模型组血清 ALT、AST、ALP、HA水平较正常对照组显著升高(P<0.05)。高剂量肝苏干预组血清ALT水平、高、中剂量肝苏干预组血清ALP水平、各剂量肝苏干预组血清AST、HA水平较肝纤维化模型组明显下降,差异有统计学意义(P<0.05)(见表 1)。
三、各组大鼠肝组织MDA含量和SOD活性比较
肝纤维化模型组肝组织MDA含量较正常对照组显著升高(P<0.05)。各剂量肝苏干预组均较肝纤维化模型组下降,高、中剂量组差异有统计学意义(P<0.05)。各组间肝组织SOD活性无明显差异(见表 2)。
表2 各组大鼠肝组织MDA含量和SOD活性比较(±s )

表2 各组大鼠肝组织MDA含量和SOD活性比较(±s )
*与正常对照组比较,P<0.05;#与肝纤维化模型组比较,P<0.05
组 别 例数 MDA(nmol/mg蛋白) SOD(U/mg蛋白)正常对照组 7 1.13±0.13 124.85±15.83肝纤维化模型组 14 2.07±0.43* 115.34±21.43肝苏干预组低剂量 10 1.77±0.33* 98.42±11.06中剂量 12 1.33±0.34# 116.10±29.04高剂量 10 1.26±0.13# 116.38±20.79
四、各组大鼠肝纤维化程度比较
各组大鼠肝组织HE和Masson染色均可见纤维组织(见图1、图2)。正常对照组肝小叶结构完整,无肝细胞脂肪变性或坏死,无炎症细胞浸润和纤维组织增生。肝纤维化模型组肝小叶结构破坏,小叶周围肝细胞明显坏死,纤维组织增生、假小叶形成,肝细胞明显肿胀变性,尤以脂肪变性为甚,部分肝细胞可见气球样变。各剂量肝苏干预组肝组织未见明显假小叶,仅少量纤维组织增生,多局限于门管区,肝细胞以脂肪变性、坏死为主。

图1 各组大鼠肝组织纤维化程度比较(HE染色,×100)
各组大鼠肝纤维化分期比较示Kruskal-Wallis检验H值为8.370,组间总体差异有统计学意义(P=0.039)。各剂量肝苏干预组纤维化分期均较肝纤维化模型组明显改善,差异有统计学意义(P<0.05),尤以高剂量组为著(见表 3)。
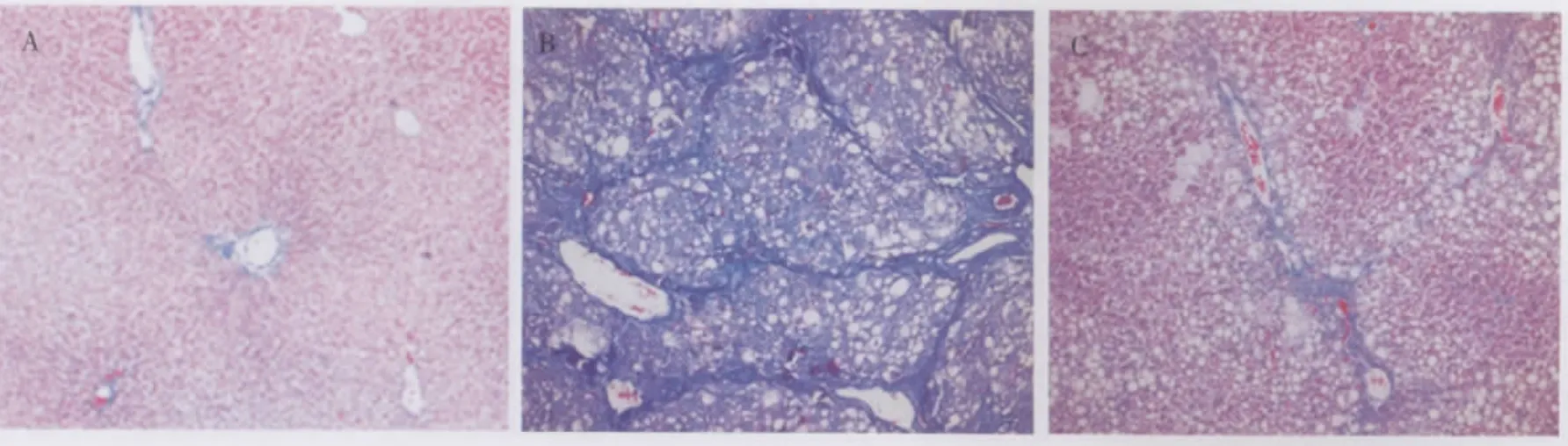
图2 各组大鼠肝组织纤维化程度比较(Masson染色,×100)
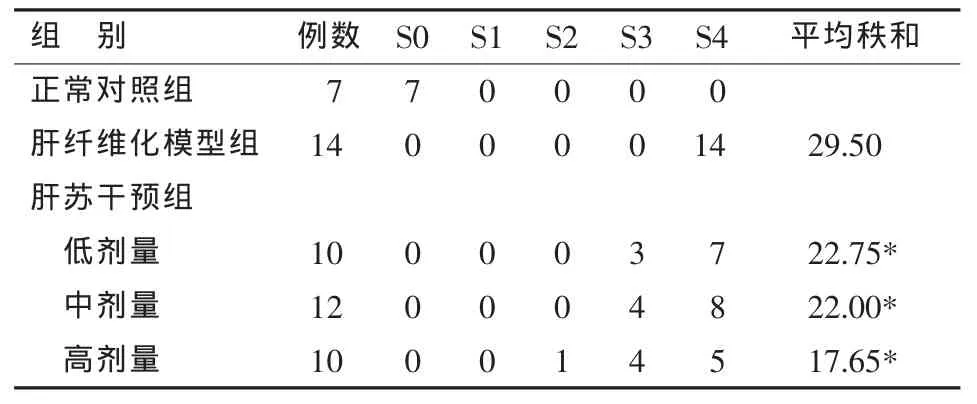
表3 各组大鼠肝纤维化分期比较(n)
五、各组大鼠肝组织α-SMA、Ⅰ型、Ⅲ型胶原含量比较
免疫组化染色示正常对照组α-SMA仅表达于小动脉、小静脉血管上皮细胞胞质。肝纤维化模型组α-SMA大量表达于门管区、纤维间隔的HSC胞质,染色面积较正常对照组显著增多(P<0.05)。各剂量肝苏干预组α-SMA主要表达于门管周围散在分布的HSC胞质,染色面积较肝纤维化模型组明显减少,差异有统计学意义(P<0.05)(见图 3、表 4)。

图3 各组大鼠肝组织α-SMA免疫组化染色图(×100)

图4 各组大鼠肝组织Ⅰ型胶原免疫组化染色图(×100)
免疫组化染色示正常对照组肝组织Ⅰ型胶原主要表达于中央静脉、门管区、门管间纤维组织,Ⅲ型胶原除上述区域外,尚表达于窦周。肝纤维化模型组Ⅰ型、Ⅲ型胶原除表达于中央静脉、门管区、窦周外,尚沿纤维间隔弥漫分布,染色面积均较正常对照组显著增多(P<0.05)。各剂量肝苏干预组Ⅰ型、Ⅲ型胶原主要表达于中央小叶和门管周围,少量表达于纤维间隔,染色面积较肝纤维化模型组明显减少,Ⅰ型胶原各剂量组差异均有统计学意义(P<0.05),Ⅲ型胶原仅高剂量组差异有统计学意义(P<0.05)(见图 4、图 5、表 4)。

图5 各组大鼠肝组织Ⅲ型胶原免疫组化染色图(×100)
表4 各组大鼠肝组织α-SMA、Ⅰ型、Ⅲ型胶原染色面积比较(±s,%)

表4 各组大鼠肝组织α-SMA、Ⅰ型、Ⅲ型胶原染色面积比较(±s,%)
*与正常对照组比较,P<0.05;#与肝纤维化模型组比较,P<0.05
组 别 例数 α-SMA Ⅰ型胶原 Ⅲ型胶原正常对照组 7 1.08±0.53 0.64±0.21 0.72±0.34肝纤维化模型组 14 9.48±2.51* 8.29±2.86* 5.21±1.56*肝苏干预组低剂量 10 5.64±1.93*#4.22±1.40*#4.26±1.61*中剂量 12 4.59±2.26*#3.16±1.18*#4.12±1.53*高剂量 10 3.87±1.66*#2.70±0.92*#3.59±1.70*#
讨 论
肝纤维化是诸多肝病的中间环节,如不予有效治疗,可最终进展为肝硬化,甚至肝癌、肝衰竭。当前观点认为肝纤维化进程可逆,预防和治疗肝纤维化是肝病防治的重要环节[6,7]。CCl4为选择性肝毒性药物,可致肝小叶中央静脉周围细胞坏死、纤维增生,CCl4大鼠肝纤维化模型是目前国内外较常采用的动物模型之一,适用于肝纤维化发生、发展的动态观察和研究[8 ~ 10]。本研究结果证实CCl4可成功诱导大鼠肝纤维化模型,模型大鼠血清ALT、AST、ALP水平较正常对照组显著升高,提示存在明显肝细胞损伤。
肝苏为中药扯根菜的成方制剂,包括槲皮素、没食子酸、乔松素等成分。Molina等[11]的研究显示槲皮素可通过直接抑制脂质过氧化、间接促进抗氧化剂谷胱甘肽(GSH)的产生以保护小鼠肝脏免受氧化应激损伤。Renugadevi等[12]的研究发现槲皮素能缓解镉所致的大鼠肾毒性和氧化应激损伤。Liu等[13]的研究亦证实槲皮素可恢复抗氧化酶活性,减少氧化应激诱导的DNA损伤和细胞凋亡。此外,有研究[14,15]发现没食子酸可激活肝微粒体谷胱甘肽-S转移酶活性,防止自由基对肝细胞微粒体的损伤。上述研究提示肝苏在保护肝细胞免受氧化应激损伤方面有一定应用前景。本研究结果示各剂量肝苏干预组血清ALT、AST、ALP水平均有不同程度的改善,提示肝苏可通过抗氧化作用减轻肝细胞坏死,从而保护肝细胞,改善肝功能。
CCl4大鼠肝纤维化模型研究提示肝内脂肪本身与HSC的活化和胶原生成无关,但可通过增强CCl4对肝脏的脂质过氧化损伤促进肝纤维化发生。MDA是脂质过氧化的重要终产物之一,可反映机体受氧自由基攻击的严重程度,SOD则反映机体清除氧自由基的能力,两者与HSC增殖和肝纤维化的发生、发展密切相关[16]。本研究结果示高、中剂量肝苏干预组肝组织MDA含量显著下降,但各组间SOD活性无明显差异,提示肝苏可能通过直接降低MDA含量以延缓肝纤维化的发生,此过程不伴SOD活性的改变。
肝纤维化由细胞外基质过度增生并在肝内异常沉积所致,胶原纤维是细胞外基质的主要成分,胶原合成、沉积与降解、吸收间动态平衡的破坏是造成肝纤维化的主要原因[17,18]。Ⅰ型、Ⅲ型胶原占总胶原含量的80% ~ 90%[19],因此观察两者的变化可间接评价肝纤维化程度,亦可用于药物抗肝纤维化疗效的评估。本研究结果示各剂量肝苏干预组Ⅰ型、Ⅲ型胶原含量均较肝纤维化模型组有所下降,与肝组织病理学检查纤维化分期结果一致,Ⅰ型胶原含量在各剂量干预组中均显著下降,Ⅲ型胶原含量仅在高剂量干预组中显著下降,由此提示肝苏可明显改善大鼠肝纤维化,尤以高剂量组作用为著。此外,本研究结果示各剂量肝苏干预组血清纤维化指标HA水平均较肝纤维化模型组显著下降,与肝组织病理学和Ⅰ型、Ⅲ型胶原含量检查结果一致。
HSC活化和增殖是肝纤维化形成的中心环节[20,21]。肝细胞损伤可激活HSC,使其由静息状态活化为肌纤维样母细胞,表达活化标记物α-SMA,并大量合成细胞外基质。本研究结果示肝纤维化模型组肝组织大量表达α-SMA,提示HSC活化;各剂量肝苏干预组α-SMA含量显著减少,即活化的HSC减少,由此提示肝苏可能通过抑制HSC活化以减少胶原沉积,改善肝纤维化,并进一步提示抑制HSC活化有望成为延缓肝纤维化进程的关键环节。
综上所述,本研究结果示肝苏能减轻实验性大鼠肝纤维化的肝细胞损伤,降低肝组织MDA含量,抑制HSC活化和肝内胶原合成,具有抗氧化和抗纤维化作用,但其具体机制有待进一步研究证实。
1 黄加权,袁萍,黄铁军,等.肝苏颗粒对实验性黄疸大鼠肝功能的保护及其机制.中华传染病杂志,2007,25(3):143-146.
2 陈晓蓉,姚华,蒋音,等.肝苏颗粒治疗慢性乙型肝炎的疗效观察.中华肝脏病杂志,2004,12(1):50.
3 刘梅,窦爱霞,陈尉华,等.肝苏对人肝细胞和肝星状细胞增殖、氧应激以及细胞外基质表达的影响.胃肠病学,2009,14(6):347-350.
4 陆伦根,房静远.肝纤维化.见:高春芳,陆伦根主编.纤维化疾病的基础和临床.上海:上海科学技术出版社,2004.359-364.
5 中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案.中华肝脏病杂志,2000,8(6):324-329.
6 Povero D,Busletta C,Novo E,et al.Liver fibrosis:a dynamic and potentially reversible process.Histol Histopathol,2010,25(8):1075-1091.
7 Pinzani M,Rombouts K.Liver fibrosis:from the bench to clinical targets.Dig Liver Dis,2004,36(4):231-242.
8 Desmyter L,Fan YD,Praet M,et al.Rating of CCl(4)-induced rat liver fibrosis by blood serum glycomics.J Gastroenterol Hepatol,2007,22(7):1148-1154.
9 Huang Q,Xie Q,Shi CC,et al.Expression of angiotensin-converting enzyme 2 in CCL4-induced rat liver fibrosis.Int JMol Med,2009,23(6):717-723.
10 Muriel P,Moreno MG,Hernández Mdel C,et al.Resolution of liver fibrosis in chronic CCl4 administration in the rat after discontinuation of treatment:effect of silymarin,silibinin,colchicine and trimethylcolchicinic acid.Basic Clin Pharmacol Toxicol,2005,96(5):375-380.
11 Molina MF,Sanchez-Reus I,Iglesias I,et al.Quercetin,a flavonoid antioxidant,prevents and protects against ethanol-induced oxidative stress in mouse liver.Biol Pharm Bull,2003,26(10):1398-1402.
12 Renugadevi J,Prabu SM.Quercetin protects against oxidative stress-related renal dysfunction by cadmium in rats.Exp Toxicol Pathol,2010,62(5):471-481.
13 Liu CM,Ma JQ,Sun YZ.Quercetin protects the rat kidney against oxidative stress-mediated DNA damage and apoptosis induced by lead.Environ Toxicol Pharmacol,30(3):264-271.
14 Shinno E,Shimoji M,Imaizumi N,et al.Activation of rat liver microsomal glutathione S-transferase by gallic acid.Life Sci,2005,78(1):99-106.
15 Rasool MK, Sabina EP, Ramya SR, et al.Hepatoprotective and antioxidant effects of gallic acid in paracetamol-induced liver damage in mice.J Pharm Pharmacol,2010,62(5):638-643.
16 Apte M.Oxidative stress:does it ‘initiate’ hepatic stellate cell activation or only ‘perpetuate’ the process?JGastroenterol Hepatol,2002,17(10):1045-1048.
17 Friedman SL.Mechanisms of hepatic fibrogenesis.Gastroenterology,2008,134(6):1655-1669.
18 Parsons CJ,Takashima M,Rippe RA.Molecular mechanisms of hepatic fibrogenesis.J Gastroenterol Hepatol,2007,22(Suppl 1):S79-S84.
19 洪微,朱元杰.纤维化中几种重要的细胞外基质.见:高春芳,陆伦根主编.纤维化疾病的基础和临床.上海:上海科学技术出版社,2004.3-20.
20 Li JT,Liao ZX,Ping J,et al.Molecular mechanism of hepatic stellate cell activation and antifibrotic therapeutic strategies.JGastroenterol,2008,43(6):419-428.
21 吴盛迪,王吉耀.抗肝纤维化治疗研究进展.肝脏,2009,14(1):71-73.

