中药藤黄呫吨酮类化合物及其分析测定方法
崔洪英, 柳文媛, 王 磊, 冯 锋*
(1.中国药科大学天然药物化学教研室,江苏 南京 210009;2.中国药科大学药物分析教研室,江苏 南京 210009;3.药物质量与安全预警教育部重点实验室,江苏 南京 210009)
中药藤黄系藤黄科植物藤黄(Garcinia hanburyi Hook.f.)所分泌的树脂干燥物,市售藤黄呈圆柱状或不规则块状,色黄,质脆易碎。传统中医学认为,藤黄味苦涩、有毒,具有攻毒、蚀疮和破血散节等功效,主治痈疽、肿毒、顽癣、恶疮和跌打损伤等疾病[1]。藤黄中含有以藤黄酸(gambogic acid,1)为代表的笼状吨酮类(caged xanthone)化合物,药理研究表明,该类成分多具有广谱强效的抗肿瘤活性[2]。因此,对藤黄中吨酮类化合物的分离和分析一直是藤黄研究的重点。近年来,研究人员从藤黄中分离得到数十种笼状吨酮类成分,其中很多化合物还存在顺反异构体和旋光异构体,因此亟待建立能全面反映藤黄化学成分,特别是吨酮类成分的分离分析方法,从而更好地对藤黄及相关产品进行质量控制。同时,对各种异构体单体的分离、鉴定及定量检测对其抗肿瘤机制的深入研究也具有重要意义。本文对近年来从中药藤黄中分离的吨酮类化合物进行了汇总,并介绍了相关分离分析方法,旨在为中药藤黄的质量控制和吨酮类化合物作用机制的深入研究提供参考。

1 藤黄中的呫吨酮类化合物
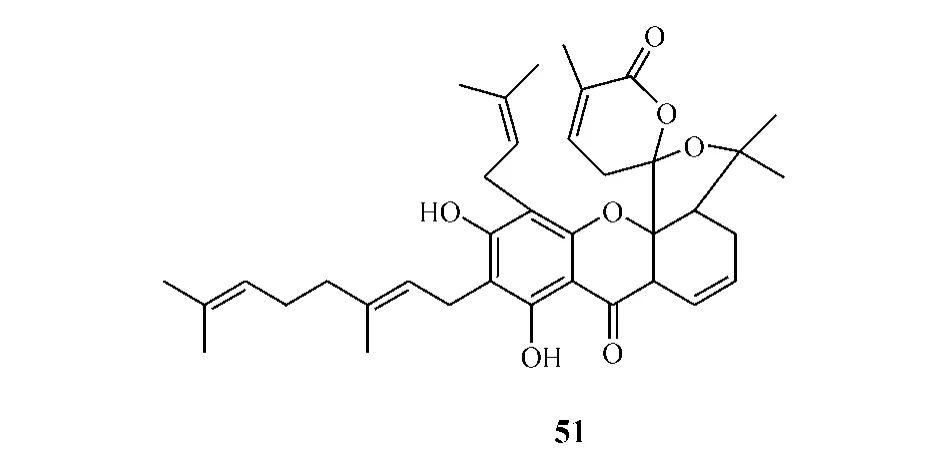
1.1 含A环的笼状呫吨酮类化合物

1.2 无A环的笼状呫吨酮类化合物

1.3 无笼状桥环的呫吨酮类化合物
2 藤黄中呫吨酮类化合物的含量测定方法
2.1 高效液相色谱-蒸发光散射法
蒸发光散射检测器(ELSD)为一种通用型检测器,可检测挥发性低于流动相的任何样品,样品无需含有发色基团,该法现已被广泛应用于碳水化合物、类脂、脂肪酸、氨基酸及药物等的检测。杨虹等(中国药科大学学报,1999年)建立了测定藤黄中藤黄酸和新藤黄酸含量的HPLC-蒸发光散射法,色谱条件为:以 Alltima C18柱(4.6 mm×150 mm,5 μm)为固定相,甲醇-己腈-水-冰乙酸(体积比为6∶1∶2∶0.3)为流动相,流速为0.8 mL·min-1,等度洗脱,色谱柱柱温为25℃,检测器漂移管温度为75℃,恒定气体压力为2.1 L·min-1。在此条件下,新藤黄酸和藤黄酸的保留时间分别为24.5和36.8 min,两者分离度良好(R>1.5)。该方法准确度较高,对5种市售藤黄进行测定,藤黄酸含量为22.75%~34.58%,新藤黄酸含量为12.75% ~21.79%,回收率均在95%以上。
2.2 高效液相色谱-紫外分光光度法
长期以来,文献报道的藤黄成分分析研究主要是针对其主成分藤黄酸和新藤黄酸进行的定性和定量分析[19-22],而极少有对藤黄中多种笼状吨酮类成分同时进行分析的报道,更无对其中顺反异构体进行分离和分析的方法。2006年,韩全斌等[23]首次建立了分析藤黄中笼状吨酮类成分顺反异构体的HPLC-UV法,选用 Alltima C18(250 mm×4.6 mm,5 μm)为固定相,乙腈-0.1%三氟乙酸(体积比为9∶1)为流动相,流速1.0 mL·min-1,等度洗脱,检测波长为360 nm,分析了来源于中国和印度的藤黄共7种。结果显示,这7种藤黄的HPLC图谱类似,且其共有的7种笼状吨酮类化合物均为主成分,包括3对顺反异构体(藤黄酸和异藤黄酸、莫里林酸和异莫里林酸以及gambogenic acid和isogambogenic acid)与30-羟甲基藤黄酸。在上述色谱条件下,7种化合物色谱峰分离度良好(R>1.5),药材中其他6个化合物与异藤黄酸相比,其色谱相对保留时间恒定(RSD均小于0.85%),故该法可作为藤黄HPLC指纹图谱的特征峰用于药材的真伪鉴别。
2.3 高效液相色谱-质谱法
HPLC-UV法和HPLC-蒸发光散射法主要用于定性和定量分析已获得单体的笼状吨酮类化合物。藤黄中笼状吨酮类化合物分子间结构相近,其主要区别在于取代基的种类和位置,异戊烯基双键两侧取代基不同所形成的顺反异构,以及C2位手性碳原子形成的旋光异构,故而分离和分析的难度较高。利用HPLC-MS联用技术则无需分离出化合物单体,就能推测出藤黄中笼状吨酮类化合物的结构。由于吨酮类成分大多具有相同的吨酮母核,其质谱裂解过程具有一定规律性[26]:笼状吨酮在碰撞诱导解离(CID)过程中C9和C10位可发生逆Diels-Alder(RDA)裂解,桥环开裂失去质荷比(m/z)为84或86的碎片,简单吨酮类化合物无此裂解行为,据此可判断待测化合物是否为笼状吨酮;笼状吨酮分子在裂解过程中会产生相继丢失C4H8(m/z为56)或C9H16(m/z为124)的碎片离子,由此可判断分子中异戊烯基的个数。此外,顺反异构体裂解方式不同,藤黄酸和异藤黄酸具有相同的分子离子峰(m/z为629.3114)和一级MS图谱,但二级MS裂解过程有差异:异藤黄酸C13位异戊烯基侧链裂解时,C27位氢原子可迁移至C12位羰基上发生McLafferty重排,丢失C13位异戊烯基侧链后产生m/z为447.2166的碎片;藤黄酸分子中C27和C28位间双键为Z式构型,使得C27位氢原子不能迁移至C12位羰基上,故而无McLafferty重排。因此,通过观察有无m/z为447.2166的离子峰可判断化合物的顺反异构。
3 结语
文献报道的藤黄中大多数成分的色谱图均相似[23,25,27,29],但对于藤黄中另一主成分(见图 1,其色谱峰编号为5)的鉴定,目前尚存在一定争议。韩全斌等[23]认为该化合物为 gambogenic acid(42),但周安等[27]认为是新藤黄酸(26)。笔者按照吕归宝等(药学学报,1984年)报道的方法制备了该化合物,然后通过色谱峰比对及NMR数据测定,发现该化合物的NMR数据与gambogenic acid的NMR数据[2]基本一致,由此认为部分文献中所述的新藤黄酸应更正为gambogenic acid。

图1 藤黄中化学成分的HPLC图谱Figure 1 HPLC chromatogram for the compounds in gamboge
目前临床应用的抗肿瘤药物多为化学合成产物,普遍存在毒副作用较大、易产生耐药性等缺点。因此,寻找高效低毒的新型化合物一直是抗肿瘤药物的研究热点。中药藤黄可通过多种机制达到抗肿瘤效果,是一种多靶点的抗肿瘤天然药物。值得注意的是,中药藤黄与一般化疗药物的明显区别在于其能选择性杀死肿瘤细胞,而对正常造血系统无影响(陈葆仁,江西医学院学报,1980年),故而具有较高安全性;其主要成分藤黄酸极具开发前景,目前该化合物的Ⅱ期临床研究已在进行中。近来国内外有关藤黄中吨酮类化合物的分离、分析及其活性研究的报道越来越多,笔者所在课题组也正在从事对藤黄中吨酮类化合物进行分离和分析的研究工作,现已分离得到10余种笼状吨酮类成分,并计划对其中多对异构体进行抗肿瘤活性初筛,以考察这些异构体尤其是C2位旋光异构体间的活性差异,为吨酮类化合物的进一步研究及藤黄中其他有效成分的探索提供参考。
[1]李时珍.本草纲目:第二册[M].北京:人民卫生出版社,1977:1344.
[2]Asano J,Chiba K,Tada M,et al.Cytotoxic xanthones from Garcinia hanburyi[J].Phytochemistry,1996,41(3):815-820.
[3]杨虹,丛晓东,王峥涛.药用藤黄化学成分的研究[J].中国药学杂志,2008,43(12):900-902.
[4]Wang L L,Li Z L,Xu Y P,et al.A new cytotoxic caged polyprenylated xanthone from the resin of Garcinia hanburyi[J].Chin Chem Lett,2008,19(10):1221-1223.
[5]Lee S B,Chen C M.Compounds isolated from gamboge resin having activity inhibiting the growth of tumor/cancer cells and pharmaceutical compositions comprising the same:US,7138428 B2[P].2006-11-21.
[6]Tao S J,Guan S H,Wang W,et al.Cytotoxic polyprenylated xanthones from the resin of Garcinia hanburyi[J].J Nat Prod,2009,72(1):117-124.
[7]Reutrakul V,Anantachoke N,Pohmakotr M,et al.Cytotoxic and anti-HIV-1 caged xanthones from the resin and fruits of Garcinia hanburyi[J].Planta Med,2007,73(1):33-40.
[8]Tao S J,Guan S H,Li X N,et al.A highly rearranged pentaprenylxanthonoid from the resin of Garcinia hanburyi[J].Helvetica Chimica Acta,2010,93(7):1395-1400.
[9]Han Q,Yang L,Liu Y,et al.Gambogic acid and epigambogic acid,C-2 epimers with novel anticancer effects from Garcinia hanburyi[J].Planta Med,2006,72(3):281-284.
[10]Han Q B,Song J Z,Qiao C F,et al.Novel compounds from Garcinia hanburyi,their use in treating cancer and method of separating epimers thereof:US,2007/0149610 A1[P].2007-06-28.
[11]Han Q B,Yang L,Wang Y L,et al.A pair of novel cytotoxic polyprenylated xanthone epimers from gamboges[J].Chem Biodivers,2006,3(1):101-105.
[12]贾明美,寿清耀,谭青,等.藤黄化学成分的研究[J].化学学报,2008,66(22):2513-2517.
[13]Han Q B,Wang Y L,Yang L,et al.Cytotoxic polyprenylated xanthones from the resin of Garcinia hanburyi[J].Chem Pharm Bull,2006,54(2):265-267.
[14]Sukpondma Y,Rukachaisirikul V,Phongpaichit S.Antibacterial caged-tetraprenylated xanthones from the fruits of Garcinia hanburyi[J].Chem Pharm Bull,2005,53(7):850-852.
[15]柳文媛.抗肿瘤新药藤黄酸的结构、代谢产物和构效关系的研究[D].南京:中国药科大学,2004.
[16]陈优生,冯锋,尤启冬.ZrOCl2比色法测定藤黄中总藤黄酸的含量[J].中国药师,2002,5(12):731-732.
[17]李茂星,贾正平,杜青云,等.二氯氧锆比色法测定镰形棘豆水提取物中的总黄酮[J].华西药学杂志,2008,23(4):466-467.
[18]Han Q B,Cheung S,Tai J,et al.Stability and cytotoxicity of gambogic acid and its derivative,gambogoic acid[J].Biol Pharm Bull,2005,28(12):2335-2337.
[19]周安,李庆林,彭代银,等.HPLC法测定藤黄中藤黄酸和新藤黄酸的含量[J].中国中医药信息杂志,2008,15(8):53-54.
[20]江再茂,李遐方,李克,等.高效液相色谱法测定藤黄药材中藤黄酸[J].中草药,2008,39(3):445-447.
[21]柳文媛,冯锋,尤启东,等.藤黄总酸注射液中藤黄酸的高效液相色谱法测定[J].江苏药学与临床研究,2003,11(1):16-18.
[22]张旭,柳文媛,冯锋,等.藤黄HPLC指纹图谱的研究[J].中国医药工业杂志,2003,34(12):605-606.
[23]韩全斌,宋景政,乔春峰,等.藤黄中xanthone类化合物的定性定量分析[J].中国天然药物,2006,4(3):210-214.
[24]Song J Z,Yip Y K,Han Q B,et al.Rapid determination of polyprenylated xanthones in gamboge resin of Garcinia hanburyi by HPLC[J].J Sep Sci,2007,30(3):304-309.
[25]Li S L,Song J Z,Han Q B,et al.Improved high-performance liquid chromatographic method for simultaneous determination of 12 cytotoxic caged xanthones in gamboges,a potential anticancer resin from Garcinia hanburyi[J].Biomed Chromatogr,2008,22(6):637-644.
[26]Zhou Y,Liu X,Yang J,et al.Analysis of caged xanthones from the resin of Garcinia hanburyi using ultra-performance liquid chromatography/electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J].Anal Chim Acta,2008,629(1/2):104-118.
[27]周安,李庆林,彭代银.高效液相色谱-质谱联用法鉴定中药藤黄中桥环类化合物[J].药学学报,2008,43(8):838-842.
[28]Han Q B,Zhou Y,Feng C,et al.Bioassay guided discovery of apoptosis inducers from gamboge by high-speed counter-current chromatography and high-pressure liquid chromatography/electrospray ionization quadrupole timeof-flight mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2009,877(4):401-407.

