齐墩果烷三萜类化合物的抗肿瘤活性及机制研究进展
张珍珍, 赵 氚, 陈 思, 季 晖*
(1.中国药科大学药理学教研室,江苏 南京 210009;2.海军总医院药剂科,北京 100048)
三萜类化合物为一类基本母核由30个碳原子组成的萜类化合物,其结构根据异戊二烯定则可视为6个异戊二烯单位聚合而成。该类化合物广泛分布于自然界,在菌类、植物和动物中均有存在,其生物合成途径是由鲨烯通过不同环化方式转变而来。研究显示,三萜类化合物具有多种生理活性,如溶血、抗肿瘤、抗炎、抗菌、抗病毒、降胆固醇及抗生育等。目前,从自然界中分离获得的三萜类化合物已超过2万种,其中多种化合物,如齐墩果烷型五环三萜类化合物齐墩果酸(OA,1)和乌苏烷型五环三萜类化合物熊果酸(UA)被证实具有抗炎和抗肿瘤活性。近年来,三萜类化合物中抗肿瘤活性最强的齐墩果烷型类化合物引起了国内外学者的普遍关注,通过对该类化合物的结构修饰和构效关系研究,现已获得一系列活性更好的衍生物[1],与此同时,其抗肿瘤的机制探究也在不断深入。本文对齐墩果烷型三萜类化合物的抗肿瘤活性及其作用机制研究进展进行综述,旨在为该类化合物作用机制的阐明及相关药物研发提供参考。

1 齐墩果烷三萜类化合物的化学结构及抗肿瘤活性
齐墩果酸分子结构中有3个可供修饰的官能团——C17位羧基、C12位和C13位间的双键以及C3位羟基。研究人员通过对该化合物进行改造,得到了抗肿瘤活性更强的结构类似物,如2-氰基-3,12-二氧代齐墩果烷-1,9-二烯-28-酸(2-cyano-3,12-dioxooleana-1,9-dien-28-oic acid,CDDO,2)及其 C17位取代的一系列衍生物 CDDO-Me(3)、CDDO-Im(4)、CDDO-MA(5)、CDDO-EA(6)和 Di-CDDO(7)等。在体外,这些化合物对多种肿瘤(如乳腺癌、前列腺癌、胰腺癌、卵巢癌、脂肉瘤、骨肉瘤和神经细胞瘤等实体瘤,以及白血病、淋巴瘤和骨髓瘤等非实体瘤)细胞均具有促进凋亡和增殖抑制作用[3-12],其中,CDDO-Me 对骨肉瘤 HOB-c、KHOS、KHOSR2、U-2OS 和 U-2OSTR细胞的 IC50分别为 0.8、0.15、0.33、0.17 和 0.39 μmol·L-1[7],对成神经瘤 LAN1、NBEB、SKNAS、SKNDZ和SKNSH细胞株的 IC50分别为160、305、418、525 和 630 nmol·L-1[9];CDDO 对 B 细胞淋巴瘤OCI-Ly19和OCI-Ly10细胞的IC50分别为1.25 和 2.0 μmol·L-1[10];CDDO-Im 对耐地塞米松的骨髓瘤 MM.1R 细胞的 IC50为 0.15 μmol·L-1,CDDO-Me对耐伊马替尼的慢性粒细胞白血病KBM5-R 细胞的 IC50为 0.22 μmol·L-1[13-14]。值得一提的是,该类化合物安全性较高,如 CDDO和CDDO-Me在诱导肿瘤细胞凋亡的浓度下,对取自急性髓系白血病患者或健康受试者的正常淋巴细胞均无明显毒性[15],故而极具开发为抗肿瘤药物的潜力。

齐墩果烷型三萜类化合物的体内抗肿瘤活性也已通过多种荷瘤动物模型得到了证实。如Liby等[16]给乙烯基氨基甲酸酯所致的肺癌模型小鼠饲以含有 CDDO-ME(60 mg·kg-1·d-1)或 CDDO-EA(400 mg·kg-1·d-1)的饲料,15 周后处死小鼠,取其肺进行观察,结果显示,CDDO-ME和CDDO-EA组小鼠肺表面的平均瘤体数分别为7.4和7.8个,而未给药组小鼠肺表面平均瘤体数为15.8个,表明CDDO-ME和CDDO-EA均可显著抑制小鼠肺部肿瘤生长;Jutooru等[17]给荷有胰腺癌L3.6pL细胞的裸鼠灌胃给予 CDDO-Me(7.5 mg·kg-1·d-1)或空白溶剂,连续给药4周,结果,CDDO-Me组和空白溶剂对照组小鼠瘤体积分别约为500和2400 mm3,瘤重分别为1和2 g;Deeb等[18]给前列腺癌转基因模型小鼠灌胃给予 CDDO(10 μmol·kg-1,每周第 1 ~5天给药),20周后,空白溶剂对照组和CDDO组中发生肿瘤淋巴结转移的小鼠比例分别为63%和27%。
2 齐墩果烷三萜类化合物的抗肿瘤作用机制
凋亡为细胞的内源性死亡程序,对保持组织内环境稳定具有重要作用,且这一特性在不同物种中均具有高度保守性。凋亡在多种正常生理过程中可起到调节作用,若此功能出现异常或缺失则可导致一系列病理情况发生。肿瘤细胞的特征之一就是缺乏这种程序性的死亡过程,提示肿瘤细胞中存在某种可避开凋亡途径的机制。而现有研究表明,齐墩果烷型三萜类化合物的抗肿瘤活性与激活肿瘤细胞凋亡的线粒体途径有关[2]。肿瘤细胞经齐墩果烷三萜类化合物处理后,线粒体膜通透性显著增加,其内部多种促凋亡物质如细胞色素C或AIF随之大量释放,从而启动下游反应,诱导细胞凋亡。
2.1 细胞凋亡的线粒体途径
凋亡是细胞生理性死亡的普遍形式,该过程受到一系列信号通路的调节,其中线粒体途径起着至关重要的作用。线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)是线粒体内外信息交流的枢纽,其开放后可导致线粒体许多功能发生致命性变化,从而启动凋亡途径。MPTP位于线粒体内外膜之间,主要由外膜的电压依赖性阴离子通道(voltage dependent anion channel,VDAC)、内膜的腺苷酸转移酶(adenine nucleotide translocator,ANT)、基质中的亲环蛋白D(cyclophilin D)及其他蛋白(如外周苯二氮受体、己糖激酶和肌酸激酶等)组成[19]。MPTP在正常生理条件下处于关闭状态;在应激状态下则开放通道,并允许相对分子质量小于1500的物质通过,进而使线粒体基质渗透压升高。随着MPTP的开放,线粒体内外H+梯度消失,线粒体膜电位降低,呼吸链解偶联,无法产生能量,此时解偶联的呼吸链会产生大量活性氧簇(ROS),氧化线粒体内膜上的还原型心肌磷脂,使线粒体结构稳定性大大降低。由于水和溶质大量涌入,线粒体发生肿胀,外膜破裂,一系列促凋亡物质如细胞色素C、第二线粒体源性Caspase激活因子(second mitochondria-derived activator of Caspase,Smac,也称DIABLO)和凋亡诱导因子(AIF)从中释放。细胞色素C释放到细胞质后与凋亡蛋白酶激活因子(Apaf-1)结合,使得Apaf-1与dATP的亲和力增加,进而促进Apaf-1构象变化并不断招募Procaspase-9,细胞色素 C、dATP、Apaf-1 和 Procaspase-9形成聚合体即凋亡复合体(apoptosome)。凋亡复合体促进其招募的大量Procaspase-9发生剪切反应,形成活化的Caspase-9,后者可作为剪切因子使Procaspase-3活化为Caspase-3。Caspase-3是执行凋亡的关键蛋白,可进一步激活下游级联反应,最终导致细胞凋亡。Smac蛋白释放至胞质后,可与凋亡抑制蛋白(IAP)特异性结合,解除IAP对Caspase-9和Caspase-3的阻遏作用,从而激活各级Caspase引起级联反应;而AIF和内切核酸酶G(Endo G)可转位进入胞核,不依赖于Caspase途径直接引起染色质浓缩及DNA断裂[20]。目前,已知可直接或间接参与 MPTP调控的内源性物质有 Bcl-2家族蛋白、Ca2+、ROS、ATP和ADP等。随着研究的不断深入,研究人员发现砷化物、苍术苷、二酰胺以及齐墩果烷三萜类化合物等物质均可刺激MPTP开放,而环孢素A(CsA)可抑制MPTP开放。细胞凋亡的线粒体途径基本原理如图1所示。
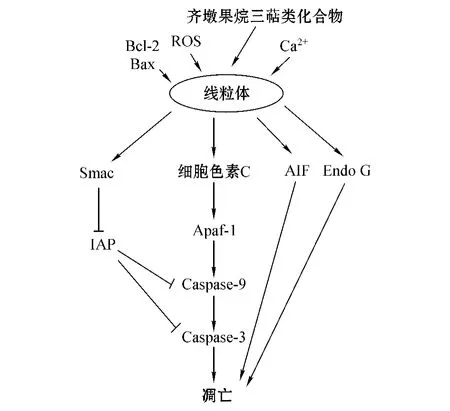
图1 细胞凋亡的线粒体途径示意图Figure 1 Schematic diagram of mitochondrial pathway of apoptosis
2.2 齐墩果烷三萜类化合物对肿瘤细胞凋亡线粒体途径的作用
2.2.1 增大线粒体膜通透性 线粒体凋亡途径的激活通常以线粒体膜通透性增大为起点。值得一提的是,齐墩果烷三萜类化合物激活线粒体膜通透性增加的机制不同于内源性物质,如Brookes等[2]发现 CDDO(2.5 μmol·L-1)能够诱导 B 细胞淋巴瘤OCI-Ly19细胞凋亡,凋亡率为80%;将 CDDO(2.5 μmol·L-1)、CsA(1μmol·L-1)与 OCI-Ly19 细胞共孵育后,细胞凋亡率仍为80%左右。为进一步考察化合物对线粒体结构和功能的影响,他们将大鼠肝细胞破碎后,通过密度梯度离心获得线粒体,然后分别用 Ca2+、Ca2++CDDO、Ca2++CDDO-Im 和Ca2++DI-CDDO(CDDO、CDDO-Im和 DI-CDDO终浓度为1或5 μmol·L-1)进行处理,发现上述各组MPTP均开放;其中,Ca2+组以及Ca2++低浓度药物组线粒体发生的通透性增大现象可被CsA抑制,而Ca2++高浓度药物组无法被抑制,提示齐墩果烷三萜类化合物与Ca2+均可激活MPTP开放但两者机制不同。此外,在完整OCI-Ly19细胞中进行的研究也获得了相同结果。已知Ca2+可破坏线粒体呼吸链酶复合物Ⅰ,影响ATP合成,增加细胞毒性自由基的释放,最终激活MPTP,该过程可被CsA抑制。
齐墩果烷三萜类化合物主要通过以下两个机制提高线粒体膜通透性,进而促进凋亡的发生。
1)降低线粒体中还原型谷胱甘肽水平 还原型谷胱甘肽(GSH)是细胞内重要的抗氧化剂,可清除线粒体新陈代谢和凋亡过程中产生的ROS,以避免ROS对线粒体内膜的破坏,对于线粒体稳态的维持具有重要意义。然而,线粒体自身不能合成GSH,只能利用从细胞质中转运进来的GSH。GSH的氧化产物——氧化型谷胱甘肽(GSSG)可在谷胱甘肽还原酶与NADPH的共同作用下转变为GSH。GSH与GSSG含量比值反映了细胞内的氧化水平,当该比值显著下降时,提示细胞可能已进入凋亡阶段。Chernyak等(Biosci Rep,1997年)研究发现,GSH可保持MPTP中巯基的还原态,从而使MPTP处于关闭状态。为了探究齐墩果烷三萜类化合物诱导线粒体内膜通透性增强的分子机制,Samudio等[21]发现,将 CDDO-Im(1 μmol·L-1)与胰腺癌 COLO357细胞孵育20~120 min后,COLO357细胞线粒体GSH水平降低,细胞总GSH水平无显著变化,ROS聚集增强,线粒体膜电位下降,提示CDDO-Im有可能通过降低线粒体GSH开放MPTP孔道,从而使线粒体膜通透性增强。2-巯基乙醇(BME)可逆转CDDO-Im的这种作用,有趣的是,其仅能彻底清除由CDDO-Im诱导产生的ROS,而不能清除由过氧化氢诱导产生的ROS,提示CDDO-Im引起线粒体GSH流失是导致ROS聚集增强的直接原因,BME并不能直接清除ROS,而是通过阻止由CDDO-Im引起的线粒体GSH流失来下调ROS水平。
心肌磷脂为线粒体磷脂的重要组成部分,对线粒体内膜稳定性的维持有着重要作用。Samudio等[22]发现,CDDO-Me可使人白血病U937细胞线粒体内膜中的还原型心肌磷脂含量大幅度降低,进而使线粒体膜电位下降,且这一过程不可被Caspase广谱抑制剂z-VAD-fmk逆转;而星形孢菌素、紫外线和肿瘤坏死因子等诱导的线粒体膜电位下降及细胞凋亡均依赖于Caspase途径,因此,上述结果提示CDDO-Me能不依赖于Caspase途径作用于线粒体内膜中的心肌磷脂,使线粒体内膜通透性增大。在慢性粒细胞白血病KBM5细胞及KBM5R细胞中进行的研究结果亦表明:CDDO-Me能使线粒体内膜中的还原型心肌磷脂含量减少,其原因是CDDO-Me选择性降低了线粒体GSH水平,使氧化应激反应蛋白——血红素加氧酶1(HO-1)表达水平升高,导致ROS增多,从而引起还原型心肌磷脂被氧化,线粒体稳定性下降,膜通透性增大[14]。
2)动员凋亡蛋白Bax的迁移 细胞色素C对于生命活动的重要性不仅体现在其参与细胞能量的生成,且在凋亡中也发挥着重要作用。大量研究表明细胞色素C与Apaf-1的结合是凋亡进程中的关键步骤[23-24]。关于细胞色素C释放的具体机制,目前主要存在2种假说。一是与MPTP的开放有关:当MPTP被激活时,线粒体膜发生破裂,从而释放细胞色素C[25];二是与 Bcl-2蛋白家族的参与有关:Bcl-2蛋白家族属于信号转导蛋白,可参与线粒体外膜通透性的调节。该家族包括抗凋亡蛋白(如Bcl-2、Bcl-xL、Bcl-w 和 Mcl-1)与促凋亡蛋白(如 Bax、Bak及Bok),Bcl-2定位于MPTP,可抑制MPTP的开放,当各种刺激因子作用于细胞时,Bax从细胞质转移至线粒体外膜并发生聚集,在线粒体外膜磷脂层中形成孔道,这些孔道可使小分子蛋白如细胞色素C 通过[26]。Konopleva 等[27]发现,CDDO-Me 能增加人白血病HL-60和U937细胞中bax mRNA水平,进而使Bax表达增多,且线粒体中Bax水平上升,细胞质中Bax水平下降,表明CDDO-Me能诱导Bax从胞质向线粒体迁移。此外,齐墩果烷三萜类化合物也能诱导非小细胞肺癌H460和A549细胞和卵巢癌A2780细胞中Bax表达增多,进而促进线粒体释放细胞色素 C[28-29]。Samudio 等[22]发现,在 CDDO-Me诱导U937细胞发生凋亡的过程中,细胞色素C达到最大释放量时可见大量Bax发生转运,然而Bax转运至线粒体之前,细胞色素C就已开始从线粒体中释放,由此推测,Bax转运在齐墩果烷三萜类化合物促肿瘤细胞凋亡过程中发挥了重要作用,但并非促使细胞色素C释放的唯一原因,即细胞色素C的释放可能存在多种机制。
2.2.2 促进凋亡诱导因子释放 AIF为线粒体蛋白中的一种,在凋亡过程中也能从线粒体膜间隙释放至胞质中,且该过程不依赖于Caspase。AIF前体蛋白可通过其N末端的线粒体定位信号穿入线粒体内外膜间隙,然后被线粒体内肽酶加工为成熟的蛋白分子,此时分子N末端锚定于线粒体内膜。当AIF与一些细胞凋亡因子发生作用后,可从线粒体膜上的锚定位点脱离;随着线粒体外膜通透性增加,该分子可从线粒体膜间隙中释放至胞质中,然后通过分子自身携带的核定位信号转运至细胞核内,从而激活核酸内切酶,对细胞核内DNA进行水解,造成大范围的DNA片段化及染色质凝集[30]。研究显示,CDDO和CDDO-Im可促使A2780和U937细胞线粒体内的 AIF浓度下降,细胞核 AIF浓度上升[21,29]。Konopleva 等[31]通过免疫荧光技术观察到在未经药物处理的U937细胞中,AIF呈散点状分布于细胞质中,而经CDDO处理后,AIF则主要聚集于细胞核中。由此推测,齐墩果烷三萜类化合物能促使AIF大量释放,从很大程度上说是MPTP被激活的结果。
AIF信号通路并非存在于所有形式的细胞凋亡中,但在某些细胞的凋亡中的作用尤为关键[32]。AIF从线粒体中释放往往早于细胞色素C,若用抗体封闭AIF或敲除AIF基因均可使受试细胞免于死亡,且线粒体不再释放细胞色素 C。Konopleva等[31]采用siRNA技术沉默U937细胞中的AIF基因,使AIF表达水平下调,结果发现CDDO对U937细胞的抑制率显著降低,胞内DNA片段化程度也明显减小。上述研究表明:齐墩果烷三萜类化合物激活U937细胞MPTP开放后触发的一系列下游反应中,AIF介导的凋亡通路发挥了至关重要的作用。
但是,MPTP开放并非促进AIF释放的唯一原因,多聚ADP核糖聚合酶1(PARP-1)也可促进线粒体释放AIF。线粒体中多种信号通路如AIF和细胞色素C各自诱导的凋亡通路虽然互不依赖,但也并非完全相互独立——AIF可促使线粒体释放更多的细胞色素C,细胞色素C活化的Caspase亦可促进线粒体释放AIF。因此,齐墩果烷三萜类化合物也有可能通过激活其他信号通路促进AIF释放。
2.3 齐墩果烷三萜类化合物对其他细胞凋亡途径的作用
现有研究表明:除作用于线粒体途径外,齐墩果烷三萜类化合物还能调节肿瘤细胞凋亡中的其他信号通路,例如,CDDO可通过直接作用于过氧化物酶体增殖物活化受体γ(peroxisome proliferator-activated receptor γ,PPARγ)激活 Caspase 8 和 Caspase3,最终诱导肿瘤细胞凋亡[33];核转录因子 κB(NF-κB)可调节细胞的增殖和分化,尤其在肿瘤细胞的抗凋亡机制中发挥着重要作用,Shishodia等[34]发现CDDO-Me可抑制KBM5细胞中NF-κB通路中的关键激酶——NF-κB 抑制物(IκB)激酶(IKK),进而阻断NF-κB通路,诱导细胞凋亡;Janus激酶-信号转导和转录激活因子(Jak-STAT)信号转导途径参与细胞的增殖、分化、凋亡及免疫调节等过程,Duan等[35]发现 CDDO-Me能抑制耐紫杉醇的卵巢癌OVCAR8TR细胞中的酪氨酸蛋白激酶——Jak2激酶和Scr激酶,进而抑制下游STAT3的磷酸化及核转运,导致受STAT3调节的相关抗凋亡蛋白(如BclxL)水平下降,从而诱导细胞凋亡;Deeb等[36]发现CDDO-Me可通过抑制胰腺癌PC-3细胞中的抗凋亡通路——丝氨酸/苏氨酸激酶[AKT,也称为蛋白激酶B(PKB)]通路和哺乳动物雷帕霉素靶蛋白(mTOR)通路诱导细胞凋亡。Liby等[37]推测齐墩果烷三萜类化合物母核的C1和C9充当了迈克尔加成反应的电子受体,易被包括巯基在内的电子供体进攻,PPARγ和IKK等蛋白质的活性中心均含有半胱氨酸,故而可与齐墩果烷三萜类化合物形成加合物,从而触发下游促凋亡反应。
3 结语
目前,对齐墩果烷三萜类化合物诱导肿瘤细胞凋亡的分子机制的研究还在进行中,有关文献报道不断问世,但最终定论尚未阐明。
中国药科大学新药研究中心 Ding等[38]曾对CDDO进行内酯化,合成了一系列结构新颖的2-氰基-3,12-二氧代齐墩果烷-1,9-二烯-28,13β-内酯化合物。笔者所在课题组对此类化合物进行了抗肿瘤活性初筛,并初步探讨了其可能的作用机制。初步研究结果表明:其中化合物8对肝癌细胞HepG2 的抑制活性最强,IC50为 1.86 μmol·L-1。初步机制研究结果显示,HepG2细胞经该化合物处理后,线粒体膜电位降低,细胞抗氧化能力减弱,线粒体中c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路和p38丝裂原活化蛋白激酶(p38 MAPK)信号通路被激活,进而使Bax与Bcl-2比值升高,促发细胞色素C和AIF的释放。今后还将进一步研究该类化合物诱导肿瘤细胞凋亡的机制及其体内抗肿瘤作用,以期为相关药物的开发提供依据。

[1]Connolly J D,Hill R A.Triterpenoids[J].Nat Prod Rep,2005,22(4):487-503.
[2]Brookes P S,Morse K,Ray D,et al.The triterpenoid 2-cyano-3,12-dioxooleana-1,9-dien-28-oic acid and its derivatives elicit human lymphoid cell apoptosis through a novel pathway involving the unregulated mitochondrial permeability transition pore[J].Cancer Res,2007,67(4):1793-1802.
[3]Kim E H,Deng C X,Sporn M B,et al.CDDO-imidazolide induces DNA damage,G2/M arrest and apoptosis in BRCA1-mutated breast cancer cells[J].Cancer Prev Res,2011,4(3):425-434.
[4]Hyer M L,Shi R,Krajewska M,et al.Apoptotic activity and mechanism of 2-cyano-3,12-dioxoolean-1,9-dien-28-oic-acid and related synthetic triterpenoids in prostate cancer[J].Cancer Res,2008,68(8):2927-2933.
[5]Deeb D,Gao X H,Arbab A S,et al.CDDO-Me:A novel synthetic triterpenoid for the treatment of pancreatic cancer[J].Cancers,2010,2(4):1779-1793.
[6]Duan Z,Ames R Y,Ryan M,et al.CDDO-Me,a synthetic triterpenoid,inhibits expression of IL-6 and Stat3 phosphorylation in multi-drug resistant ovarian cancer cells[J].Cancer Chemother Pharmacol,2009,63(4):681-689.
[7]Ryu K,Susa M,Choy E,et al.Oleanane triterpenoid CDDO-Me induces apoptosis in multidrug resistant osteosarcoma cells through inhibition of Stat3 pathway[J].BMC Cancer,2010,10(1):187.
[8]Hughes D T,Martel P M,Kinlaw W B,et al.The synthetic triterpenoid CDDO-Im inhibits fatty acid synthase expression and has antiproliferative and proapoptotic effects in human liposarcoma cells[J].Cancer Invest,2008,26(2):118-127.
[9]Alabran J L,Cheuk A,Liby K,et al.Human neuroblastoma cells rapidly enter cell cycle arrest and apoptosis following exposure to C-28 derivatives of the synthetic triterpenoid CDDO[J].Cancer Biol Ther,2008,7(5):709-717.
[10]Ray D M,Morse K M,Hilchey S P,et al.The novel triterpenoid 2-cyano-3,12-dioxooleana-1,9-dien-28-oic acid(CDDO)induces apoptosis of human diffuse large B-cell lymphoma cells through a peroxisome proliferator-activated receptor gamma-independent pathway[J].Exp Hematol,2006,34(9):1202-1211.
[11]Ahmad R,Liu S,Weisberg E,et al.Combining the FLT3 inhibitor PKC412 and the triterpenoid CDDO-Me synergistically induces apoptosis in acute myeloid leukemia with the internal tandem duplication mutation[J].Mol Cancer Res,2010,8(7):986-993.
[12]Riccioni R,Senese M,Diverio D,et al.Resistance of acute myeloid leukemic cells to the triterpenoid CDDO-imidazolide is associated with low caspase-8 and FADD levels[J].Leuk Res,2008,32(8):1244-1258.
[13]Chauhan D,Li G,Podar K,et al.The bortezomib/proteasome inhibitor PS-341 and triterpenoid CDDO-Im induce synergistic anti-multiple myeloma(MM)activity and overcome bortezomib resistance[J].Blood,2004,103(8):3158-3166.
[14]Samudio I,Kurinna S,Ruvolo P,et al.Inhibition of mitochondrial metabolism by methyl-2-cyano-3,12-dioxooleana-1,9-diene-28-oate induces apoptotic or autophagic cell death in chronic myeloid leukemia cells[J].Mol Cancer Ther,2008,7(5):1130-1139.
[15]Suh W S,Kim Y S,Schimmer A D,et al.Synthetic triterpenoids activate a pathway for apoptosis in AML cells involving downregulation of FLIP and sensitization to TRAIL[J].Leukemia,2003,17(11):2122-2129.
[16]Liby K,Royce D B,Williams C R,et al.The synthetic triterpenoids CDDO-methyl ester and CDDO-ethyl amide prevent lung cancer induced by vinyl carbamate in A/J mice[J].Cancer Res,2007,67(6):2414-2419.
[17]Jutooru I,Chadalapaka G,Abdelrahim M,et al.Methyl 2-cyano-3,12-dioxooleana-1,9-dien-28-oate decreases specificity protein transcription factors and inhibits pancreatic tumor growth:role of microRNA-27a[J].Mol Pharmacol,2010,78(2):226-236.
[18]Deeb D,Gao X,Liu Y,et al.Synthetic triterpenoid CDDO prevents the progression and metastasis of prostate cancer in TRAMP mice by inhibiting survival signaling[J].Carcinogenesis,2011,32(5):757-764.
[19]Leytin V,Allen D J,Mutlu A,et al.Mitochondrial control of platelet apoptosis:Effect of cyclosporin A,an inhibitor of the mitochondrial permeability transition pore[J].Lab Invest,2009,89(4):374-384.
[20]Green D R,Kroemer G.The pathophysiology of mitochondrial cell death[J].Science,2004,305(5684):626-629.
[21]Samudio I,Konopleva M,Hail N Jr,et al.2-Cyano-3,12-dioxooleana-1,9-dien-28-imidazolide(CDDO-Im)directly targets mitochondrial glutathione to induce apoptosis in pancreatic cancer[J].J Biol Chem,2005,280(43):36273-36282.
[22]Samudio I,Konopleva M,Pelicano H,et al.A novel mechanism of action of methyl-2-cyano-3,12 dioxoolean-1,9 diene-28-oate:direct permeabilization of the inner mitochondrial membrane to inhibit electron transport and induce apoptosis[J].Mol Pharmacol,2006,69(4):1182-1193.
[23]Hüttemann M,Pecina P,Rainbolt M,et al.The multiple functions of cytochrome c and their regulation in life and death decisions of the mammalian cell:from respiration to apoptosis[J].Mitochondrion,2011,11(3):369-381.
[24]Fadeel B,Ottosson A,Pervaiz S.Big wheel keeps on turning:apoptosome regulation and its role in chemoresistance[J].Cell Death Differ,2008,15(3):443-452.
[25]Lee K K,Shimoji M,Hossain Q S,et al.Novel function of glutathione transferase in rat liver mitochondrial membrane:role for cytochrome c release from mitochondria[J].Toxicol Appl Pharmacol,2008,232(1):109-118.
[26]Adams J M,Cory S.The Bcl-2 apoptotic switch in cancer development and therapy[J].Oncogene,2007,26(9):1324-1337.
[27]Konopleva M,Tsao T,Ruvolo P,et al.Novel triterpenoid CDDO-Me is a potent inducer of apoptosis and differentiation in acute myelogenous leukemia[J].Blood,2002,99(1):326-335.
[28]Kim K B,Lotan R,Yue P,et al.Identification of a novel synthetic triterpenoid,methyl-2-cyano-3,12-dioxooleana-1,9-dien-28-oate,that potently induces caspase-mediated apoptosis in human lung cancer cells[J].Mol Cancer Ther,2002,1(3):177-184.
[29]Petronelli A,Saulle E,Pasquini L,et al.High sensitivity of ovarian cancer cells to the synthetic triterpenoid CDDO-imidazolide[J].Cancer Lett,2009,282(2):214-228.
[30]Otera H,Ohsakaya S,Nagaura Z,et al.Export of mitochondrial AIF in response to proapoptotic stimuli depends on processing at the intermembrane space[J].EMBO J,2005,24(7):1375-1386.
[31]Konopleva M,Tsao T,Estrov Z,et al.The synthetic triterpenoid 2-cyano-3,12-dioxooleana-1,9-dien-28-oic acid induces Caspase-dependent and-independent apoptosis in acute myelogenous leukemia[J].Cancer Res,2004,64(21):7927-7935.
[32]Norberg E,Orrenius S,Zhivotovsky B.Mitochondrial regulation of cell death:processing of apoptosis-inducing factor(AIF)[J].Biochem Biophys Res Commun,2010,396(1):95-100.
[33]Tsao T,Kornblau S,Safe S,et al.Role of peroxisome proliferator-activated receptor-γ and its coactivator DRIP205 in cellular responses to CDDO(RTA-401)in acute myelogenous leukemia[J].Cancer Res,2010,70(12):4949-4960.
[34]Shishodia S,Sethi G,Konopleva M,et al.A synthetic triterpenoid,CDDO-Me,inhibits IκBα kinase and enhances apoptosis induced by TNF and chemotherapeutic agents through down-regulation of expression of nuclear factor κB-regulated gene products in human leukemic cells[J].Clin Cancer Res,2006,12(6):1828-1838.
[35]Duan Z,Ames R Y,Ryan M,et al.CDDO-Me,a synthetic triterpenoid,inhibits expression of IL-6 and Stat3 phosphorylation in multi-drug resistant ovarian cancer cells[J].Cancer Chemother Pharmacol,2009,63(4):681-689.
[36]Deeb D,Gao X,Jiang H,et al.Oleanane triterpenoid CDDO-Me inhibits growth and induces apoptosis in prostate cancer cells by independently targeting pro-survival Akt and mTOR[J].Prostate,2009,69(8):851-860.
[37]Liby K T,Yore M M,Sporn M B.Triterpenoids and rexinoids as multifunctional agents for the prevention and treatment of cancer[J].Nat Rev Cancer,2007,7(5):357-369.
[38]Ding Y,Huang Z J,Yin J,et al.DDQ-promoted dehydrogenation from natural rigid polycyclic acids or flexible alkyl acids to generate lactones by a radical ion mechanism[J/OL].Chem Commun,2011.[2011-07-15].http://pubs.rsc.org/en/content/articlelanding/2011/CC/c1cc11633a.

