二氢吡啶类钙通道拮抗剂的剂型研究进展
覃小恒, 邹巧根, 张尊建*
(1.教育部药物质量与安全预警重点实验室,江苏 南京 210009;2.中国药科大学分析测试中心,江苏 南京 210009;3.南京工业大学生物与制药工程学院,江苏 南京 210009)
高血压是我国最常见的心脑血管疾病,也是目前对人类威胁最大,死亡率最高的疾病之一。二氢吡啶类(dihydropyridine,DHP)钙拮抗剂,俗称“地平类降压药”,为20世纪60年代后期研究开发的一类新型药物,现已成为治疗高血压最重要的药物类别之一。第一代DHP钙拮抗剂又称短效DHP钙拮抗剂,代表药物有硝苯地平和尼卡地平等,其体内半衰期(t1/2)及药效持续时间均较短;第二代DHP也称长效DHP钙拮抗剂,如贝尼地平、尼索地平和尼群地平等,与第一代DHP钙拮抗剂相比,第二代DHP钙拮抗剂药效持续时间显著延长,但其水溶性较差,即使药物在体内释放完全,生物利用度也较低;第三代DHP钙拮抗剂克服了前两代DHP钙拮抗剂药效持续时间短及生物利用度低的缺点,代表化合物有氨氯地平和拉西地平等。以氨氯地平为例,其在人体中的t1/2为35~50 h,生物利用度为64% ~88%,显著优于前两代DHP钙拮抗剂[1-3]。
第一、二代DHP钙拮抗剂大多为水难溶性化合物,且吸收过程中可发生首过效应,从而导致其生物利用度较低;另外,此类药物药效持续时间通常较短,若要达到平稳降压的目的则需让患者频繁服药,因此依从性较低。然而这些药物又有其独特的临床价值而不能被替代,因此,除通过大规模的有机合成和筛选工作,获得生物利用度和t1/2均显著改善的新型DHP钙拮抗剂外,研究人员也尝试对现有的DHP钙拮抗剂进行剂型改进,以达到改善其药动学及药效学特性的目的。本文重点介绍国内外有关DHP钙拮抗剂剂型改进方面的研究成果,旨在为部分DHP钙拮抗剂类药物的进一步开发提供参考。
1 提高药物的生物利用度
如前所述,导致DHP钙拮抗剂类药物生物利用度较低的原因主要有两点:第一,溶解性较差。药物口服后先在消化道内溶解于消化液中,然后通过被动扩散或主动转运等吸收机制进入血液循环,若其溶解性较差,则在消化液中溶出速率也偏低,从而影响药物吸收;第二,存在首过效应,首过效应可使一部分药物被肝药酶代谢而损失,导致生物利用度偏低。针对上述问题,研究人员采用固体分散技术、环糊精包合技术和脂质体技术等手段,提高药物的体内溶出度;通过改变给药途径如静脉给药、鼻腔给药或口腔黏膜给药以避免首过效应以改善药物在体内的吸收,进而提高生物利用度。
1.1 固体分散体
固体分散体(solid dispersion,SD)系指药物以分子、胶体、微晶或无定形的形式均匀分散在固态载体物质中而形成的体系。应用SD技术,可大大提高难溶性药物的溶出度,从而提高其口服生物利用度。常见SD制备方法有熔融法、溶剂法和研磨法等。
管清香等[4]采用熔融法,将聚乙二醇 6000(PEG 6000)和泊洛沙姆188按质量比1∶39混合作为载体制备了尼莫地平的固体分散体。体外溶出试验显示,该固体分散体中尼莫地平在pH 6.8磷酸盐缓冲液中溶出50%所需时间仅为19.90 min,远远短于尼莫地平原料药粉末(溶出50%所需时间在1000 min以上)。赵艳花等[5]采用熔融法,以泊洛沙姆188为载体制备了尼群地平固体分散体,发现药物在水中的溶解度随载体比例增大而升高:尼群地平在水中的溶解度为0.102 mg·L-1,当尼群地平与泊洛沙姆188的质量比为1∶1时,尼群地平溶解度为5.351 mg·L-1;而当该比例达1∶8时,尼群地平在水中溶解度大于38.26 mg·L-1,为单独使用尼群地平时药物溶解度的300倍以上。靖博宇等[6]采用溶剂法、熔融法和溶剂蒸发-沉积技术,分别以聚乙烯吡咯烷酮(PVPK30)、泊洛沙姆188或吐温80为载体,制备了非洛地平固体分散体。体外释药研究显示,药物累积释放量随载体比例增大而升高,但升高到一定水平便再无显著变化:当非洛地平与PVPK30的质量比为1∶10时,非洛地平在水中1 h内的累积释放量最高可达58%;非洛地平与泊洛沙姆的质量比为1∶8时,非洛地平在1 h内的累积释放量最高可达70%;非洛地平、吐温80和吸附剂聚乙烯聚吡咯烷酮(PVPP)的质量比为1∶4∶5时,1 h累积释放量最高可达90%以上,约为相同溶出条件下非洛地平原料药的15倍。不同制备工艺对固体分散体中药物的溶出度也有不同程度的影响。Won等[7]以羟丙甲纤维素(HPMC)为载体,氢化蓖麻油和泊洛沙姆为表面活性剂,分别采用传统溶剂蒸发法(CSE)和超临界抗溶剂沉积法(SAS)制备了非洛地平的固体分散体,溶解性研究显示,上述2种固体分散体中非洛地平在水中的溶解度分别为40.55和107.24 mg·L-1,而非洛地平原料药的溶解度仅为0.5 mg·L-1。将SAS法制备的非洛地平固体分散体压制成片,其在pH 6.5的磷酸缓冲液中2 h内溶出度在90%以上。
1.2 环糊精包合物
包合物系指某种物质分子被全部或部分包合于另一种分子的空穴结构内所形成的特殊的络合物。包合物技术可提高难溶性药物的溶解度和生物利用度,也可调节药物释放速率,掩盖药物不良气味。目前,制剂工艺中常用包合材料为环糊精(cyclodextrin,CD)及其衍生物。环糊精的空穴开口处呈亲水性,空穴内部呈疏水性,若将疏水性药物包合于环糊精内,则可改善药物水溶性不佳的问题。管清香等[8]采用饱和水溶液法制备了尼群地平的环糊精包合物,经过正交试验确定最佳制备条件为:尼莫地平与β-CD的摩尔比1∶2,搅拌时间4 h,搅拌温度50℃。该条件下所制得的尼群地平环糊精包合物在蒸馏水中溶解度为(8.48±0.07)mg·L-1,约为尼群地平原料药溶解度的10.5倍,显著改善了尼群地平的溶解性。
1.3 脂质体和前体脂质体
脂质体是由磷脂和胆固醇组成的具有类似生物膜双分子层结构的封闭膜性微球,其可将脂溶性药物包裹在疏水基团的夹层中,从而增加药物的水溶性。此外,该类药物载体具有组织相容性、细胞亲和性和靶向性等特点,还可使所载药物缓释或控释,因而近年来受到研究人员的广泛关注。Wang等[9]采用改良乙醇注射法制备了尼莫地平脂质体,在大鼠体内进行的药动学研究显示,静脉注射该脂质体的尼莫地平AUC为普通尼莫地平注射液的1.78倍。
前体脂质体(proliposome)是一种干燥的、具有良好流动性的粉末,系将脂质体膜材与药物的混合溶液在减压搅拌下逐步分布到一种可溶性固体载体表面所形成的体系。普通脂质体在放置过程中,其磷脂双分子层易发生聚集,从而破坏了体系的均一性和稳定性,使药物易发生渗漏,因此其使用受到了一定限制;前体脂质体则由于尚未形成脂质双分子层,不会发生脂质体聚集融合,使用前只需加水即得脂质体,因此可在一定程度上克服传统脂质体稳定性不佳、不宜久置的缺陷。夏萌申等[10]采用薄膜载体沉积法制备了尼莫地平的前体脂质体。分别给大鼠尾静脉注射上述尼莫地平前脂质体和普通尼莫地平注射液,结果显示两者AUC分别为42991.2和24025.9 μg·min·L-1,表明尼莫地平制成前脂质体后其生物利用度明显提高。
1.4 自乳化释药系统
自乳化释药系统 (self emulsifying drug delivery system,SEDDS)是由药物、油相和表面活性剂按一定比例组成的各向同性的混合物,通常还含有一种或多种亲水性的助溶剂或辅助乳化剂。SEDDS在胃肠道内,或环境温度适宜(通常为37℃)及温和搅拌的条件下,可迅速形成精细的水包油乳剂结构。通常SEDDS所形成的精细乳剂粒径范围较大,从几纳米到几微米不等。当体系中亲水性表面活性剂较多或在体系中添加助溶剂时,轻微搅动下即可形成更精细的乳剂(粒径范围为100~250 nm),即自微乳化释药系统(SMEDDS)[11-12]。SEDDS可提高水难溶性药物和脂溶性药物的水溶性,促进药物的吸收,从而提高药物的生物利用度;其水包油结构可避免稳定性较差的药物发生水解及刺激性药物对胃肠道的刺激;此外,其还具有服用方便、制备简单以及适合大规模生产等优点。因此,SEDDS也常被用作DHP钙拮抗剂的释药系统。
纪海英等[13]用肉豆蔻酸异丙酯、葵酸酯、吐温80和十二烷基硫酸钠制备了载有尼群地平的SEDDS,将所得SEDDS灌装于软胶囊中,然后进行体外释药研究,结果显示,胶囊中尼群地平在蒸馏水、0.1 mol·L-1HCl和 pH 6.8磷酸盐缓冲液中45 min时的溶出度均在75%以上,远高于市售尼群地平片剂(约为6%)。传统的SEDDS通常为液态形式,为方便口服需灌装在软胶囊或硬胶囊中,但该剂型存在药物易泄露与沉降、胶囊老化,以及生产成本偏高等缺点。因此,近来也有人尝试将液态SEDDS改良为固态 SEDDS。Wang等[14]采用挤出-滚圆法,以微粉硅胶(SYLOIDⓇ244 FP)为吸附剂,将尼群地平液态SEDDS制成了固态SEDDS,并加入微晶纤维素(MCC)改善其成粒性。在比格犬体内进行的药动学研究显示,经口使用尼群地平固态SEDDS的生物利用度约为尼群地平普通片剂的1.6倍,虽与尼群地平的液态SEDDS相近,但却具有更好的制剂稳定性,以及更低的药物泄露率和沉降率。
1.5 微乳
微乳系由水相、油相、表面活性剂和助表面活性剂按适当比例混合而自发形成的各向同性、透明、热力学稳定的一种分散体系,液滴粒径为100~1000 nm时称为亚微乳,粒径为10~100 nm时则称为纳米乳。亚微乳是近年来研究较多的一种新型液体剂型,可使药物均匀分布于油相,大大提高其稳定性,适合用作易水解药物的载药系统;也能提高水难溶性药物的溶解度,解决其在被制成注射剂使用时易出现的问题。传统的尼莫地平注射剂在放置过程中易析出晶体,使用前需温热使之溶解;此外,由于尼莫地平水溶性较差,需在注射剂中添加乙醇促进药物溶解,但若长期用药,制剂中的乙醇会对血管壁造成刺激。为克服这一问题,张翠霞等[15]采用磷脂和泊洛沙姆188(质量比为2∶1)制备了尼莫地平亚微乳,包封率达97.9%,该释药体系在常温及加速试验条件下放置3个月均性质稳定,克服了传统尼莫地平注射剂不稳定及刺激性较大等缺点,使尼莫地平静脉给药更加安全。
纳米乳具有经热压灭菌或离心也不会分层,液滴粒径小,黏度低,可减轻注射时的疼痛感及缓释和靶向性等特性,因此,作为一种新型载药系统受到广泛关注。Jain等[16]以吐温80为表面活性剂、Transcutol P(二乙二醇单乙基醚)为增溶剂、SolutolⓇHS-15(聚乙二醇十二羟基硬脂酸酯)为辅助表面活性剂,制备了尼群地平纳米乳,用于鼻腔喷雾给药。该制剂稳定性较好,放置1个月体系无明显变化,在家兔中进行的研究显示,该尼群地平纳米乳鼻喷剂和市售口服片剂AUC分别为1524.81 和 932.05 ng·min·L-1,表明鼻喷剂生物利用度显著高于市售尼群地平片剂。
1.6 口腔粘附制剂
口腔粘附制剂是一种新型药物释放系统,主要是利用一些药用高分子材料可与口腔黏膜紧密粘附的特性,将药物与合适的高分子材料制成片剂粘附于口腔黏膜,使药物经由黏膜吸收,从而避免药物的首过效应,提高生物利用度。Charde等[17]采用羟丙基甲基纤维素(HPMC)为生物粘附剂,以聚环氧乙烯(PEO)为缓释材料制备了乐卡地平口腔粘附片,给家兔分别经口使用乐卡地平普通片剂与该课题组制备的口腔粘附片,结果显示2种制剂血药浓度达峰时间(tmax)分别为1.0和2.0 h,AUC分别为(1202.5 ±143.8)和(1997.4 ±261.0)μg·h·L-1,表明该课题组制备的乐卡地平口腔粘附片生物利用度明显高于普通片剂。
2 延长药物的作用时间
硝苯地平等短效DHP拮抗剂给药后的血药浓度迅速达到峰值,不利于用药者血压的平稳下降(Ochs等,Klin Wochenschr,1984 年;Rämsch 等,Am J Nephrol,1986年),而且该类药物的普通制剂需多次给药,剂量也需严格控制。然而,多次给药往往容易造成反射性心率加快,已有越来越多的证据表明短效DHP钙拮抗剂在降低心血管病发病率和死亡率以及改善病人生活质量方面并不令人满意,且有增加癌症发病率和胃肠道出血的风险[18]。因此,近年来国内外研究人员也在相继开发DHP钙拮抗剂类药物的缓控释制剂,一方面可减少给药次数,提高疗效及病人的依从性;另一方面也能使病人血压平稳下降,用药更为安全。
2.1 骨架型缓释片
骨架型缓释片是最常见的缓释制剂类型,其又可分为溶蚀型、亲水凝胶型和非亲水凝胶型。HPMC为常用骨架材料,其遇水则发生水化呈凝胶状,药物可通过扩散和溶蚀双重机制从中释放。陈崇清[19]以HPMC为骨架材料,制备了尼索地平的亲水凝胶型骨架缓释片。体外释放研究显示,该骨架缓释片在0.5%十二烷基硫酸钠水溶液中12 h内呈一级释放,缓释行为与拜耳公司开发的尼索地平缓释片SULARⓇ相似。向军涛等[20]采用聚甲基丙烯酸甲酯作为缓释骨架材料制备了硝苯地平非亲水凝胶型缓释片,克服了HPMC作为骨架材料时缓释片释放速度容易受释放介质离子强度影响的缺点,使缓释片中硝苯地平在消化道内不同部位均可稳定释放。该缓释片制备工艺重复性好,在0.1 mol·L-1HCl溶液中2、4和8 h时的累积释放度分别为30% ~50%、50% ~70%和70%以上,符合药品标准规定。Penwest制药公司研制了一种名为TIMERxⓇ的药物缓释系统,该系统是以杂多糖黄原胶和半乳甘露聚糖槐豆胶这2种天然多糖为材料制成的亲水骨架基质材料,在水性环境下骨架基质层中的2种多糖起协同作用,形成一层紧密的、可缓慢溶蚀的凝胶层,从而控制药物从制剂中释放的速度。Mylan公司和赛诺菲-圣德拉堡(Sanofi-Synthelabo)公司分别利用这项专利技术开发了硝苯地平的缓释片,商品名分别为Generic Version of ProcardiaⓇXL(即由拜耳公司开发的ProcardiaⓇXL的仿制药)和SlofedipineⓇXL[21],每日仅需服药 1 次,而普通硝苯地平片剂需每日服药3次。
近来,有研究人员开发了一种将速释与缓释技术相结合的新型制剂,主要目的是在减少患者服药次数的同时降低血药浓度峰谷波动的幅度,使血药浓度达到相对平稳的水平。张勇等[22]根据尼索地平在人体胃和小肠吸收能力较强而在结肠段吸收较弱的特点,制备了尼索地平控释包心片。该片剂外层为缓释部分,以HPMC为药物缓释骨架材料,使药物在胃和小肠部分缓慢释药;片心为速释部分,可在结肠段迅速释药以弥补该部位吸收较弱的缺陷。在0.2%十二烷基硫酸钠水溶液中进行的体外释放研究结果显示,该制剂的缓释部分在第0~6 h释放,速释部分在第6~10 h内释放。两阶段的释药机制均为非Fick扩散,即药物扩散与骨架溶蚀协同作用。在缓释制剂中加入速释部分的另一个目的是为了在药物长时间维持治疗浓度的前提下,迅速达到降压效果。王颖等[23]研制了尼群地平双层缓释片,其中包含速释层与缓释层。在含有乙醇的人工胃液中进行的体外释放研究结果显示,片剂速释部分首先释放,10 min内释药量达40%,提示该制剂口服后可在体内迅速达到有效治疗浓度;随后,缓释部分缓慢释放,可维持24 h。
2.2 渗透泵片
渗透泵片是由药物、半透膜材料、渗透压活性物质及推动剂等组成的一种控释制剂,以药片内高渗透压为推动力恒速释放药物,且释药不受胃肠道生理环境影响。渗透泵片按结构特点可分为单室型和多室型。单室型渗透泵片一般适用于易溶性药物,包括片芯和包衣膜两部分,其中,片芯由药物和高渗透性物质组成,包衣膜为半透膜,膜上通常打一小孔作为药物输出孔道。多室型渗透泵片一般至少由药室和动力室这两部分组成,使用时,水分由包衣膜进入动力室,动力室中的高分子材料吸水膨胀,从而挤压药室使药物经包衣膜上小孔释放(见图1)。而难溶性药物的溶解度较低,难以在片芯微环境中形成较高的浓度和渗透压来维持有效释药速度,需使用大量促渗剂来维持持久恒定的渗透压,但此举往往使药片片重超过正常范围。因此,单室型渗透泵片不适用于难溶性药物,需增加动力室,即制成多室型渗透泵片方能确保药物恒速释放。德国拜耳公司开发的硝苯地平控释片ProcardiaⓇXL就采用了多室型渗透泵片技术。G·韦尼奥等[24]发明了尼索地平多室型控释口服片剂,其中心层含有尼索地平和控释成分;上下两层为阻挡层,含有可膨胀且易溶蚀的聚合物,可使药物延迟一段时间再释放;最外层包有半透膜。人体药动学研究表明:该课题组制备的尼索地平控释片tmax为9.42 h,明显长于尼索地平普通片(tmax为1 h)。在尼索地平载药量相同的条件下,该课题组制备的尼索地平控释片和市售尼索地平缓释片SULARⓇ的 AUC 分别为72.84 和68.21 μg·h·L-1。

图1 双室渗透泵片结构示意图Figure 1 The structural diagram of bilayer-core osmotic pump tablet
叶琳琳等[25]采用聚环氧乙烷为助悬剂,用激光打孔机在外层包衣膜上下各打一个释药孔,如此制备的硝苯地平单室型渗透泵片与市售口服硝苯地平双室型渗透泵片在5%乙醇溶液中释放行为一致,具有良好的零级释放特征;且21 h内制剂形态良好,可有效防止药物突释。虽然在国外双室型渗透泵片的产品已经上市,但其在制备过程中需使用带有药物辨识功能的激光打孔机,成本高昂,且多层渗透泵片剂的制备工艺复杂,故而其在国内的开发和应用均受到一定限制,因此研发结构简单、适合工业化生产的渗透泵片成为国内该领域的热点。徐向宁[26]使用带针冲头的压片机制备了由带孔药物层和助推层组成的双层片芯(见图2),并对其进行包衣,即得硝苯地平双室型渗透泵片,通过调整包衣膜厚度及增塑剂比例使药物达到零级释放。该工艺的创新之处在于,药物层上的孔具有足够大的空间,包衣膜厚度较小,因此在包衣过后,孔洞不会被包衣膜完全封闭,未被包裹的空隙即渗透泵片的释药孔,可使药物经由小孔缓慢释放,免去激光打孔过程,大大降低了生产成本。体外释放研究显示,该课题组制备的硝苯地平渗透泵片在人工胃液和肠液中24 h内接近恒速释放,释药速率约为每分钟3.75%,其释放曲线与市售硝苯地平控释片ProcardiaⓇXL相比,f2因子达62.4,表明其控释效果良好。
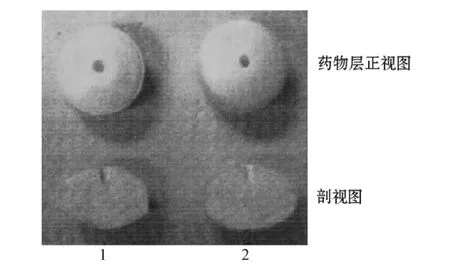
图2 使用带针冲头压片机制备的双层渗透泵片Figure 2 The bilayer-core osmotic pump tablet prepared by tablet press machine with needle on its punch pin
2.3 缓释微丸
微丸为一种粒径在0.25~2.5 mm之间的微球或类球形制剂,药物以溶解状态或分散状态存在于球形骨架中,口服后可广泛、均匀地分散在胃肠道。该剂型具有流动性好、释药稳定以及局部刺激小等优点。采用不同材料对微丸进行包衣,可达到缓、控释的目的,常用缓释微丸包括膜控型、骨架型,以及膜控与骨架技术结合的微丸。任君刚等[27]先以聚乙二醇4000为载体,制备了硝苯地平固体分散体,然后采用挤出-滚圆法制备了硝苯地平24 h骨架型缓释微丸。在犬中进行的药动学研究结果显示,该课题组自制微丸与硝苯地平控释片ProcardiaⓇXL的tmax分别为(5.0±1.1)和(5.7±0.8)h,AUC 分别为(311.3 ±71.7)和(308.6 ±70.1)μg·h·L-1,相对生物利用度为(102.1±18.4)%,提示两者具有生物等效性;与ProcardiaⓇXL相比,该课题组设计的制备工艺更为简单。刘伟芬[28]将其制备的硝苯地平膜控型脉冲释药缓释微丸给大鼠灌胃使用,结果显示硝苯地平在给药后约4.49 h开始释放,6.18 h时血药浓度达到峰值,更符合时辰治疗学强调的在特定时间产生一定药物浓度的要求;而普通硝苯地平片剂血药浓度达峰时间仅为0.61 h,无延迟释药效果。
DHP钙拮抗剂类药物在吸收过程中普遍存在较强的首过效应,制成缓释制剂后药物吸收时间延长,故而生物利用度低于相同剂量下的普通制剂。为解决这一问题,可增加给药剂量或添加速释部分以使肝药酶达到饱和状态。Teramura等(Xenobiotica,1997年)将盐酸巴尼地平的速释微丸与缓释微丸按质量比1∶2混合,得到了生物利用度较高的盐酸巴尼地平缓释胶囊,AUC0-∞为盐酸巴尼地平普通制剂的97%±15%,是单独口服盐酸巴尼地平缓释微丸的1.4倍。
2.4 原位凝胶
原位凝胶系指一类以溶液形式存在的制剂,给药后立即在用药部位发生相转变,由液态转化为非化学键交联的半固体凝胶。这种由水溶性高分子材料制备的原位凝胶具有高度亲水性的三维网格结构,以及良好的组织相容性、生物黏附性和独特的溶液-半固体凝胶转变性质,此外,其还有制备工艺简便、应用方便、在用药部位滞留时间较长及缓释性能良好等优点。任逢晓等[29]采用泊洛沙姆407和泊洛沙姆188为载体材料制备了尼莫地平脂质体原位凝胶。给家兔左后腿股四头肌肌内注射该自制凝胶或尼莫地平溶液,结果显示,两者的tmax分别为(2.0±0.7)和(0.6±0.3)h,表明该原位凝胶系统具有明显缓释作用;此外,自制原位凝胶和溶液剂中尼莫地平的AUC0-∞分别为(402 ±15)和(227 ±53)μg·h·L-1,提示原位凝胶中尼莫地平的生物利用度更高。
3 结语
随着科学技术的不断发展,各种增溶技术及缓控释技术相继出现与成熟,使得一些原本因理化性质与体内药动学参数不佳而应用受到限制的药物重获新生,DHP钙拮抗剂便是很好的例子。根据临床高血压治疗所强调的平稳降压的原则,长效DHP钙拮抗剂越来越受到患者青睐,缓控释剂型的开发和改进仍将是DHP钙拮抗剂研究领域的热点。可以相信,随着对制剂技术研究的不断深入,一定会有更多溶解性好、生物利用度高及作用时间持久的新型DHP钙拮抗剂和相关新制剂问世,为患者带来希望。
笔者所在课题组以盐酸巴尼地平为主药,聚甲基丙烯酸酯为包衣材料,制备了膜控型缓释微丸和速释微丸,目前正在进行处方工艺的优化和筛选工作,并计划以该制剂在比格犬体内的生物利用度为考察指标,确定速释成分与缓释成分的最佳配比,以期获得具有较高生物利用度的盐酸巴尼地平缓释微丸。
[1]Lüscher T F,Cosentino F.The classification of calcium antagonists and their selection in the treatment of hypertension.A reappraisal[J].Drugs,1998,55(4):509-517.
[2]孟舒献,温晓娜.二氢吡啶类钙通道阻滞剂的研究进展[J].广东药学院学报,2004,20(2):170-172.
[3]张石革,马国辉,臧靖.二氢吡啶类钙通道阻滞剂的研究进展与合理应用[J].中国全科医学,2006,9(4):314-316.
[4]管清香,林天慕,刘晶瑶,等.尼莫地平固体分散体的制备[J].吉林大学学报:医学版,2003,29(1):72-75.
[5]赵艳花,傅红兴,李校堃,等.尼群地平-泊洛沙姆188固体分散体的制备[J].温州医学院学报,2007,37(6):591-592.
[6]靖博宇,王志远,李燕,等.非洛地平固体分散体的制备和体外溶出度考察[J].沈阳药科大学学报,2010,27(3):185-190.
[7]Won D H,Kim ms,Lee S,et al.Improved physicochemical characteristics of felodipine solid dispersion particles by supercritical anti-solvent precipitation process[J].Int J Pharm,2005,301(1/2):199-208.
[8]管清香,林天慕,丁志英,等.尼群地平-β-环糊精包合物的制备[J].吉林大学学报:医学版,2005,31(5):811-813.
[9]Wang Z X,Deng Y J,Zhang X P,et al.Development and pharmacokinetics of nimodipine-loaded liposomes[J].J Pharm Pharmacol,2006,58(9):1289-1294.
[10]夏萌申,黄莉颖,殷璐璐.尼莫地平前体脂质体的制备和大鼠药动学的研究[J].华西药学杂志,2002,17(2):98-103.
[11]Gursoy R N,Benita S.Self-emulsifying drug delivery systems(SEDDS)for improved oral delivery of lipophilic drugs[J].BiomedPharmacother,2004,58(3):173-182.
[12]Kohli K,Chopra S,Dhar D,et al.Self-emulsifying drug delivery systems:an approach to enhance oral bioavailability[J].Drug Discov Today,2010,15(21/22):958-965.
[13]纪海英,张钧寿.尼群地平胶囊自乳化释药系统处方优化研究[J].中国药科大学学报,2004,35(3):211-214.
[14]Wang Z,Sun J,Wang Y,et al.Solid self-emulsifying nitrendipine pellets:preparation and in vitro/in vivo evaluation[J].Int J Pharm,2010,383(1/2):1-6.
[15]张翠霞,王东凯,王海凤,等.尼莫地平亚微乳的制备及其性质考察[J].中国新药杂志,2006,15(15):1264-1267.
[16]Jain R,Patravale V B.Development and evaluation of nitrendipine nanoemulsion for intranasal delivery[J].J Biomed Nanotechnol,2009,5(1):62-68.
[17]Charde S,Mudgal M,Kumar L,et al.Development and evaluation of buccoadhesive controlled release tablets of lercanidipine[J].AAPS PharmSciTech,2008,9(1):182-190.
[18]刘天行.对钙拮抗剂安全性的提示[J].中国医院药学杂志,2001,21(1):61.
[19]陈崇清.尼索地平凝胶骨架片的制备[J].中国现代药物应用,2009,3(11):5-6.
[20]向军涛,蒋琳兰.硝苯地平骨架缓释片的制备及体外释放度的考察[J].广东药学院学报,2006,22(5):489-491.
[21]张彦,吕竹芬.新型缓(控)释骨架片的研究进展[J].药品评价,2006,3(6):446-449.
[22]张勇,宗莉,平其能,等.尼索地平控释包心片释药机理的研究[J].中国药科大学学报,2003,34(5):426-429.
[23]王颖,侯峻冰.尼群地平双层缓释制剂:中国,1524526[P].2004-09-01.
[24]G·韦尼奥,P·格勒尼耶,A·尼安米斯.包含尼索地平的控释固体口服制剂:中国,101516352A[P].2009-08-26.
[25]叶琳琳,蒋国强,陈军,等.硝苯地平口服渗透泵片的制备及其体外释药特性[J].精细化工,2002,19(11):628-647.
[26]徐向宁.免激光打孔法制备双层芯渗透泵片的研究[D].杭州:浙江大学,2007.
[27]任君刚,邹梅娟,王悦,等.硝苯地平骨架缓释微丸的制备及在家犬体内的药物动力学[J].沈阳药科大学学报,2007,24(2):70-73.
[28]刘伟芬.硝苯地平脉冲释放微丸的研制[D].开封:河南大学,2007.
[29]任逢晓,姚静,周建平,等.LC-MS法研究尼莫地平脂质体原位凝胶在家兔体内的药动学[J].中国新药与临床杂志,2008,27(5):341-345.

