原代培养的恶性胶质瘤细胞表达死亡受体与TRAIL抵抗的关系
南栗岩 齐 玲 肖振晶 赵庆旭 王 伟 于洪泉 (吉化集团公司总医院药剂科,吉林 吉林 30)
肿瘤坏死因子相关凋亡诱导配体(TRAIL)是肿瘤坏死因子超家族中的一员,作为肿瘤治疗的新药,在美国已进入临床Ⅱ期试验阶段〔1〕。但由于在肿瘤治疗研究中,TRAIL一直存在治疗抵抗,因此,本文对原代培养的恶性胶质瘤细胞进行研究,通过观察TRAIL的两种受体——死亡受体(DR)4、DR5在恶性胶质瘤细胞中的表达,探讨在原代培养肿瘤细胞中存在的TRAIL抵抗问题。
1 材料与方法
1.1 细胞培养〔2〕取新鲜人脑胶质瘤组织(吉林大学第一医院提供,病理诊断为Ⅲ~Ⅳ级脑胶质瘤)。将组织剪成小块(1 mm×1 mm),置于离心管中,加入0.25%胰酶,37℃恒温水浴中孵育30 min,离心后弃上清,培养液重悬细胞,苔盼蓝计数活细胞,加入10%DMEM/F12(Gibco)培养液,以1×106个/75 cm2密度接种细胞,将培养瓶置入37℃、5%CO2孵箱、饱和湿度下进行培养,隔日换液,1∶3传代,获得3株恶性胶质瘤细胞株(GC417、GC321、GC125)。
1.2 免疫印迹检测恶性胶质瘤细胞中神经分裂症断裂基因(DISC)成分的表达〔3〕将细胞培养3 d,待细胞生长90%左右,弃培养液,磷酸盐缓冲液(PBS)充分洗涤细胞,弃PBS,0.25%胰酶消化,将细胞收集于1.5 ml离心管中,3 000 r/min离心5min,弃上清。PBS充分洗涤细胞,离心弃上清,每个样品加入50 μl的细胞裂解液,细胞充分裂解后,12 000 r/min 4℃离心15 min,上清移于另一管中,弃沉淀,Braford法检测样品蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺电泳(SDS-PAGE)跑胶分离样品,4℃转膜封闭后,加入相应一抗〔兔抗人死亡受体(DR)5多克隆抗体;兔抗人DR4多克隆抗体;兔抗人β-actin多克隆抗体;1∶1 000〕4℃孵育过夜。加入相应的二抗,室温、避光孵育1 h,胶片曝光拍照。
2 结果
Western印迹结果显示,在三株原代培养的恶性胶质瘤细胞株中,死亡受体DR5表达略有不同,GC321表达量明显高于其他两株细胞,GC125和GC417表达则明显减少。在三株细胞中DR4的表达差别不明显。见图1。
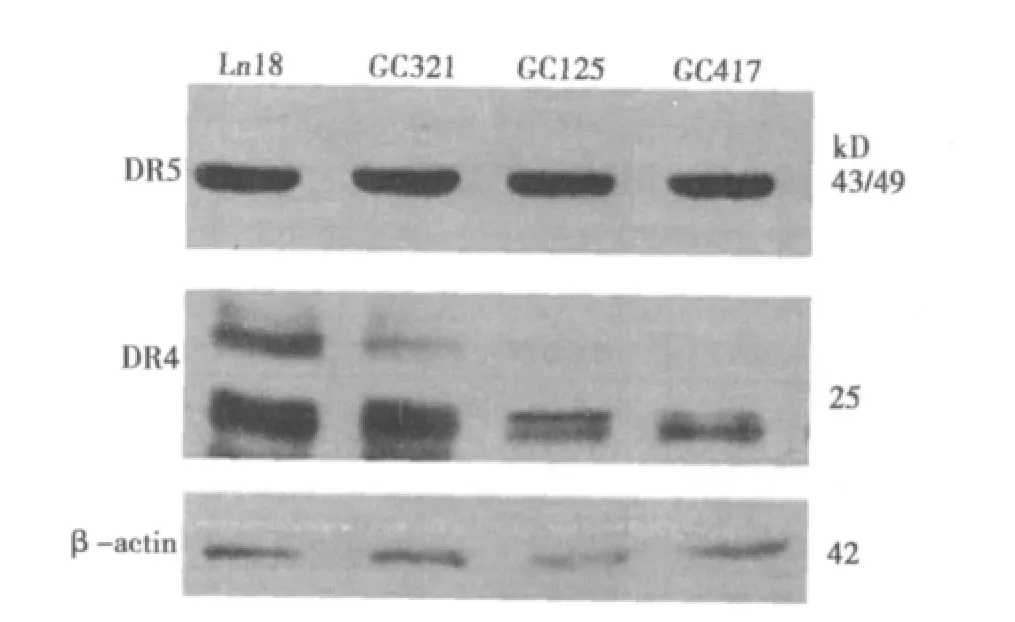
图1 恶性胶质瘤细胞表达DR5、DR4情况
3 讨论
TRAIL自发现至今,一直处于相对较热的研究状态。作为肿瘤坏死因子超家族中的一员,TRAIL可由体内的免疫系统细胞正常表达,并具有天然的肿瘤杀伤活性,对正常细胞无明显毒性作用〔1〕。国内外已进行了很多关于TRAIL的研究,但现在困扰科研人员的难题之一就是其在多种肿瘤研究过程中出现TRAIL抵抗现象。脑肿瘤是病死率最高的肿瘤之一,恶性肿瘤占70%以上〔4〕。很多胶质母细胞瘤细胞株及原代培养的胶质母细胞瘤对TRAIL诱导凋亡存在抵抗,并且发表许多关于抵抗方面的报道〔5~7〕。到目前为止,对于TRAIL在脑胶质瘤细胞中产生抵抗的机制还不十分清楚,国内对此研究较少,因此,本实验对原代培养的恶性胶质瘤表达DR5、DR4情况进行研究,初步探讨其表达与细胞凋亡之间的关系。
TRAIL受体有五种,包括:DR-DR4、DR5,诱捕受体(decoy receptor,DcR)-DcR1、DcR2 及护骨素(osteoprotegerin,OPG)。DR4、DR5均为Ⅰ型膜蛋白,含有两个结构域,一个胞外富含半胱氨酸区域(cysteine-rich domain,CRD),它与 TRAIL结合;另一个胞浆内的死亡结构域(death domain,DD),能够传递死亡信号,诱导肿瘤细胞凋亡。DcR1、DcR2及OPG与DR相似,但缺乏功能性细胞内死亡结构域,均不能传递死亡信号。正常组织和细胞中表达DcR1、DcR2,与DR竞争结合TRAIL,所以TRAIL对正常的组织和细胞无明显毒性作用〔8,9〕。DR4和 DR5与TRAIL特异性结合后,可通过胞浆内的 DD激发并传递凋亡信号。
本实验采用原代培养的胶质母细胞瘤细胞株GC321、GC417、GC125,这三株细胞对TRAIL的反应性不同,GC321敏感,GC417不敏感,而GC125介于前两者之间。Western印迹显示,在三株原代培养的恶性胶质瘤细胞株中,DR5表达略有不同,GC321表达量明显高于其他两株细胞,GC125和GC417表达则明显减少;DR4的表达差别不明显。这说明可能DR5表达与原代培养的恶性胶质瘤细胞对TRAIL的敏感性相关,但是否还有TRAIL传导通路中其他因素影响细胞发生凋亡,还需要深入研究。
1 Bellail AC,Qi L,Mu lligan P,et al.TRAIL agonists on clinical trials for cancer therapy:the promises and the challenges〔J〕.Rev Recent Clin Trials,2009;4(1):34-41.
2 齐 玲,金 宏,丁丽娟,等.脑肿瘤干细胞的培养及生物学特性研究〔J〕.中国实验诊断学,2011;15(2):227-8.
3 齐 玲,于洪泉,丁丽娟,等.Caspase-8在胶质母细胞瘤抵抗TRAIL诱导凋亡中的作用〔J〕.吉林大学学报(医学版),2011;37(4):612-6.
4 Sathornsumetee S,Reardon DA,Desjardins A,et al.Molecularly targeted therapy for malignant glioma〔J〕.Cancer,2007;110(1):13-24.
5 Bellail A,Tse MC,Song JH,et al.DR5-mediated DISC controls caspase-8 cleavage and initiation of apoptosis in human glioblastomas〔J〕.J Cell Mol Med,2010;14(6A):1303-17.
6 Xiao C,Yang BF,Asadi N,et al.Tumor necrosis factor-related apoptosisinducing ligand-induced death-inducing signaling complex and its modulation by c-FLIP and PED/PEA-15 in glioma cells〔J〕.J Biol Chem,2002;277(28):25020-5.
7 Song JH,Bellail A,Tse MC,et al.Human astrocytes are resistant to Fas ligand and tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis〔J〕.J Neurosci,2006;26(12):3299-308.
8 Griffith TS,Anderson RD,Davidson BL,et al.Adenoviral-mediated transfer of the TNF-related apoptosis-inducing ligand/Apo-2 ligand gene induces tumor cell apoptosis〔J〕.J Immunol,2000;165(5):2886-94.
9 Almasan A,Ashkenazi A.Apo2L/TRAIL:apoptosis signaling,biology,and potential for cancer therapy〔J〕.Cytokine Growth Factor Rev,2003;14(3-4):337-48.

