肝癌组织中ZHX2基因启动子甲基化及其与临床病理特征的关系
田晓丰 赵红蕾 孙月芳 曹 宏 (吉林大学第二医院普外科中心,吉林 长春 3004)
ZHX2是ZHX(zinc-fingers and homeoboxes)蛋白家族成员之一,是2003年新克隆得到的转录抑制因子,位于染色体8q24.13,含有2个锌指结构和5个同源结构域,其编码的蛋白含837个氨基酸残基,定位于细胞核内〔1〕。近年来的研究结果显示,ZHX2参与正常肝细胞中肝癌标志物的转录抑制,提示ZHX2的表达缺失可能是肝细胞癌发生的关键因素之一。目前研究发现原发性肝细胞癌(HCC)细胞中存在异常甲基化的DNA,其中一个甲基化DNA片段为ZHX2。提示ZHX2基因启动子甲基化为其在HCC中呈低表达的主要原因之一,进一步表明ZHX2基因与HCC发生发展有密切关系〔2〕。启动子的高甲基化被认为是人类癌症的标志,同时也是导致基因失活的常见机制。然而受限于寡核苷酸杂交序列或者酶切位点等原因,许多方法比较费时费力,或提供的信息有限,不能够应用于大量序列或样本的检测。本研究通过亚硫酸氢钠变性高效液相色谱(DHPLC)技术检测HCC中ZHX2启动子区域甲基化情况,并分析其与HCC临床病理特征的关系,以探讨ZHX2基因在HCC的发生发展和侵袭转移中的作用。
1 材料与方法
1.1 病例选择 24例HCC及癌旁肝组织和6例胆管结石手术切除的正常肝组织均来自2009~2010年吉林大学第二医院手术标本。所有研究对象均有知情同意权。标本于手术摘除后5 min内采集,生理盐水冲洗后立即液氮保存,肿瘤标本均经病理组织学切片证实为HCC。
1.2 仪器和试剂 DHPLC仪为美国Transgenomic公司WAVE®,Transgenomic Inc.,Cambridge,MA;DHPLC 分离柱:DNASep@Cartridge DNA-99-3510;洗脱液A:0.1 moL/L TEAA,0.025%ACN;洗脱液 B:0.1 mol/L TEAA,25%CAN;Master cycler PCR仪(德国Eppendorf公司);dNTP(德国Qiagen公司),Taq酶(匹基生物工程有限公司)。低融点琼脂糖凝胶为Invitrogen Inc.,Carlsbad,CA产品;QIA quick胶提取试剂盒为Qiagen,Valencia,CA 产品;EA DNA Methylation-gold Kit为 Zemo Research公司试剂盒;体外甲基化的DNA(Chemicon International,Temecula,CA)作为甲基化的阳性对照,人类胎盘DNA(Sigma,St.Louis,MO)作为甲基化的阴性对照。亚硫酸氢盐修饰前配制甲基化/未甲基化的DNA溶液。
1.3 基因启动子区域甲基化分析
1.3.1 引物设计 预测ZHX2启动子区CG二核苷酸富集区,并根据其序列设计引物,上游引物:5'-TTTTAAAATCGTTATTATTATTTT-3',下游引物 5'-ATTTTCTTTATGAAAAGTTCAA-3',扩增片段长度240 bp。
1.3.2 亚硫酸盐处理及启动子区域目的片段扩增 按照EA DNA Methylation-gold Kit说明书,对基因组DNA,进行亚硫酸氢钠处理,将非甲基化胞嘧啶转化为尿嘧啶。PCR反应体系为50 μl,包括模板 DNA 5 μl、dNTP 4 μl、10 × PCR 缓冲液5 μl、10 μmol/L的上 下 游 引 物 各 1 μl、HotStar Taq DNA 聚 合 酶0.25 μl、ddH2O 34.75 μl。反应条件为:95℃预变性 5 min;94℃30 s,54℃ 30 s,72℃ 20 s,35 个循环;72℃ 10 min;4℃保存。
1.3.3 DHPLC 对PCR产物直接进行DHPLC分析。DHPLC使用自动化DHPLC仪器,用Transgenomic DNASep®色谱柱进行。样品用2%的洗脱液B线性梯度洗脱,buffer B起始浓度为40%,以0.9 ml/min的流速检测12 min,紫外检测器在260 nm处进行检测。每个样品的部分变性温度根据实验的不同使用WAVE Navigator软件确定。根据样品中靶序列的保留时间确定甲基化状态。
1.3.4 亚硫酸氢盐处理后测序 用2%的低融点琼脂糖凝胶对PCR产物进行电泳,切胶回收用QIA quick胶提取试剂盒纯化。使用BigDye Terminator v3.1循环测序试剂盒(Applied Biosystems,Foster City,CA)测序,按说明书步骤操作。测序产物使用 DyeEx spin columns(Qiagen,Valencia,CA)纯化。DNA 沉淀使用 10 μl HiDi甲酰胺(Applied Biosystems,UK)重悬,转移至96孔光学反应板内并用隔板封闭(所有部件来自Applied Biosystems,Foster City,CA)。序列使用 ABI PRISM 3100自动 DNA序列检测系统(Perkin-Elmer,Foster City,CA)分析。
1.4 统计学分析 采用统计学软件SPSS10.0对两样本率的比较使用χ2检验。
2 结果
2.1 DHPLC检测ZHX2启动子甲基化方法的建立 启动子通用PCR产物,在50℃非变性条件下进行双链DNA片段长度测定,发现它们的保留时间完全相同。在55℃条件下按检测突变方式进行测定,发现甲基化PCR产物保留时间为5.6 min,而非甲基化PCR产物保留时间为5.4 min。将两种PCR产物混合后,则能够在5.4 min和5.6 min各检测到一个相互独立的色谱峰。表明所建立的方法正确,可以用于下一步HCC样本的检测。见图1。
2.2 DHPLC检测样品ZHX2启动子区甲基化水平 胆管结石手术切除患者的正常肝组织中均可见保留时间为5.4 min的非甲基化色谱峰(图2),未检测到ZHX2基因启动子区域甲基化。对24例不同等级的肝癌组织的检测发现,有11例可在5.6 min处检测到甲基化峰(图2),甲基化阳性率为45.8%。另外,在24例癌旁肝组织检测到3例甲基化,甲基化阳性率为16.6%,明显低于癌组织。
2.3 ZHX2启动子甲基化与HCC临床病理特征的关系
ZHX2启动子甲基化发生情况与患者年龄、性别、肿瘤直径、肿瘤分化程度无显著相关性,但与血清AFP值及是否转移有关。见表1。

图1 ZHX2启动子区甲基化和非甲基化PCR产物色谱图

图2 部分组织标本ZHX2启动子区甲基化DHPLC测定色谱图
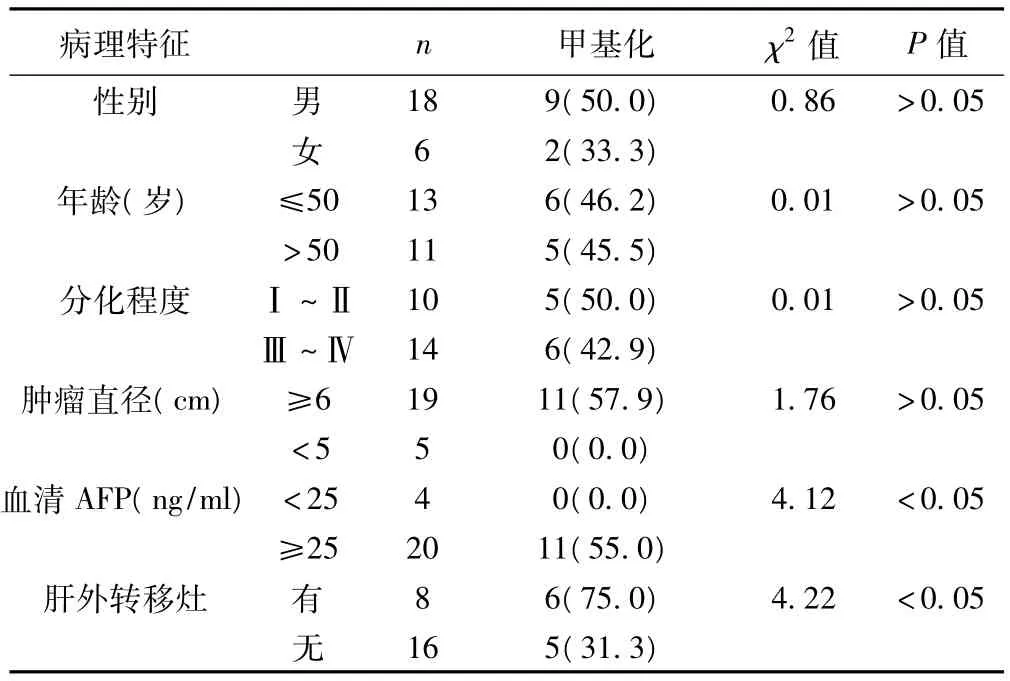
表1 ZHX2启动子甲基化与HCC临床病理特征的关系〔n(%)〕
3 讨论
启动子的高甲基化被认为是人类癌症的标志,同时也是导致基因失活的常见机制。越来越多学者认为HCC是基因病,必须从探明HCC发病的分子机制入手才能从根本上控制HCC的发生和发展〔3〕。随着分子生物学的发展,对HCC发病机制的认识有了飞跃。目前普遍认为HCC的发生和发展是一个多步骤逐渐演变的复杂过程,涉及多组基因结构和表达水平的变化,包括原癌基因的激活和肿瘤抑制基因的失活等改变〔4〕。DNA甲基化是一种影响基因表达的机制,只引起基因表达异常,并不改变DNA本身的序列和基因产物,所以这种改变是可逆的。因此,运用甲基化抑制剂使甲基化的肿瘤抑制基因去甲基化,重新发挥抑制肿瘤的功能,就有可能成为一种新的肿瘤治疗途径〔5〕。
本研究利用DHPLC方法,针对ZHX2基因启动子重要区域,建立了甲基化定量分析标准体系,并初步应用于HCC组织样本的检测中。DHPLC是一种高通量、自动化的基因突变检测技术,该技术已在医学、癌症、药物等研究领域开展应用,与SSCP和DNA直接测序等突变检测技术相比,DHPLC具有灵敏性更高,特异性更强,廉价省时等优点。DHPLC用来检测DNA突变和单核酸多态性,可以取代传统分子生物学技术,不需要制备凝胶,检测DNA片段做到了全自动、高效、快速、准确,在疾病相关基因突变检测方面提供了有效的技术手段,是一种快速有效的基因突变筛查方法。已有研究表明,ZHX2对多种HCC相关基因有调控作用,强烈提示其在HCC发生中的作用。尽管ZHX2调控的基因都具有HCC特异性表达特点,然而其自身表达广泛,且在多种哺乳动物中十分保守〔6〕。2006年Lv等报道,在HCC中发现了ZHX2启动子区的高度甲基化和甲基化介导的ZHX2基因表达缺失〔7〕。另有研究显示ZHX2表达与多发性骨髓瘤恶性程度及病人预后呈负相关〔8〕。ZHX2的这种表达特点和在肿瘤中的甲基化修饰提示ZHX2具有抑癌基因特性,然而其在HCC发生中的作用尚未见报道。本研究采用DHPLC发现在正常肝组织未检测到ZHX2基因启动子区域甲基化,而24例HCC癌组织中有11例(45.8%)存在甲基化,提示该甲基化是肿瘤相关性的。另外,有16.6%癌旁肝组织也能检测到甲基化,但明显低于癌组织,有可能是由于癌旁肝组织存在不同程度的肝硬化或慢性炎症,而并非完全正常肝组织,但也说明该甲基化有可能在HCC发生的早期或者癌前病变时就已经出现。2006年吕自力等〔9〕使用甲基化特异的PCR方法,对6例正常肝组织和32例HCC癌组织及其癌旁肝组织中ZHX2基因启动子甲基化的情况进行了检测,所得甲基化的数据与本研究相似,其结论为HCC中ZHX2基因启动子甲基化与患者血清AFP值及是否伴随转移有关,而与肿瘤直径及分化程度无关,与本研究相同。同时,基于ZHX2基因启动子甲基化发生率在有转移组的HCC癌组织中高于无转移组,吕自力等推测可能是ZHX2基因通过与NF-YA结合后影响MMPs及TIMPs等与HCC转移相关基因的表达〔9~11〕,参与或调节HCC的转移,提示ZHX2甲基化的检测为判断HCC预后提供参考。
1 Kawata H,Yamada K,Shou Z,et al.fingers and homeoboxes(ZHX)2,a novel member of the ZHX family,functions as a transcriptional repressor〔J〕.Biochem J,2003;373(Pt 3):747-57.
2 Yamada K,Ogata-Kawata H,Matsuura K,et al.ZHX2 and ZHX3 repress cancer markers in normal hepatocytes〔J〕.Front Biosci,2009;14(1):3724-32.
3 Wagner AO,Malin C,Nlmer P.Application of denaturing high performance liquid chromatography in microbial ecology:fermentor sludge,compost and soil community profiling〔J〕.Appl Environ Microbiol,2009;75:956-64.
4 Morford LA,Davis C,Jin L,et al.The oncofetal gene glypican 3 is regulated in the postnatal liver by zinc fingers and homeoboxes 2 and in the regenerating liver by alpha-fetoprotein regulator 2〔J〕.Hepatology,2007;46(5):1541-7.
5 陈伟露,吕自力.ZHX2的研究进展〔J〕.国际病理科学与临床杂志,2010;30(4):342-5.
6 Wu C,Qiu R,Wang J,et al.ZHX2 interacts with ephrin-B and regulates neural progenitor maintenance in the developing cerebral cortex〔J〕.J Neurosci,2009;29(23):7404-12.
7 Lv Z,Zhang M,Bi J,et al.Promoter hypermethylation of a novel gene,ZHX2,in hepatocellular carcinoma〔J〕.Am J Clin Pathol,2006;125(5):740-6.
8 Armellini A,Sarasquete ME,Garcia-Sanz R,et al.Low expression of ZHX2,but not RCBTB2 or RAN,is associated with poor outcome in multiple myeloma〔J〕.Br J Haematol,2008;141(2):212-5.
9 吕自力.ZHX2基因启动子甲基化在肝细胞癌中的研究〔D〕.广州:中山大学博士论文,2006.
10 Zhong ZD,Hammani K,Bae WS,et al.NF-Y and Sp1 cooperate for the transcriptional activation and cAMP response of human tissue inhibitor of metalloproteinases-2〔J〕.J Biol Chem,2000;275(24):18602-10.
11 Cappabianca L,Farina AR,Tacconelli A,et al.Reconstitution of TIMP-2 expression in SH-SY5Y neuroblastoma cells by 5-azacytidine is mediated transcriptionally by NF-Y through an inverted CCAAT site〔J〕.Exp Cell Res,2003;286(2):209-18.

