SAPK/JNK信号通路在脑梗死后神经元凋亡中的作用*
李 欣, 魏红艳, 胡春林, 荆小莉, 熊 艳, 詹 红, 廖晓星
(中山大学附属第一医院急诊科,广东 广州 510080)
中风依然是目前迫切需要解决的医疗问题之一,除了急性缺血缺氧导致的脑细胞坏死外,慢性期的细胞凋亡也是导致脑功能受损的重要原因。缺血再灌注损伤、过度的炎症反应、兴奋性氨基酸毒性等因素都可以引发并加重这一病理生理过程。应激活化的蛋白激酶/c-Jun氨基端激酶(stress-activated protein kinase/c-Jun amino- terminal kinase,SAPK/JNK)信号通路是各种应激刺激(包括紫外线、辐射、神经酰胺、炎症因子等)影响机体的最强力信号途径之一[1,2]。JNK的活化介导参与了各种损伤引致的细胞凋亡过程,但JNK信号通路的调控机制尚未研究清楚,其与MAPK信号通路中其它通路的联系、自身亚型间相互作用的具体机制、通路中参与信号转导的支架蛋白的作用亦都需要进一步深入研究。bcl-2基因家族是目前较为公认与凋亡密切相关的基因,bcl-2是最主要的细胞凋亡抑制基因,bax是最主要的细胞凋亡促进基因,两者表达产物的比值(Bcl-2/Bax)影响细胞凋亡的发生[3]。本研究拟观察脑梗死后SAPK/JNK及Bcl-2/Bax信号途径中关键蛋白质的变化,以探寻各种病理因素引发神经元凋亡的分子机制,为将来的干预治疗寻找良好的作用靶点。
材料和方法
1 动物与方法
1.1 动物 动物实验遵照1996版《美国实验动物使用指引》(NIH Publications No.80-23)的要求进行,并获得中山大学动物伦理委员会的批准。所有实验遵循随机和双盲的原则。
1.2 光化学法大脑皮层局灶缺血梗死模型(photothrombotic cortical injury,PCI) 光化学法大脑皮层局灶缺血实验大鼠模型根据Watson等[4]的方法制作,局部细节稍有改动。选择体重约250 g的雄性SD大鼠,腹腔内注射氯胺酮(ketamine,80 mg/kg)和甲苯噻嗪(xylazine,8 mg/kg)进行麻醉。生理盐水稀释的玫瑰红(40 mg/kg BW)通过股静脉注入体内。在脑立体定位仪上固定动物,切开头皮暴露颅骨表面。把一根直径10 mm的光导纤维棒定位连接在颅骨前囟点后3 mm和中线向右旁开3 mm的交界点。光导纤维棒的另一端连接冷白光源(Volpi Intralux 6000,150 W;Volpi AG),用最大输出功率照射8 min。实验过程中,用体温控制板(CMA 150;Carnegie Medicine)监测并控制肛温在37℃。大鼠清醒后送入动物中心饲养,自由饮食。在本研究中提到的假手术组大鼠,除不注射玫瑰红外,其所有操作同上。脑梗死组和假手术组大鼠总数各为18只,6只用于PCI后24 h的组织染色检查,6只用于PCI后7 d的电镜检查,6只用于PCI后7 d的Western blotting分析。通过使用旋转实验(IITC Life Science)对动物的肢体功能做测试和评价,具体做法参照文献方法进行[5]。在入选实验前,所有动物利用从 5-15 r/min逐渐加速的平衡杆对动物训练4 d,只有那些能在转速15 r/min情况下站立满200 s的动物入选实验。PCI后的1 d、7 d,再次对动物进行功能测试,在平衡杆转速为15 r/min的情况下,每只动物测试5次,记录每次能站立在平衡木的时间,如达到200 s则实验终止,计算每只动物的平均停留时间。动物停留时间越短,则表面其运动功能越差。
1.3 脑组织 2,3,5 - 氯化三苯基四氮唑(2,3,5 -triphenyltetrazolium chloride,TTC)染色 为鉴定制作局灶性脑梗死的有效性,对假手术组和脑梗死组大鼠在PCI后24 h的脑组织进行染色显示。动物麻醉后断头取脑,放入-30℃冷冻10 min,自嗅球后2 mm做脑冠状切片,放入1%TTC(Genetime)生理盐水溶液中,37℃的恒温箱中孵育30 min,正常脑组织染成红色,缺血坏死的脑组织因线粒体被破坏不染色而成白色,取出脑片放至10%甲醛溶液中固定。
1.4 电镜检查 动物麻醉后断头取脑,0℃环境下迅速剥取梗死灶侧完整大脑皮层,在梗死灶周边位置切取0.5 cm×0.5 cm×0.5 cm的组织块,固定于4%多聚甲醛4 h,4℃。用0.1 mol/L PBS液进行漂洗,2%锇酸后固定2 h,乙醇丙酮梯度脱水后用812包埋剂包埋。超薄切片,常规铅铀染色,在日立HE-800透射电镜下观察。
1.5 Western blotting分析 快速断颈处死动物、剥取梗死灶同侧新鲜大脑皮层,在梗死灶周边位置切取0.5 cm×0.5 cm×0.5 cm的组织块,液氮冻存。收齐标本后,加入添加了10% 蛋白酶抑制剂和1%磷酸酶抑制剂的裂解液(10mmol/L Tris pH7.4,150 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L EGTA),冰浴下匀浆,将匀浆液入Eppendorf 5415D低温离心机中4℃、26000×g离心30 min。取上清,用Bio-Rad DC蛋白质定量测定试剂盒(Bio-Rad)在分光光度计上进行蛋白质定量测定。SDS PAGE采用4%积层胶,10% -12.5%分离胶,上样量为40 μg,电压12 V/cm,结束后取出凝胶电转移至同等大小的硝酸纤维素膜上。转移后的硝酸纤维素膜置于封闭液(TBST+2%BSA+5%脱脂奶粉)封闭1 h。加入单克隆抗体(p-JNK1、p-JNK2、p-c-Jun、p-ATF-2、total JNK1、total JNK2、Bcl-2 和 Bax),4℃过夜。TBST漂洗5 min×3次;带有辣根过氧化物酶(HRP)的相应 II抗(1∶500),室温处理1 h,TBST漂洗5 min×3次;增强化学发光法(enhanced chemiluminecence,Amersham)显示阳性反应的蛋白质。每条带的光亮度测定使用ImageJ分析。每个条带的蛋白负荷量用多克隆山羊β-actin(1∶2000,C-11,Santa Cruz)检测控制。
2 统计学处理
结 果
1 PCI造模后24 h梗死灶大小及动物的行为学改变
假手术组的血脑屏障完整;脑梗死组均见光照区淡玫瑰红色染料渗出,提示假手术组无血脑屏障破坏,而脑梗死组明显破坏。假手术组大鼠TTC染色后未见梗死灶。脑梗死组大鼠TTC染色后右顶叶照射区呈白色梗死灶,冠状面梗死灶呈“碗形”,尖端指向侧脑室,深达皮质全层。梗死灶部位恒定,梗死灶大小基本一致,见图1。实验前,训练后的大鼠在平衡木上停留的时间都达到200 s。在PCI后1 d,PCI组动物在平衡木上的停留时间显著下降[(14.67±2.08)s vs(200±0)s,P <0.01];7 d后该时间是(25.33±11.02)s,较实验前仍有显著下降(P<0.01)。

Figure 1.The morphology and characteristics of the rat brain after stroke induced by photothrombotic cortical injury(PCI).A:control;B:stroke.The arrow indicates infarction area.图1 光化学法诱导大鼠脑梗死后脑形态学及其特征鉴定
2 透射电镜下观察脑梗死后神经元的损伤
PCI后7 d,在透射电镜下观察梗死灶侧大脑皮层的形态学变化。与假手术组比较,脑梗死组可见到明显的神经元细胞凋亡现象,存在广泛的胞浆浓缩、核固缩畸形、染色质边际化、染色加深;细胞器方面,可见广泛的线粒体肿胀、空泡样变、嵴断裂或消失,内质网扩张,见图2。
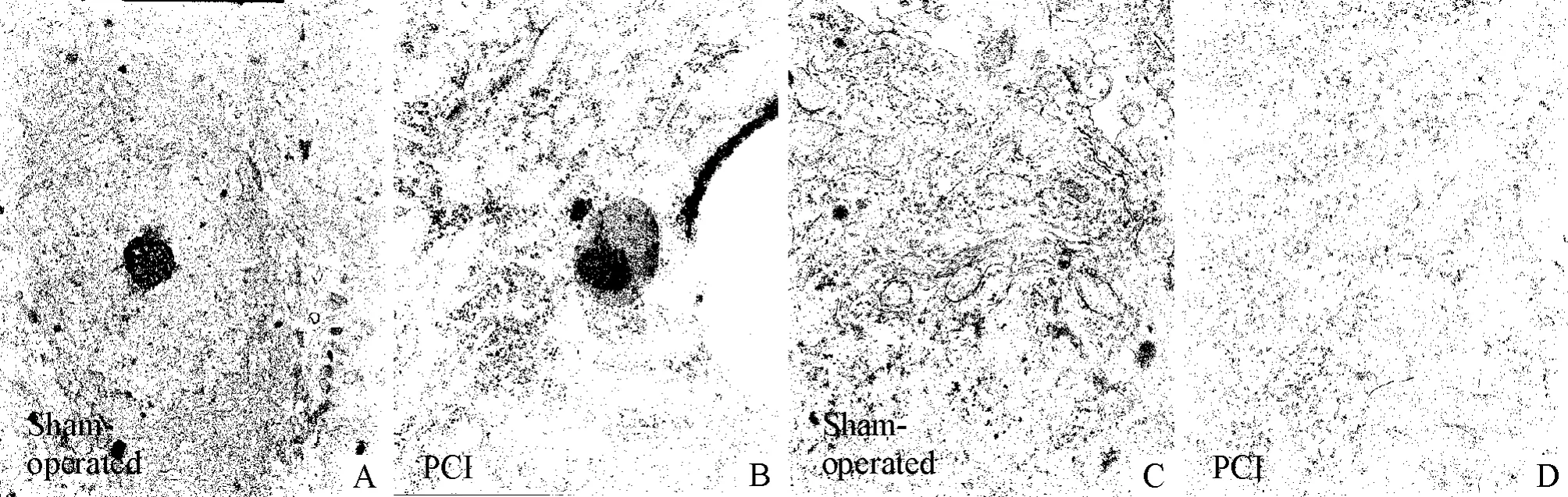
Figure 2. The neurons in the ipsilesional cortex under transmission electron microscope after stroke injury.A:normal neurons(×3900);B:apoptosis of neurons(×15500);C:normal organelles(×11500);D:swollen mitochondria,vacuolar degeneration and wide endoplasmic reticulum(×11500).图2 电镜观察脑梗死后神经元的损伤
3 脑梗死对SAPK/JNK信号通路的活化作用
在脑梗死组,SAPK/JNK信号途径中诸多因子被显著活化,p-JNK1、p-JNK2以及其下游的p-c-Jun、p-ATF-2的水平较假手术组显著升高(P<0.05),而total JNK1、total JNK2水平在各组间无显著差异(P>0.05)。这些结果表明脑梗死对SAPK/JNK途径有显著的活化作用,见图3、表1。

Figure 3.The SAPK/JNK and Bcl-2/Bax signaling pathways after stroke injury(Western blotting).The levels of p-JNK1,p-JNK2,p-c-Jun and p-ATF-2 were increased in PCI group compared with those in sham-operated group(P<0.05).The level of Bax was increased after stroke injury,but the Bcl-2 level was not changed.图3 脑梗死抑制SAPK/JNK和Bcl-2/Bax信号通路
表1 SAPK/JNK通路关键蛋白和Bcl-2、Bax相对吸光度值比较Table 1.The density of the Bcl-2,Bax and key proteins of SAPK/JNK signal pathway(.n=6)

表1 SAPK/JNK通路关键蛋白和Bcl-2、Bax相对吸光度值比较Table 1.The density of the Bcl-2,Bax and key proteins of SAPK/JNK signal pathway(.n=6)
▲P<0.05 vs sham-operated group.
Group p-ATF-2 p-c-Jun p-JNK 1 p-JNK 2 Total-JNK 1 Total-JNK 2 Bcl 2 Bax Sham -operated 1.00 ±0.15 1.00 ±0.04 1.00 ±0.23 1.00 ±0.33 1.00 ±0.08 1.00 ±0.07 1.00 ±0.42 1.00 ±0.04 PCI 2.00 ±0.31▲ 1.17 ±0.08▲ 1.77 ±0.15▲ 2.29 ±0.25▲ 0.99 ±0.05 0.92 ±0.04 1.39 ±0.26 1.31 ±0.10▲
4 脑梗死对凋亡相关蛋白Bcl-2和Bax的影响
与假手术组比较,脑梗死组Bcl-2水平变化不显著,Bax水平明显升高(P<0.05),见图3、表1。
讨 论
光化学法制作脑梗死模型由 Watson等[4]于1985年首次报道后,近年来被广泛应用于脑梗死的研究,具有可预知梗死的部位和范围、死亡率低、重复性好等优点。本实验中,使用PCI法成功制成大脑皮层局灶缺血梗死模型,并伴有血脑屏障的破坏。每个梗死灶的大小基本一致,这为随后对药物治疗效果的比较提供了前提。在假手术组未见梗死灶,说明单纯光照不会引起脑组织梗死,且不会导致烧伤等并发症。
迟发性神经元死亡与脑缺血、脑退行性病变等的关系密切。急性脑缺血缺氧性损伤后继发引起的细胞凋亡是迟发性神经元死亡的主要方式,是脑梗死后亚急性期和慢性期病变进一步加重的重要原因之一[6,7]。本研究中,脑梗死组 PCI后7 d在海马部位仍可见到较为广泛的神经元凋亡现象,存在明显的胞浆浓缩、核畸形、染色质边际化;在细胞器方面,可见广泛的线粒体肿胀、空泡样变、嵴消失、内质网增宽。而在假手术组,未见到凋亡细胞,细胞核无水肿和畸形、核仁完整存在;细胞器方面,未见线粒体肿胀及内质网增宽、核糖体与高尔基体完整存在。
蛋白激酶介导的信号转导通路是细胞对周围环境变化的主要反应之一。近年研究神经元凋亡的热点之一是探讨多种丝裂素活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路的作用。MAPK是一丝/苏氨酸蛋白激酶家族,由ERK、JNK和p38组成,每一成员都各自形成独立的信号通路及网络,介导胞外信号引起核反应信息传递的汇聚功能。JNK最初被命名为54 kD的SAPK,可被许多应激诱导刺激(如脂多糖、TNF、IL-1、渗透压应激和紫外线)所活化,JNK通路的激活与细胞凋亡关系密切。JNK激活通过对转录因子 c-Jun/AP-1、ATF-2、Elk-1等磷酸化促进基因的表达及新蛋白质的合成,新生蛋白质可能作用于细胞凋亡途径的某一环节而促进细胞凋亡[8]。在本研究中,脑梗死组p-JNK1、p-JNK2以及其下游的 p-c-Jun、p-ATF-2在脑梗死组较假手术组显著升高,表明SAPK/JNK信号通路被缺血损伤激活而进一步导致组织和细胞的病变,其必然会导致更严重的炎症损伤、细胞器的破坏和更多的细胞凋亡等。
对哺乳动物细胞凋亡的基因调控过程目前还不十分清楚,研究表明与细胞增殖有关的原癌基因和抑癌基因几乎都参于对细胞凋亡的调控,其中研究较多的有 bcl- 2、c- myc、p53、Ice、Fas/APO -1 等。bcl-2家族即细胞凋亡抑制基因,包括bcl-2、bax、bad、bcl-x等。bax基因是bcl-2基因家族的一员,其产物是一种与Bcl-2同源的相关蛋白,主要作用是加速细胞凋亡,并与Bcl-2一起调节细胞凋亡。Bcl-2家族的成员通常以二聚体的形式发挥作用,Bcl-2/Bcl-2、Bcl-2/Bax和 Bcl-2/Bcl-XL 抑制细胞凋亡;Bax/Bax、Bax/Bad和 Bcl-2/Bax-XL促进细胞凋亡。Bax过表达能对抗Bcl-2抑制细胞凋亡的活性,在促凋亡因素刺激下,Bcl-2/Bax比值将决定细胞的存活[3,9,10]。在本研究中,脑梗死组 Bcl-2水平变化不大,而Bax水平显著升高,提示Bcl-2/Bax的比值降低,加速细胞的凋亡。
总之,脑梗死发生后在较长的一段时间内都存在着以神经元凋亡为表现形式的迟发性神经细胞死亡,而这一过程可能与缺血缺氧性损伤激活了SAPK/JNK信号通路及调节凋亡相关蛋白(如Bcl-2/Bax)等机制有关。对这一病理机制的揭示,可以为治疗脑损伤提供理论依据和干预靶点。
[1]Ferrer I,Friguls B,Dalfó E,et al.Early modifications in the expression of mitogen-activated protein kinase(MAPK/ERK),stress-activated kinases SAPK/JNK and p38,and their phosphorylated substrates following focal cerebral ischemia[J].Acta Neuropathol,2003,105(5):425-437.
[2]郑关毅,陈晓春,杜 建,等.没食子酸丙脂对脑缺血大鼠神经元SAPK/JNK及p38 MAPK激活的抑制作用[J].药学学报,2006,41(6):548-554 .
[3]Li DQ,Bao YM,Li Y,et al.Catalpol modulates the expressions of Bcl-2 and Bax and attenuates apoptosis in gerbils after ischemic injury[J].Brain Res,2006,1115(1):179-185.
[4]Watson BD,Dietrich WD,Busto R,et al.Induction of reproducible brain infarction by photochemically initiated thrombosis[J].Ann Neurol,1985,17(5):497 -504.
[5]Baker AH,Sica V,Work LM,et al.Brain protection using autologous bone marrow cell,metalloproteinase inhibitors,and metabolic treatment in cerebral ischemia[J].Proc Natl Acad Sci USA,2007,104(9):3597 -3602.
[6]Culmsee C,Plesnila N.Targeting Bid to prevent programmed cell death in neurons[J].Biochem Soc Trans,2006,34(Pt 6):1334-1340.
[7]Plesnila N,Zhu C,Culmsee C.Nuclear translocation of apoptosis-inducing factor after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2004,24(4):458 -466.
[8]Humar M,Loop T,Schmidt R,et al.The mitogen-activated protein kinase p38 regulates activator protein 1 by direct phosphorylation of c-Jun[J].Int J Biochem Cell Biol,2007,39(12):2278 -2288.
[9]符跃强,卢仲毅,方 芳,等.氧化应激诱导肺泡Ⅱ型上皮细胞凋亡及Bax和p53的表达变化[J].中国危重病急救医学,2008,20(2):76-79.
[10]倪世容,王万铁,王 鑫,等.人硫氧还蛋白对肺缺血再灌注损伤时细胞凋亡及Bcl-2/Bax的影响[J].中国病理生理杂志,2010,26(5):871-875.

