αvβ6-ERK直接通路参与去甲斑蝥素诱导HT-29结肠癌细胞凋亡*
张 琦, 胡燕燕, 彭 程, 牛卫博, 刘恩宇, 贺兆斌, 赵传宗, 牛 军
(1山东大学第二医院血液肿瘤科,山东 济南 250033;山东大学齐鲁医院2干部保健科,3肝胆外科,山东 济南 250012)
整合素是细胞表面黏附分子家族成员,由α和β 2种亚基通过非共价键连接而成,是一类阳离子依赖的跨膜糖蛋白受体,其中αvβ6又是一种特殊的上皮细胞限制性整合素亚型。整合素αvβ6的主要配体是纤维连接蛋白,在正常健康成人上皮组织中无法测到β6 mRNA和蛋白的表达[1];但是却出现在胚胎形成、损伤修复和一系列上皮源性肿瘤之中[2]。
结肠癌是国内临床最常见的一类消化道恶性肿瘤,其发病率呈现逐年升高的趋势[3,4]。外科手术是治疗结肠癌最有效的手段,但是术后肿瘤的局部复发和远处转移仍是影响其预后的关键性因素[5]。因此,术后早期进行化疗是目前改善结肠癌预后的较好选择。FOLFOX4作为治疗晚期转移性结肠癌的一线化疗方案[6],国内多家医院通过多中心双盲临床观察证实,将去甲斑蝥素和FOLFOX4化疗方案联合应用治疗晚期结肠癌较单独应用FOLFOX4方案不但近期疗效好、不良反应轻,而且中位生存时间明显延长,生活质量显著提高[7,8]。去甲斑蝥素(norcantharidin,NCTD)是由呋喃和马来酸酐进行 Diels-Alder加成反应并催化加氢后获得的新型人工合成化合物。长期以来关于去甲斑蝥素如何发挥抗癌作用有各种解释,但尚无明确结论。
我们的前期研究证实,αvβ6的表达与肿瘤的恶性生物学行为密切相关,参与调控其中的众多环节。本研究旨在这些基础上探索NCTD的抗癌机制。
材料和方法
1 细胞株和试剂
人结肠癌HT-29细胞株购自美国标准菌种收藏所(American Type Culture Collection,ATCC);鼠抗人αvβ6整合素胞外区单抗 R6G9(IgG2a)、鼠抗人αvβ6整合素功能性单抗10D5(IgG2a)、鼠抗人αvβ5整合素功能性单抗P1F6(IgG1)及鼠抗人αvβ3整合素功能性单抗LM609(IgG1)均购自Chemicon;标准IgG2a和IgG1抗体购自Dako;抗ERK(extracellular signal-related kinase,ERK)、抗 p-ERK(phosphorylated ERK)、抗 JNK(c-Jun N -terminal kinase,JNK)、抗p-JNK(phosphorylated JNK)、抗p38以及p-p38(phosphorylated p38)抗体均购自Santa Cruz;Hoechst 33258细胞凋亡试剂盒购自中国凯基生物技术公司;明胶琼脂糖珠4B购自Amersham Pharmacia;NCTD(分析纯)购自北京第四制药厂。
2 方法
2.1 Hoechst 33258染色 分别吸取经60 μmol/L NCTD处理12 h的HT-29细胞悬液和对照组(未处理)细胞悬液,滴于载玻片上,醋酸-乙醇固定。冰磷酸缓冲液冲洗2遍,每次5 min;4℃下,4%甲醛固定10-15 min;冰磷酸缓冲液冲洗2遍,每次5 min;加入Hoechst 33258荧光染料,室温下避光染色15 min;冰磷酸缓冲液冲洗3遍,每次5 min;避光晾干,水溶性封片剂封片,在荧光显微镜(Olympus)下观察细胞凋亡情况。
2.2 流式细胞术检测细胞表面蛋白质的表达 用胰酶收集单层培养的细胞,羊血清4℃封闭10 min。PBS 漂洗1 次,αvβ6、αvβ5 和 αvβ3 单抗 R6G9、PIF6和LM6094℃孵化20 min,再用PBS漂洗2次,用标记了藻红蛋白的Ⅱ抗羊抗鼠IgG(60 mg/L)4℃染色20 min,接着用PBS漂洗2次,取0.5 mL PBS重悬液进行流式细胞术分析。测定各细胞表面整合素αvβ6、αvβ3 和 αvβ5 的表达情况。
2.3 Western blotting检查蛋白质表达 分别收集对照组及处理组细胞,将其裂解于200 μL含有蛋白酶抑制剂(100 mg/L PMSF,2 mg/L Aprotitin)的裂解液中[1%Triton X -100,50 mmol/L Tris-HCl(pH 7.4),150 mmol/L NaCl,10 mmol/L EDTA,100 mmol/L NaF,1 mmol/L Na3VO4],4 ℃ 裂解 40 min,15000 r/min离心20 min,取上清,Bradford法进行蛋白定量。与3×样品缓冲液混合,煮沸5 min。将样品在10%的SDS-聚丙烯凝胶中进行电泳3 h,然后转印至硝酸纤维素膜上。5%脱脂牛奶封闭1 h后,分别加入Ⅰ抗,4℃过夜。TTBS洗4次后加入辣根过氧化物酶标记的Ⅱ抗室温下作用30 min,ECL法显色。
2.4 免疫共沉淀 4℃下,等量的NCTD处理组细胞和对照组细胞裂解液用αvβ6单克隆抗体R6G9孵育过夜;细胞裂解液高速离心(10000×g,10 min);裂解液用兔抗鼠免疫球蛋白偶联的4B-琼脂糖小球处理2 h,间接将免疫沉淀析出;免疫沉淀蛋白用RIPA缓冲液洗涤3次;免疫沉淀蛋白在非衰减条件下用7.5%SDS-PAGE分析。
3 统计学处理
百分率比较用χ2检验,计量资料以均数±标准差()表示,两样本均数比较采用成组设计的t检验,成组设计的多样本均数比较采用单因素方差分析,用SPSS 16.0软件进行统计分析。
结 果
1 NCTD诱导人结肠癌HT-29细胞凋亡
取预先用60 μmol/L NCTD处理的HT-29细胞悬液和未经NCTD处理的细胞悬液,Hoechst 33258染色,荧光显微镜观察细胞凋亡情况。未处理组HT-29细胞,核染色均一、明亮,见图1A;而NCTD处理组,细胞凋亡明显增加,蓝色荧光显著增强,细胞核内有凝聚态染色质,部分细胞内凋亡小体出现,细胞呈现典型的凋亡态特征,见图1B。任意选取10个视野,每个视野计数200个细胞,未处理组细胞凋亡率为1.45% ±0.67%,而NCTD处理组细胞凋亡率为35.60% ±1.84%,两者对比有显著差异(P<0.01),见图1C。
2 NCTD抑制HT-29细胞表达整合素αvβ6
预先用 20 μmol/L、40 μmol/L 和 60 μmol/L NCTD处理细胞12 h(NCTD未处理组作为空白对照),然后用流式细胞仪检测整合素 αvβ6、αvβ5 和αvβ3的表达情况。结果显示,整合素αvβ6荧光密度值(intensity fluorescence,IF)随NCTD浓度增加而依次降低(113±3、85±2、54±2、29±1),差异显著(P<0.01)。随 NCTD 浓度增加,整合素 αvβ3和αvβ5 表达情况未见明显变化(P >0.05),见图2。
3 MTT检测整合素功能阻断抗体对HT-29细胞生长的影响
预先用针对整合素 αvβ3、αvβ5 和 αvβ6 的功能阻断抗体LM609(10 mg/L)、FIF6(10 mg/L)和10D5(10 mg/L)封闭细胞2 h,然后再经20 μmol/L NCTD处理12 h,标准单克隆抗体IgG2a和IgG1作为阴性对照。实验证实,只有αvβ6功能阻断抗体10D5能够明显抑制结肠癌 HT-29细胞生长(P<0.01);当NCTD与10D5联用时,此种抑制效应明显增强(P<0.01),而整合素 αvβ3 和 αvβ5 的单克隆抗体 LM609和FIF6则无明显抑制细胞生长的能力(P>0.05),见图3。
4 Western blotting检查去甲斑蝥素对人结肠癌HT-29细胞丝裂原活化蛋白激酶表达的影响
预先用 0 μmol/L、20 μmol/L、40 μmol/L 和 60 μmol/L NCTD处理细胞24 h、36 h和48 h,然后进行Western blotting分析。结果显示,经NCTD处理后,细胞内ERK、JNK、p-JNK、p38和p-p38水平无明显变化。只有p-ERK含量随NCTD浓度增加或作用时间延长而逐渐降低,见图4A,呈现出明显的时间-剂量相关性,见图4B、C。表明NCTD对ERK的磷酸化过程有明显的抑制作用(P<0.05)。
5 免疫共沉淀实验检测NCTD对HT-29细胞αvβ6-ERK直接连接的影响
HT-29细胞经40 μmol/L NCTD处理24 h后(未处理组设为阴性对照),用抗αvβ6单克隆抗体R6G9析出免疫沉淀蛋白,再用抗ERK单克隆抗体(6G11)及抗p-ERK单克隆抗体(12D4)结合免疫沉淀蛋白,见图5。上层凝胶电泳图显示,用抗ERK抗体或抗p-ERK抗体可从未处理组的免疫沉淀中析出ERK或p-ERK,表明未处理组中αvβ6-ERK直接连接完整;下层凝胶电泳图显示,用抗ERK抗体或抗p-ERK抗体无法从处理组的免疫沉淀中析出ERK或p-ERK,表明处理组中αvβ6和ERK之间没有连接,NCTD具有干扰整合素αvβ6-ERK直接连接形成的作用。
讨 论
既往研究发现,整合素αvβ6可通过细胞黏附分子介导信号转导调控基质金属蛋白酶(MMPs)的表达,在降解破坏基质和肿瘤侵袭转移中起重要作用。通过转基因诱导表达β6整合素,可使结肠癌细胞分泌 MMP -9增多,加速破坏细胞外基质[9]。αvβ6 可对丝裂原活化蛋白激酶(MAPKs)信号通路发挥直接调控作用,其中细胞外信号调节蛋白激酶(ERK)途径是整合素用于调控肿瘤细胞生长、侵袭和转移的主要通路。我们前期研究证实αvβ6的β链胞内功能段与ERK之间存在直接的生理性连接通路,阻断β6与ERK的结合位点则会抑制肿瘤生长。下调整合素β6亚基的表达可以抑制肿瘤细胞在体内的生长,并且抑制MAPK对血清刺激的反应活性。因此,αvβ6-ERK这一直接连接是细胞为了适应特定环境,专为高度恶性上皮肿瘤的发生发展、侵袭转移开通的一条直通信息高速公路[10]。
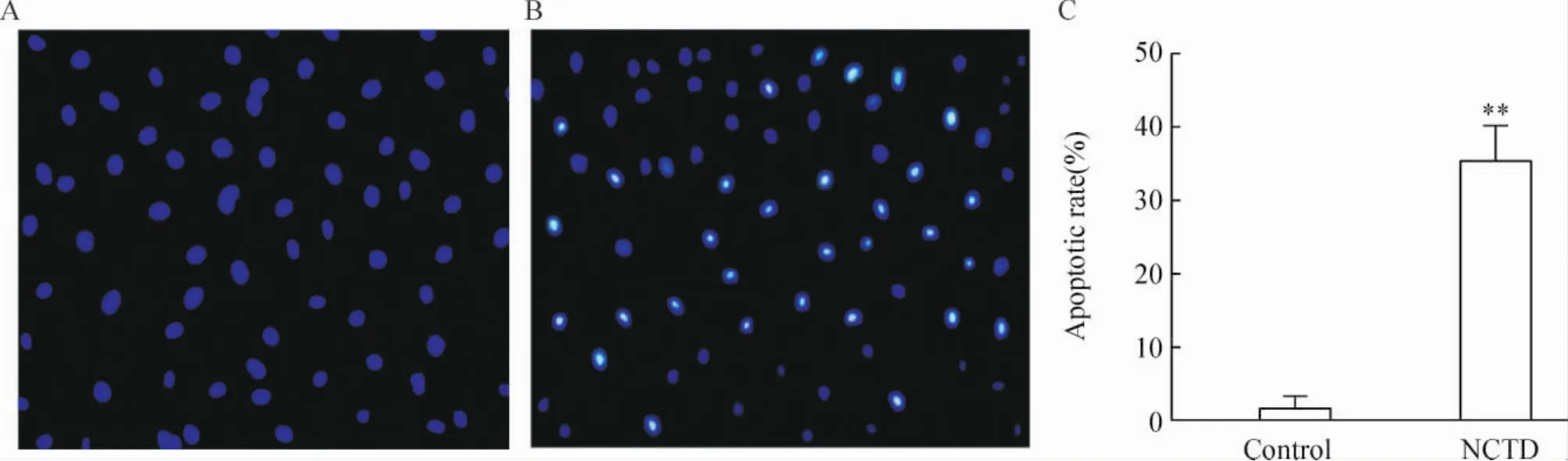
Figure 1.Apoptosis of HT -29 cells detected by Hoechst 33258 staining.A:control group,HT - 29 cells were not treated with NCTD;B:NCTD group,HT -29 cells were treated with 60 μmol/L NCTD for 12 h;C:comparison of the apoptotic rates between control group and NCTD group..n=3.**P<0.01 vs control group.图1 Hoechst 33258染色法检测细胞凋亡

Figure 2.The suppression of β6 -subunit expression in HT -29 cells treated with NCTD.A:flow cytometry assay showed the suppression of β6 - subunit expression with NCTD treatment in HT -29 cells.B:the expression of the integrin αvβ6 in the HT -29 cells treated by NCTD was reduced,but the expression of αvβ5 and αvβ3 was not changed..n=3.**P<0.01 vs 0 μmol/L.图2 NCTD抑制人结肠癌HT-29细胞表达整合素αvβ6

Figure 3.MTT methods were used to detect the effects of function - blocking antibodies against αvβ6,αvβ5 and αvβ3 on HT -29 cells treated with or without NCTD.10D5 alone could inhibit HT-29 cells growth..n=3.**P <0.01 vs other antibodies.This suppressing effects were strengthened when combining 10D5 with NCTD.△△P<0.01 vs other antibodies+NCTD.图3 MTT检测整合素功能阻断抗体单独及联合去甲斑蝥素对HT-29细胞生长的影响
本研究中,我们发现NCTD有明显的诱导HT-29结肠癌细胞凋亡的作用,这与国外学者利用NCTD处理SAS细胞(人口腔鳞癌)、A375-S2细胞(恶性黑素瘤)和HeLa细胞(人宫颈癌)取得的结论相一致[11-13]。流式细胞分析证实,NCTD 能够抑制HT-29细胞表达整合素αvβ6,而且随着作用时间及浓度增大抑制效应逐渐增强。MTT实验也证实只有针对整合素αvβ6的功能性单抗10D5能够增强NCTD产生的细胞生长抑制效应,而整合素αvβ3的功能性单抗(LM609)和αvβ5的功能性单抗(P1F6)则无此效应。Western blotting分析表明,用NCTD处理HT-29细胞后仅有p-ERK表达水平降低,而且其降低程度与NCTD处理时间和作用浓度显著相关。细胞内ERK、JNK、p-JNK、p38和 p-p38表达水平则不受NCTD处理影响。免疫共沉淀表明,NCTD确实能够干扰ανβ6-ERK直接连接的形成。

Figure 4.Western blotting was used to detect the expression and the phosphorylation of mitogen activated protein kinases(MAPKs)in HT-29 cells treated with NCTD.A:Western blotting for MAPKs and p-MAPKs after treatment with various doses of NCTD(0,20,40,60 μmol/L)for 24,36,and 48 h;B,C:the level of p -ERK was decreased substantially by NCTD in a dose-and time-dependent manner..n=3.图4 Western blotting检测NCTD对HT-29细胞内MAPKs表达量及磷酸化程度的影响

Figure 5.Co-immunoprecipitation assay was used to detect the effects of NCTD on αvβ6 - extracellular signal- regulated kinase(ERK)direct linkage in HT - 29 cells.Upper:HT -29 cells untreated without NCTD.Lower:HT - 29 cells treated with 40 μmol/L NCTD for 24 h.图5 免疫共沉淀实验检测NCTD对αvβ6-ERK直接连接的影响
综上所述,我们认为NCTD的核心药理学作用是通过降低HT-29细胞表达整合素αvβ6,阻碍ERK的磷酸化,干扰αvβ6-ERK直接连接形成,阻断了αvβ6介导的恶性生物学信号转导。NCTD通过αvβ6-ERK信号通路诱导HT-29人结肠癌细胞凋亡。
[1]Breuss JM,Gillett N,Lu L,et al.Restricted distribution of integrin beta 6 mRNA in primate epithelial tissue[J].Histochem Cytochem,1993,41(11):1521-1527.
[2]Agrez M,Chen A,Cone RI,et al.The alpha v beta 6 integrin promotes proliferation of colon carcinoma cells through a unique region of the beta 6 cytoplasmic domain[J].J Cell Biol,1994,127(3):547 -566.
[3]Jemal A,Siegel R,Ward E,et al.Cancer statistics 2006[J].CA Cancer J Clin,2006,56(2):106-130.
[4]高 明,龚 瑾,吕永添,等.β-连环素在结肠腺癌中的异常表达及其与预后的关系[J].中国病理生理杂志,2010,26(5):928 -930.
[5]Jemal A,Murray T,Ward E.Cancer statistics,2005[J].CA Cancer J Clin ,2005,55(1):10 -30.
[6]de Gramont A,Figer A,Seymour M,et al.Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer[J].J Clin Oncol,2000,18(16):2938-2947.
[7]Li HJ,Dong L,Fu SY.Comparative study on treatment of advanced colorectal cancer by Aidi injection combined with FOLFOX4 regimen and by FOLFOX4 regimen alone[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2007,27(12):1086-1089.
[8]Zeng J,Chen Y,Xie RS.Clinical observation of the therapeutic result of aidi injection combined chemotherapy of later period gastrointestinal malignance[J].Practic Clin Med,2007,8(6):23 -24,27.
[9]Niu J,Turton J ,Agrez MV.Integrin - mediated signaling of gelatinase B secretion in colon cancer cells[J].Biochem Biophys Res Comm,1998,249(4):287-291.
[10]Gu X,Niu J,Dorahy DJ,et al.Integrin αvβ6 - associated ERK2 mediates MMP-9 secretion in colon cancer cells[J].Br J Cancer,2002,87(3):348 -351.
[11]Kok SH,Cheng SJ,Hong CY,et al.Norcantharidin-induced apoptosis in oral cancer cells is associated with an increase of proapoptotic to antiapoptotic protein ratio[J].Cancer Lett,2005,217(1):43 -52.
[12]An WW,Wang MW,Tashiro S,et al.Norcantharidin induces human melanoma A375-S2 cell apoptosis through mitochondrial and caspase pathways[J].Korean Med Sci,2004,19(4):560 -566.
[13]An WW,Gong XF,Wang MW,et al.Norcantharidin induces apoptosis in HeLa cells through caspase,MAPK,and mitochondrial pathways[J].Acta Pharmacol Sin,2004,25(11):1502 -1508.

