褪黑素对急性肾脏缺血-再灌注损伤小鼠热休克蛋白表达的影响*
杨红英,贾孟良 ,谢守霞,黄 毅,谢 立
(1.广东省深圳市人民医院·暨南大学第二临床医学院,广东 深圳 518020;2.广东省深圳市孙逸仙心血管医院,广东 深圳 518020)
缺血-再灌注损伤是临床常见的病理现象。急性肾缺血较常见于创伤、休克、败血症、产后大出血、肾移植等大手术后。在肾缺血-再灌注过程中,会产生肾小管缺血损伤、坏死等,从而损伤肾小管的功能[1-2]。目前对肾缺血-再灌注损伤尚无理想药物,临床以营养支持、透析等方法治疗,等待肾功能恢复。为寻找抗肾缺血-再灌注损伤药物,笔者观察了褪黑素(melatonin)对肾脏缺血-再灌注损伤的组织结构保护作用,探讨其对肾脏缺血-再灌注时热休克蛋白(HSP70)表达的影响,试图了解褪黑素对肾脏缺血-再灌注损伤的保护作用机制,为临床用药提供理论依据。
1 材料与方法
1.1 材料
健康雄性昆明种小鼠,体重18~22 g,广东省医学实验动物中心提供,动物合格证号为2007A006,试验前常规饲养1周,饲养条件为屏障环境(温度20~25℃,湿度40% ~70%)。褪黑素(美国Sigma公司,批号为25H0904,纯度大于99%,使用前用3%乙醇生理盐水溶解)。热休克蛋白免疫组化(SABC)试剂盒(武汉博士德公司),其余试剂及有机溶剂均为分析纯。
1.2 试验方法
造模:小鼠腹腔注10%水合氯醛(30 mg/kg)麻醉,固定后,常规消毒手术区。小鼠腹正中切口,切除右侧肾脏,游离左侧肾脏,用无创血管夹夹闭左侧肾蒂45 min,去除血管夹,肉眼观察3 min,若左侧肾脏灌注后颜色由暗黑转为红润,表示灌注成功,缝合切口,再灌注24 h[3]。
分组与给药:将小鼠随机分为4组,褪黑素高、低剂量组(n=10),术前30 min腹腔分别注射褪黑素10 mg/kg和1 mg/kg,夹闭左侧肾蒂缺血45 min,再灌注24 h;缺血-再灌注组(n=10),术前30 min腹腔注射与治疗量等容量的3%乙醇生理盐水,夹闭左侧肾蒂缺血45 min,再灌注24 h;假手术组(n=10),术前30 min腹腔注射与治疗量等容量的3%乙醇生理盐水,全身麻醉后只切除右肾,缝合切口。4组均在24 h后取血和肾组织。
肾脏病理检查:肾组织经10%福尔马林固定24 h,脱水,石蜡包埋,切片厚4 μm做HE染色,最后在光学显微镜下观察肾小管的结构及肾小球内中性粒细胞的数目。
免疫组化检测:采用SABC法检测肾组织中热休克蛋白的表达。将石蜡包埋的肾组织标本切成4 μm厚切片,然后按以下步骤进行。肾组织石蜡切片脱蜡至水;滴加3%H2O2,室温放置10 min,磷酸盐缓冲溶液洗涤3次;热修复抗原,切片浸入磷酸盐缓冲液,微波炉加热至沸腾后断电,间隔10 min后,反复1次,冷却后磷酸盐缓冲液洗涤2次;滴加工作浓度一抗,37℃孵育30 min,磷酸盐缓冲液洗涤3次;滴加工作浓度二抗,37℃孵育20 min,磷酸盐缓冲液洗涤3次;滴加SABC,37℃放置20 min,磷酸盐缓冲液洗涤3次;3,3二氨基联苯胺(DAB)显色,显微镜下控制反应时间,呈棕黄色为止,蒸馏水洗涤;苏木素复染;脱水、透明、封片。热休克蛋白阳性反应为胞浆呈棕黄色染色,不着色者为阴性反应,并采用计算机图像灰度分析,测定平均灰度值。
1.3 统计学处理
2 结果
2.1 对肾小球内中性粒细胞的影响
肾脏组织病理检查,假手术组肾小球、肾小管结构正常,肾小球内偶见中性粒细胞;缺血-再灌注组小鼠左肾血流被阻断45 min后恢复再灌注24 h,肉眼可见肾皮质较苍白,肾髓质呈暗红色,光镜下可见肾小管上皮细胞肿胀,出现不同程度的变性、坏死,部分肾小管细胞出现混浊肿胀,管腔内可见蛋白管型及脱落上皮细胞,间质充血水肿,肾小球内中性粒细胞数目明显增多(P<0.01);褪黑素高、低剂量组小鼠肾脏外观与假手术组相似,光镜下仅见部分肾小管细胞轻度肿胀,肾缺血性改变明显减轻,肾小球内中性粒细胞数目较缺血-再灌注组明显减少(P<0.01)。结果见表1。
表1 褪黑素对肾缺血-再灌注损伤小鼠肾小球内中性粒细胞和肾组织热休克蛋白表达强度的影响()

表1 褪黑素对肾缺血-再灌注损伤小鼠肾小球内中性粒细胞和肾组织热休克蛋白表达强度的影响()
注:与假手术组相比,*P<0.01;与缺血-再灌注组相比,△P<0.01;▲P <0.01。
2.2 对肾组织热休克蛋白表达强度的影响
各组肾组织均有热休克蛋白的表达,其中假手术组肾组织仅有少量热休克蛋白表达;与假手术组相比,缺血-再灌注组肾组织热休克蛋白的表达显著增强(P<0.01);与缺血-再灌注组相比,褪黑素高、低剂量组肾组织热休克蛋白的表达显著增强。各组肾组织热休克蛋白表达强度经图像分析系统测定结果见表1和图1。
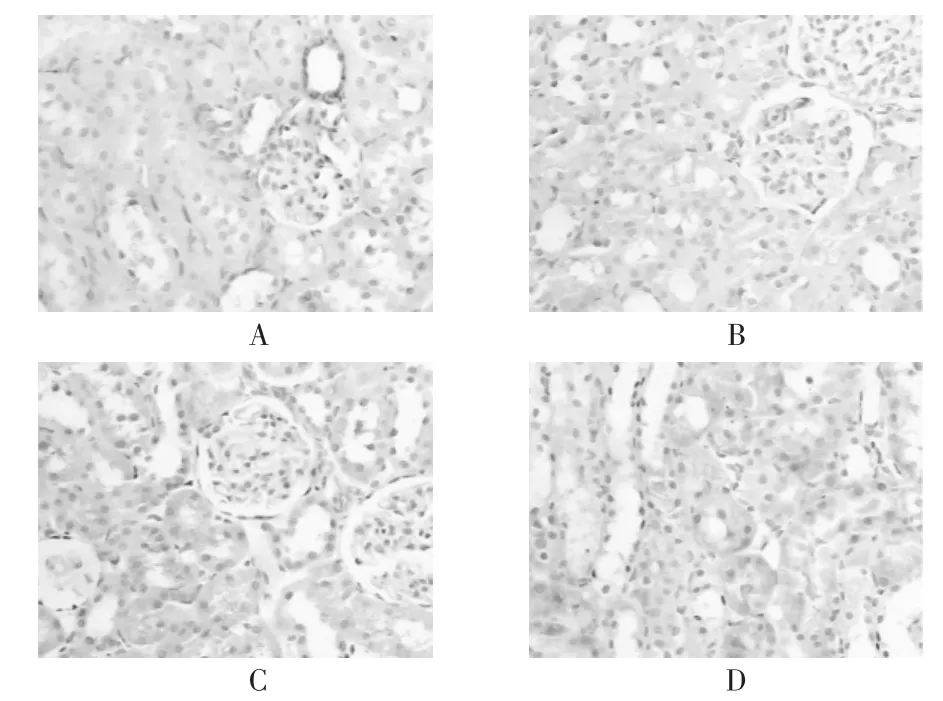
图1 各组热休克蛋白的表达情况
3 讨论
持久的肾脏缺血将造成不可逆的损伤,尽快恢复再灌注是治疗肾脏缺血的基本保证,但再灌注可能进一步加重肾脏细胞的损伤。缺血-再灌注导致的组织细胞损伤主要与活性氧自由基产生、膜脂质过氧化、细胞内钙超载、能量消耗、细胞骨架紊乱等密切相关。在肾缺血-再灌注损伤过程中,肾脏在黄嘌呤氧化酶催化下,由次黄嘌呤生成尿酸的过程中,产生大量的活性氧自由基损伤组织。循环中的中性粒细胞与肾血管内皮细胞的黏附和随后的中性粒细胞激活与浸润,可降低肾小球滤过率和肾小管的重吸收,加剧肾缺血-再灌注损伤[2]。
研究显示,褪黑素是迄今为止发现的最强、最有效的自由基清除剂和抗氧化剂,可通过多种途径发挥抗缺血-再灌注损伤方面保护作用[4-6]。褪黑素通过发挥自身的自由基清除剂作用,以及增加谷胱甘肽(GSH)、减少缺血-再灌注后心肌组织中丙二醛(MDA)产生等抗氧化作用,减少心肌组织细胞凋亡和坏死,从而减少缺血再灌注后心脏的梗死面积[6]。褪黑素可以降低缺血再灌注后肝组织的氧化损伤程度,减少多形核白细胞(PMN)的浸润[7]。缺血后使用褪黑素处理可以减少额脑区的一氧化氮(NO)、环磷酸鸟苷(cGMP)、活化型一氧化氮合酶(iNOS),同时减少微血管中黏附因子的生成和附壁白细胞的数目,减轻缺血再灌注后组织器官微循环的无复流现象[8]。光镜观察结果表明,褪黑素对急性肾缺血-再灌注损伤具有保护作用。
热休克蛋白在正常细胞中水平较低,而在应激状态下显著升高,在缺血、缺氧等情况下,如局灶及全脑缺血后受损细胞内的变性蛋白可诱导热休克蛋白表达。热休克蛋白等内源性物质在肾脏缺血-再灌注损伤中有重要作用,其对缺血-再灌注肾脏的保护作用可能与以下机制有关:抑制肾组织的炎症反应[9];热休克蛋白发挥分子伴侣作用稳定缺血时Na+-K+-ATP酶在细胞骨架上的锚着,稳定细胞骨架[10];减轻Ca2+介导的细胞损伤[11]。
本研究结果显示,假手术组小鼠肾小球、肾小管结构正常,仅有少量热休克蛋白表达;缺血-再灌注组小鼠肾小管上皮细胞肿胀,出现不同程度的变性、坏死,热休克蛋白表达较假手术组显著增强,这是由于缺血本身为一种应激反应,可诱导其表达,而且也是机体调动内源性保护机制,发挥细胞保护作用;褪黑素高、低剂量组缺血性改变较缺血再灌注组明显减轻,接近正常,热休克蛋白表达丰富。热休克蛋白表达的上调,可能是褪黑素对肾缺血细胞在转录和翻译水平上调热休克蛋白的表达,从而使其合成增加,使得肾脏对缺血及氧化损伤的抵抗能力增加,显著改善小鼠肾脏缺血-再灌注的损伤。
[1]Yokozawa T,Liu ZW,Dong E.A study of Ginsenoside Rd in a renal ischemia reperfusion model[J].Nephron,1998,78(2):201.
[2]Nath KA,Norby SM.Reactive oxygen species and acute renal failure[J].Am J Med,2000,109(8):665.
[3]谢守霞,张万帆,贾孟良,等.基因芯片分析银杏叶提取物对小鼠肾缺血再灌注损伤的保护作用机制[J].中国医院药学杂志,2006,26(12):1455.
[4]Reiter RJ,Tan DX.Melatonin:a novel protective agent against oxi-dative injury ofthe ischemic/reperfused heart[J] .CardiovascularRes,2003,58(1):10.
[5]Han YX,Zhang SH,Wang XM,et al.Inhibition of mitochondria responsiblefor theanti-apoptoticeffects ofmelatonin duringischemiareperfusion[J].J Zhejiang Univ Sci B,2006,7(2):142.
[6]Lochner A,Genade S,DavidsA,et al.Short-and long-term effects of melatonin on myocardial post-ischemic recovery[J].J Pineal Res,2006,40(1):56.
[7]Freitas I,Bertone V,Guarnaschelli C,et al.In situ demonstration of improvement of liver mitochondria function by melatonin after cold ischemia[J].In Vivo,2006,20(2):229-237.
[8]Cuzzocrea S,Costantino G,Mazzon E,et al.Beneficial effects of melatonin in a rat model of splanchnic artery occlusion and reperfusion[J].J Pineal Res,2000,28(1):52-63.
[9]Wang Y,Whittall T,McGowan E,et al.Identification of stimulating and inhibitoryepitopeswithin theheatshock protein 70 moleculethat modulate cytokine production and maturation of dendritic cells[J].J Immunol,2005,174(6):3306-3316.
[10]Bidmon B,Endemann M,Müller T,et al.HSP-25 and HSP-90 stabilize Na,K-ATPase in cytoskeletal fractions of ischemic rat renal cortex[J].Kidney Int,2002,62(5):1620-1627.
[11]Giachelli CM,Jono S,Shioi A,et al.Vascular calcification and inorganic phosphate[J].Am J Kidney Dis,2001,38(4 suppl 1):S34-37.

