含油废水中絮凝剂产生菌DX-3的分离鉴定及特性研究
张红莲,夏立群,段东霞,谢悦芬
(1.广东海洋大学水产学院,广东 湛江 524088;2.中船重工725研究所青岛分部,山东 青岛 266071)
絮凝法是处理含油废水的一种常用方法,在废水处理中占有十分重要的地位[1~4]。目前,我国炼油工业污水一般采用“隔油—浮选—生化”的处理工艺,绝大多数炼油企业的外排水虽可以达标,但炼油污水的排放量逐年增加,必然会导致各种污染物在水体、土壤或生物体中的富集,经历复杂的迁移转化过程后,仍会带来一定程度的污染。因此,研究适宜的污水深度处理工艺,以保证炼油污水循环回用十分必要。生物法在污水回用深度处理中应用非常广泛,能降解多种污染物,处理成本低,运行稳定可靠,抗冲击能力很强。
微生物絮凝剂(Microbial flocculant,MBF)是一类由微生物产生并分泌到细胞外,具有高效、无毒、无二次污染和易于生物降解等特点的新型絮凝剂,在城市生活污水、食品废水和制药废水的处理方面应用广泛,在石油炼化行业含油废水的处理方面也有较大的应用潜力[3~7]。
作者从湛江市东兴炼油厂附近污水中分离筛选得到一株高产微生物絮凝剂的芽孢杆菌DX-3,并对其絮凝特性进行了考察和分析,拟为石油炼化废水处理研究以及工业化应用提供一定的参考。
1 实验
1.1 材料与培养基
污水样品采自湛江市东兴炼油厂附近污水河。
分离培养基:酵母膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,H2O 1 L,pH值7.2。
发酵培养基:葡萄糖20 g,尿素0.5 g,酵母膏0.5 g,K2HPO45 g,KH2PO42 g,NaCl 0.1 g,(NH4)2SO40.2 g,MgSO4·7H2O 0.2 g,去离子水1 L,pH值7.5~8.5。
炼油厂废水培养基[5]:FeSO40.15 g、NaNO30.1 g、MgSO40.05 g、NH4Cl 0.1 g、煤灰0.2 g、原油0.08 g,去离子水1 L,pH值自然。
无机盐培养液[8]:(NH4)2SO41 g,NaCl 2 g,Na2CO35 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,去离子水1 L,pH值7.0。
1.2 方法
1.2.1 菌株筛选
取1 mL污水样品,稀释至10-4、10-5、10-6级浓度,每个梯度稀释液吸取100 μL涂布于分离培养基平板,30 ℃培养48 h,挑选表面光滑且带有粘性的单菌落再次接种于相应的平板培养基划线纯化,然后各挑取一环纯化菌株接种于发酵培养基中30 ℃、160 r·min-1振荡培养48 h。取1 mL菌悬液进行定量的絮凝活性测定。重复多次筛选和纯化步骤,直到获得具有稳定高效絮凝活性的絮凝剂产生菌。
1.2.2 菌株的鉴定
1.2.2.1 菌株的形态学观察及生理生化特征鉴定
将所筛选菌株划线于分离培养基,37 ℃培养48 h,观察菌落形态,挑取单菌落进行革兰氏染色并进行镜检;同时参照《常见细菌系统鉴定手册》[9]对DX-3菌株进行一系列的生理生化实验。
1.2.2.2 16S rDNA序列测定
采用细菌通用引物,正向引物基因序列5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物基因序列5′-AAGGAGGTGATCCAGCCGCA-3′。PCR反应体系为:10×PCR Buffer 2.0 μL、2.5 mmol·L-1dNTPs 1.6 μL、10 μmol·L-1引物各0.4 μL、Taq酶0.3 μL,超纯水补足20 μL。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,33个循环,最后72 ℃延伸8 min。PCR产物以1%琼脂糖凝胶电泳检测后用DNA纯化回收试剂盒(TIANGEN公司)回收,与pMD18-T载体连接,转化大肠杆菌DH5α感受态细胞,将所得阳性菌送华大生物技术公司测序,测定结果利用GenBank数据库进行同源性分析,确定分离筛选得到菌株的分类地位。
1.2.3 细胞生长周期及产絮凝剂周期的测定
将备选菌株接种到发酵培养基中,37 ℃、160 r·min-1恒温振荡连续培养96 h。每隔6 h取菌悬液,测定培养液OD660,以未接菌的培养基作参比调零,同时测定培养液对高岭土悬浊液的絮凝活性,绘制曲线图。
1.2.4 絮凝条件实验
1.2.4.1 培养液絮凝活性分布测定
将备选菌株培养72 h的发酵液于6000 r·min- 1离心30 min,取上清液装无菌试管,用蒸馏水将菌体细胞洗涤3次,重悬于与发酵原液等体积的蒸馏水中,制得菌悬液。以空白培养基作对照,分别测定发酵液、上清液和菌悬液对高岭土悬浊液的絮凝能力,以确定菌株所产絮凝剂的絮凝活性分布。
1.2.4.2 絮凝剂投加量对絮凝效果的影响
取备选培养液0.1 mL、0.3 mL、0.5 mL、0.7 mL、0.9 mL、1.0 mL、1.2 mL、1.5 mL、2.0 mL分别投加到100 mL高岭土悬浊液和含油废水中,测定其絮凝率。
1.2.5 对含油废水的处理实验
挑取备选菌株先行活化至100 mL发酵培养基中,37 ℃、160 r·min-1振荡培养18 h,收集菌体后用发酵培养基稀释成OD660=0.5的菌悬液(以发酵培养基作为空白对照)。
1.2.5.1 温度对处理效果的影响
在45 mL无机盐培养液中加入50 mL含油废水(CODCr135 mg·L-1,下同)后接入5 mL菌悬液,分别在17 ℃、22 ℃、27 ℃、32 ℃、37 ℃和42 ℃下恒温振荡培养6 d,取培养液测其COD去除率[10]及石油类去除率,所有处理均重复3次。
1.2.5.2 pH值对处理效果的影响
在45 mL无机盐培养液中加入50 mL含油废水后接入5 mL菌悬液,分别调pH值为4、5、6、7、8、9和10,在优选温度下恒温振荡培养6 d,取培养液测其COD去除率及石油类去除率,所有处理均重复3次。
1.2.5.3 废水体积对处理效果的影响
分别在10 mL、20 mL、30 mL、40 mL、50 mL、60 mL、70 mL和80 mL含油废水中加无机盐培养液至90 mL左右,接入5 mL菌液,再加无机盐培养液定容至100 mL,在优选温度和pH值下恒温振荡培养6 d,取培养液分别测其COD去除率和石油类去除率,所有处理均重复3次。
1.2.6 絮凝活性的测定[11]
絮凝活性用絮凝率表示。在100 mL烧杯中配制4 g·L-1的高岭土悬浊液,快速搅拌1 min,再加入90 mmol·L-1CaCl2溶液1 mL,搅拌30 s,然后加入1 mL菌体培养液搅拌30 s,静置10 min。取上清液,用分光光度计测定550 nm波长处吸光度,记为M。不加菌体培养液做空白实验,其吸光度值记为N。絮凝率按下式计算:
含油废水絮凝活性测定方法与高岭土悬浊液测定方法相同。
1.2.7 石油降解率的测定
采用紫外分光光度法[12]测定石油降解率。用处理过的石油作标准油样,以沸程60~90 ℃的石油醚为溶剂,配制成一系列的石油标准溶液,用分光光度计测定225 nm处测吸光度值,以吸光度值为纵坐标、石油浓度为横坐标,绘制工作曲线。培养液经萃取和适当稀释后,测其吸光度值,然后在工作曲线上查出含油量,计算降解率。
2 结果与讨论
2.1 菌株的分离和初步鉴定
从4个污水点采样后分离纯化出56株菌落表面油亮、均匀、湿润的菌株,经过多次分离纯化和传代培养,得到1株具有稳定高效絮凝活性的絮凝剂产生菌,命名为DX-3。DX-3菌落表面白色泛微黄,菌体细胞杆状,革兰氏染色阳性,产芽孢。生理生化特性鉴定结果如表1所示。
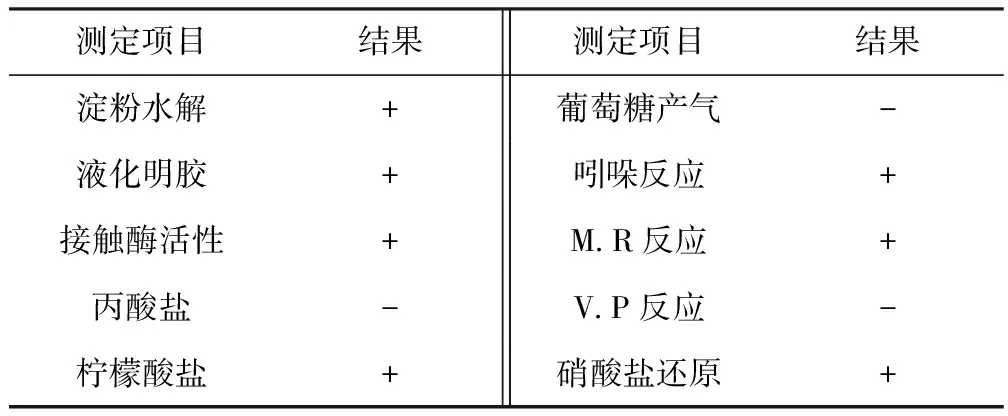
表1 DX-3菌株的生理生化特征
根据细菌的菌落形态以及表1结果,结合《常见细菌系统鉴定手册》[9]中相关描述,初步鉴定菌株DX-3为芽孢杆菌属(Bacillussp.)。
2.2 DX-3菌株的16S rDNA序列分子鉴定
以菌株DX-3的DNA为模板,扩增菌株的16S rDNA 基因序列,PCR产物凝胶电泳图见图1。
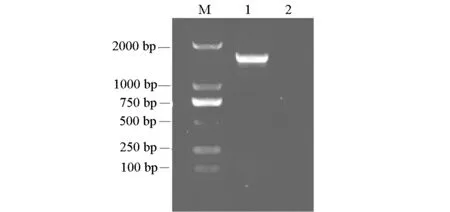
M.DNA Marker DL2000 1.DX-3 PCR Product 2.Negative control
由图1可知,PCR扩增得到长约1500 bp的16S rDNA片段。扩增片段经测序,测得其长度为1.548 bp,将测得的序列提交到GenBank,序列号为:JN399219。在国际生物技术信息网中心(NCBI)数据(http://www.ncbi.nlm.nih.gov/)中对DX-3进行序列同源性分析,运用ClustalX1.83软件与从GenBank数据库中获得的7株同源性较高的菌株序列和5株Bacillussp.其它属菌株序列进行16S rDNA序列比对,运用Mega3.0软件以NJ法构建16S rDNA系统发育树(图2),Bootstrap检验,重复1000次,确定该菌的分类地位。
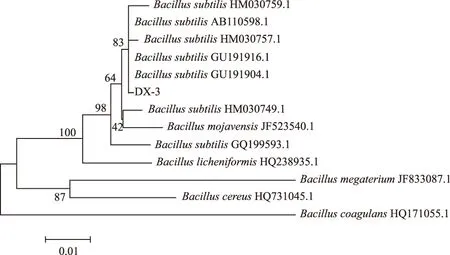
图2 基于16S rDNA基因序列构建的DX-3菌株系统发育树
由图2可知,DX-3菌株与枯草芽孢杆菌属亲缘关系最近。
2.3 DX-3菌株的生长特性及产絮凝剂特性(图3)
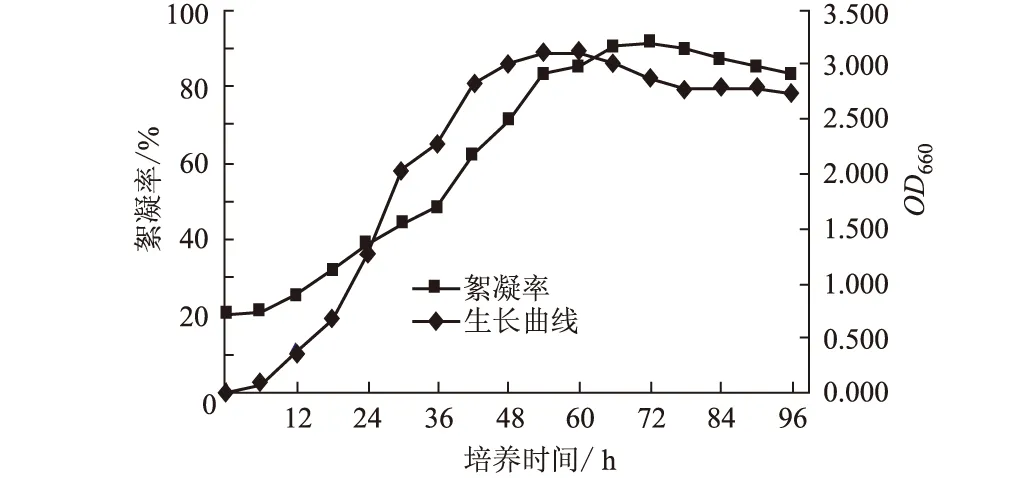
图3 菌株DX-3生长曲线及絮凝率
由图3可知,菌株DX-3的生长曲线可分为4个时期,静止期和对数生长期(0~54 h)、稳定期(54~60 h)、衰减期(60~96 h)。细胞生长量在54 h达到最高。菌株生长早期即有了一定的絮凝活性,说明该絮凝剂不是由微生物细胞自溶产生的胞内物质,絮凝物是在菌株生长过程中产生的。培养初期,培养液絮凝活性较低;在菌株对数生长期,伴随着细胞生长量的增长,絮凝活性不断提高,在72 h达到最大,絮凝活性与细胞生长量呈正相关;随着培养时间的继续延长,絮凝活性稍有下降,这可能是由于体系中解絮凝活性酶的产生所致。
2.4 絮凝条件
2.4.1 培养液絮凝活性分布(图4)
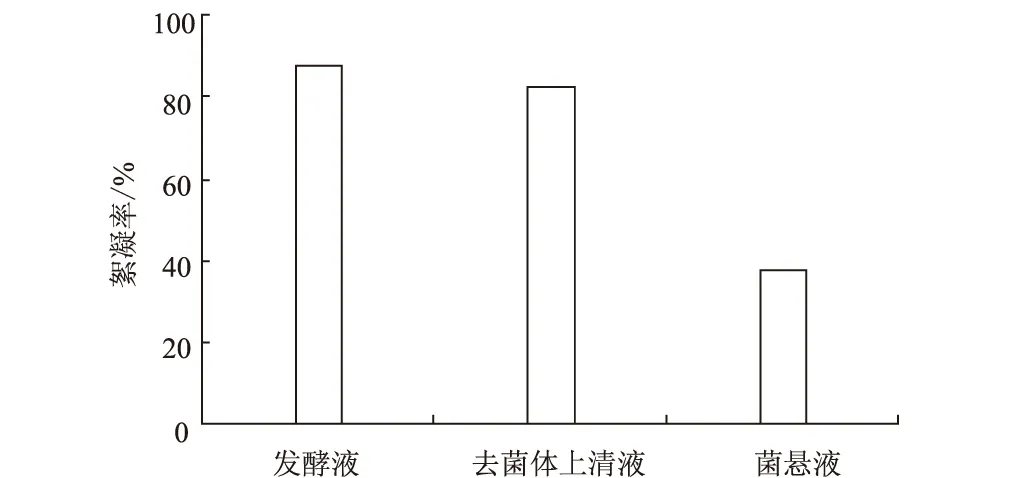
图4 DX-3菌株絮凝活性分布
由图4可知,发酵液絮凝效果最好,去菌体上清液效果次之,菌悬液絮凝效果最差。说明絮凝活性成分主要分布在发酵液中,该絮凝剂为微生物的胞外产物。
2.4.2 絮凝剂投加量对絮凝效果的影响(图5)
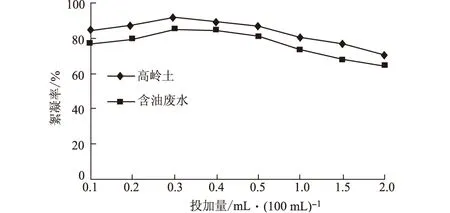
图5 微生物絮凝剂投加量对絮凝效果的影响
由图5可以看出,絮凝率并不与絮凝剂的投加量成正比,而是存在着一个有效的范围。当投加量为0.3 mL·(100 mL)-1时,絮凝剂对高岭土悬浊液和含油废水的絮凝率均达到最大,分别为91.5%和85%,随着投加量的继续增加,絮凝率呈现下降的趋势。有研究表明[13~15],絮凝剂投加量的最佳值约为固体颗粒表面吸附大分子化合物达到1/2饱和时的吸附量,此时架桥几率最大。如果投加大分子絮凝剂过量,胶体颗粒将被过多吸附的大分子所包围,反而失去了同其它微粒架桥结合的机会。因此,为了有效絮凝必须确定最佳絮凝剂投加量。
2.5 对含油废水的处理效果
2.5.1 温度对处理效果的影响(图6)
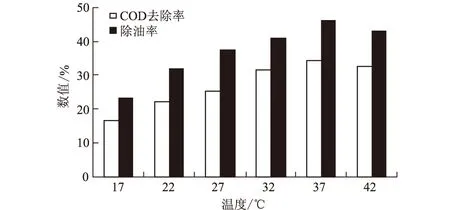
图6 温度对含油废水处理效果的影响
由图6可知,DX-3菌株在17~42 ℃的温度范围内皆能生长。温度为37 ℃时,DX-3菌株对含油废水的COD去除率和除油率均达最高,分别为34.26%和46%。可见,适宜的温度在加快菌体增殖的同时,也提高了其次生代谢产物絮凝剂的产生效率。
2.5.2 pH值对处理效果的影响(图7)
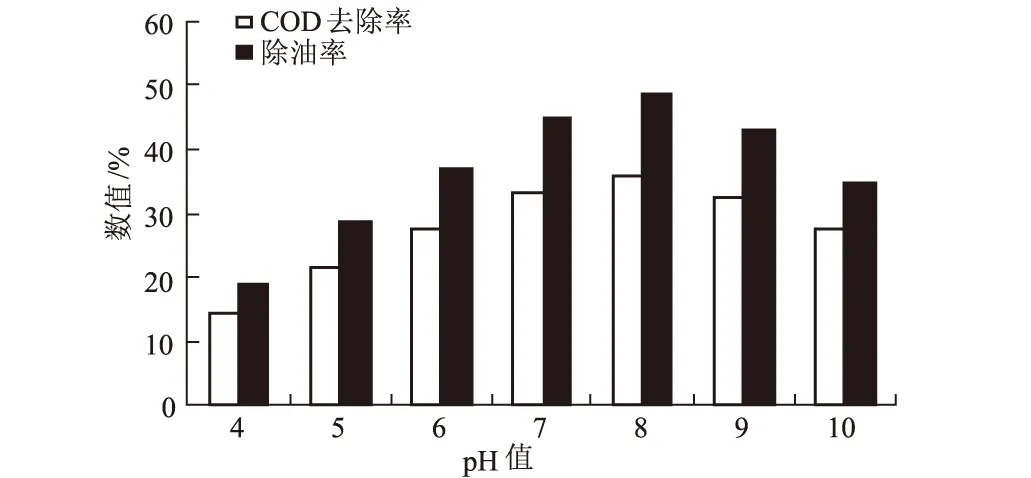
图7 pH值对含油废水处理效果的影响
由图7可知,当培养基pH值为8时,DX-3菌株对含油废水的COD去除率和除油率均达最高,分别为35.8%和48.4%。由于pH值影响菌细胞生长、带电状态、氧化还原电位及废水中化合物的离子化作用,故而对絮凝效果影响很大,DX-3菌株在弱碱性环境中絮凝效果较好。
2.5.3 含油废水体积对处理效果的影响(图8)
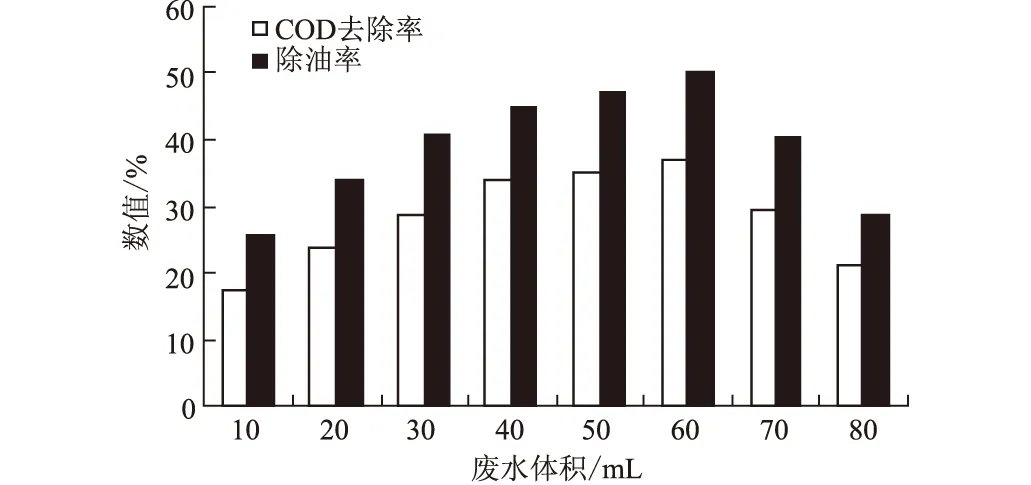
图8 废水体积对含油废水处理效果的影响
由图8可知,含油废水体积为60 mL(即体积分数为60%)时,DX-3菌株对废水的COD去除率和除油率均达最高,分别为37.2%和50.1%。随着含油废水量的增大,所能提供给DX-3菌株的碳源及氮源也同时增多,其培养过程中COD去除率和除油率都有显著提高;但更大剂量的废水则可能对DX-3菌株的生长产生毒害作用,反而导致絮凝活性降低。
3 结论
分离筛选得到一株高效絮凝剂产生菌DX-3,通过分子生物学结合传统分类方法,鉴定为枯草芽孢杆菌属。DX-3菌株产生的絮凝剂是一种胞外产物,絮凝活性成分主要分布在发酵液中。该絮凝剂用量少、效果好,0.3 mL菌悬液可使100 mL 4 g·L-1高岭土悬浊液达到91.5%的絮凝率,对含油废水的絮凝率也高达85%。当温度为37 ℃、pH值为8、废水体积分数为60%时,DX-3菌株对含油废水的COD去除率达37.2%、除油率达50.1%。
DX-3菌株是一株具有较强的炼油厂废水耐受性絮凝剂产生菌,其独特之处在于能以炼油厂废水作为主要的氮源及碳源生长,并能在生长过程中产生高效的絮凝剂,吸附废水中的小分子颗粒,导致废水的COD显著下降,因此具有较高的实际应用价值,但其处理废水的深层生化机制还有待进一步研究。
参考文献:
[1] 孙莉英,杨昌柱.含油废水处理技术进展[J].华中科技大学学报(城市科学版),2002,19(3):87-90.
[2] Liu W,Yuan H,Yang J,et al.Characterization of bioflocculants from biologically aerated filter backwashed sludge and its application in dying wastewater treatment[J].Bioresource Technol,2009,100(9):2629-2632.
[3] Kurane R,Nohata Y.Microbial flocculation of waste water liquids and oil emulsion by a bioflocculant fromAlcaligeneslatus[J].Agric Biol Chem,1991,55(4):1127-1129.
[4] Salehizadeh H,Shojaosadati S A.Extracellular biopolymeric flocculants:Recent trends and biotechnological importance[J].Biotechnology Advances,2001,19(5):371-385.
[5] 刘其友,张云波,赵朝成,等.微生物絮凝剂产生菌的筛选及其对含油废水的处理研究[J].化学与生物工程,2010,27(8):80-82.
[6] Vijayalashmi S P,Raichur A M.The utility ofBacillussubtilisas a bioflocculant for fine coal[J].Colloids and Surfaces B:Biointerfaces,2003,29(1):265-275.
[7] Zhang J,Liu Z,Wang S,et al.Characterization of a bioflocculant produced by the marine myxobacteriumNannocystissp.NU-2[J].Appl Microbiol Biotechnol,2002,59(4-5):517-522.
[8] 吴培诚,龚水明,杜林.生物絮凝剂产生菌的筛选鉴定及其絮凝活性[J].仲恺农业工程学院学报,2010,23(2):25-28.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-65.
[10] 国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,1997:372-374.
[11] 马青山,贾瑟,孙丽珉.絮凝化学和絮凝剂[M].北京:科学出版社,1988:149-150.
[12] 周瑜,柴迎梅,杜宗军,等.海洋石油降解菌的分离、鉴定和与微藻共培养[J].海洋环境科学,2011,30(2):230-233.
[13] Zhang Z,Xia S,Zhao J,et al.Characterization and flocculation mechanism of high efficiency microbial flocculant TJ-F1 fromProteusmirabilis[J].Colloids and Surface B:Biointerfaces,2010,75(1):247-251.
[14] Gong X Y,Luan Z K,Pei Y S,et al.Culture conditions for flocculant production byPaenibacilluspolymyxaBY-28[J].J Environ Sci Health A Tox Hazard Subst Environ Eng,2003,38(4):657-669.
[15] Yokoi Haruhiko,Yoshida Takashi,Hirose Jun,et al.Biopolymer flocculant produced by anPseudomonassp.[J].Biotechnology Techniques,1998,12(7):511-514.

