模拟高原低氧环境对兔龈下菌斑影响的实验研究
黄镜静,武 曦,张 纲,谭颖徽,高钰琪
(重庆 400037:1.第三军医大学新桥医院口腔科;2.第三军医大学高原军事医学系)
牙周病是成年人牙齿丧失的首要原因,其中高原牙周病又以其发病率高,进展迅猛,对牙周支持组织破坏严重等特点引起广泛关注。已有大量研究[1-2]表明:高原地区牙周病的发病率和病程进展速度远高于平原地区。牙菌斑是牙周病的始动因子[3],虽然有关牙周病病原微生物方面的研究取得了一定进展,但由于牙周局部生态环境和牙周微生物生态关系的复杂,以及技术上的障碍,很多问题仍然没有完全阐明,尤其在高原特殊环境下牙周病病原微生物致病机制的研究较少。
基于本课题组在前期研究中[4]通过PCR-变形梯度凝胶电泳技术(Polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)分析发现:模拟高原环境下SD大鼠牙周炎致病菌具有多样性,且与平原牙周炎致病菌种类存在显著差异,本研究在模拟高原低氧环境建立兔牙周炎动物模型后,采用厌氧菌的分离、培养、鉴定、内毒素检测等技术对不同条件下龈下菌斑中定植的细菌种类、数量、毒力水平以及龈沟液pH值、活菌数、内毒素水平与牙周临床指标的相关性做进一步探讨。
1 材料和方法
1.1 主要材料和仪器
中国大白兔,雄性,体质量(1.9 ±0.2)kg(新桥医院实验动物中心);低压氧舱(第三军医大学高原医学系);CDC厌氧血琼脂(CDC anaerobic blood agar)、无菌脱纤维羊血、维生素K1、氯化血红素、硫乙醇酸盐(thioglycollata,THIO)培养基、革兰氏染色试剂盒(上海江莱);厌氧产气袋、厌氧培养袋、氧气指示剂(三菱公司,日本);pH试纸(上海三爱思);显色基质鲎试剂盒(厦门市鲎试剂实验厂);DU-800核酸蛋白检测仪(Beckman公司,美国)。
1.2 动物分组和牙周炎模型的建立
取大白兔40只随机分为平原对照组、平原实验组、高原对照组、高原实验组,共4组,每组10只。平原实验组和高原实验组大白兔在速眠新肌肉注射(0.1~0.2 mL/kg体质量)麻醉下,用直径0.25 mm的正畸结扎丝结扎下颌双侧中切牙牙颈部,以结扎丝尽量进入龈沟内且不损伤牙龈为宜。两对照组不作任何处理。高原实验组、高原对照组送入低压氧舱(模拟海拔高度5000 m,23 h/d)内饲养,平原实验组和对照组均在平原环境下饲养。建模时间为8周,在此期间两实验组均按牙周炎食谱[5]饲养,两对照组普通饮食饲养。
1.3 牙周临床指标的检测
建膜8周时使用Williams牙周探针,参照文献[6]的方法检查所有动物实验牙的牙周探诊深度(probing depth,PD)、附着丧失(attachment loss,AL)水平、菌斑指数(plague index,PLI)和牙龈指数(gingival index,GI)。
1.4 龈沟液pH值的测定
所有动物实验牙经擦干、隔湿后,将 pH 5.5 ~9.0的试纸条(2 mm ×20 mm)插入牙周袋内,30 s后取出,对比比色卡读数。
1.5 牙周菌群和内毒素检测
1.5.1 培养基的配制
THIO培养基的配制:称取 THIO培养基29.25 g,加热搅拌溶解于1000 mL蒸馏水中,分装于适宜容器内,121℃高压灭菌15 min迅速冷却,加一层无菌液体石蜡油以隔绝空气,于4℃保存备用;CDC厌氧血平板的配制:称取CDC厌氧琼脂45.4 g加热搅拌溶解于1000 mL蒸馏水,121℃高压灭菌15 min,冷至45~50℃时加入无菌脱纤维羊血50 mL,氯化血红素5 mg,无菌维生素K110 mg混匀,倾入无菌平皿,于4℃保存备用。
1.5.2 龈下菌斑的采集
采集前,各组动物均用生理盐水冲洗实验牙,以去除食物残渣,干棉球隔湿,25 g/L碘酊棉球消毒牙体和局部牙龈,将无菌刮匙深入实验牙牙周袋底部,采集菌斑样本,立即放入装有2 mL事先加热刚冷却的硫乙醇酸盐半固体琼脂运输液的小管内,加一层消毒的液体石蜡油以隔绝空气,立即送往实验室进行厌氧菌培养。
1.5.3 细菌培养
将采集的菌斑样本用磁力搅拌器搅拌1 min,取1滴菌斑分散液涂片,革兰氏染色后镜检。然后再将菌斑分散液进行 10-1~10-6系列稀释,取200 μL稀释好的菌液接种于预还原的CDC厌氧血平板,并用 L棒迅速涂匀;另取100 μL接种于THIO液体培养基中,分别置厌氧培养袋中,800 mL/L N2,100 mL/L CO2,100 mL/L H2,37 ℃培养2~5 d,应用平板菌落计数法计算各组活菌数。
1.5.4 内毒素检测
采用合成基质偶氮显色法对培养24~48 h的新鲜菌斑分散液进行内毒素检测,严格按照显色基质鲎试剂盒所附说明书进行操作。
1.6 统计学分析
采用SPSS 17.0统计软件进行统计分析,各组AL,龈沟液pH值、活菌数、内毒素浓度等计量资料采用单因素方差分析,两两比较用t检验;各组PLI、GI采用秩和检验;龈沟液pH值、活菌数、内毒素浓度与牙周临床指标的相关性采用Spearman相关分析,检验水准α=0.05。
2 结果
2.1 建模8周后各组牙周临床指标比较
两实验组牙周各指标均高于其相应的对照组,差异有统计学意义(P<0.05),表明建模成功。4组中,各项临床指标均以高原实验组最高,与其他各组相比,差异均有统计学意义(P<0.05)(表1)。

表1 各组兔牙周临床指标的检测
2.2 建模8周后各组龈沟液pH值、活菌数及内毒素水平比较
4组龈沟液pH值、活菌数及内毒素水平均以高原实验组最高,与其他各组相比,差异均有统计学意义(P<0.05);高原对照组与平原实验组相比,上述各指标均无显著性差异(P>0.05),但明显高于平原对照组(P<0.05)(表2)。
表2 各组龈沟液pH值、活菌数及内毒素水平比较()

表2 各组龈沟液pH值、活菌数及内毒素水平比较()
不同字母组间P<0.05
分组 龈沟液pH值 活菌数(CFU/mL) 内毒素(EU/mL)平原对照组 7.04 ±0.29A 2.50 ×106±0.75 ×106A 0.84 ±0.21A平原实验组 7.43 ±0.39B 5.58 ×107±0.88 ×107B 1.20 ±0.16B高原对照组 7.42 ±0.37B 5.50 ×107±0.80 ×107B 1.19 ±0.20B高原实验组 7.80 ±0.39C 7.41 ×107±0.87 ×107C 1.48 ±0.22C
2.3 龈沟液 pH值、活菌数、内毒素水平与 AL、PLI、GI的相关性分析
龈沟液pH值、活菌数与AL、PLI、GI均呈正相关(P<0.05);内毒素水平仅与AL呈正相关(P<0.05),而与 PLI、GI无相关性(P >0.05)(表3)。

表3 龈沟液pH值、活菌数及内毒素水平与AL、PLI、GI的相关系数
2.4 各组龈下菌斑细菌的镜下形态(革兰氏染色法)
平原组龈下菌斑中细菌种类单一,主要以G-杆菌、球菌为主,而高原组细菌种类则较为丰富,G-杆菌、球菌,G+杆菌、球菌均占一定比例。(图1)
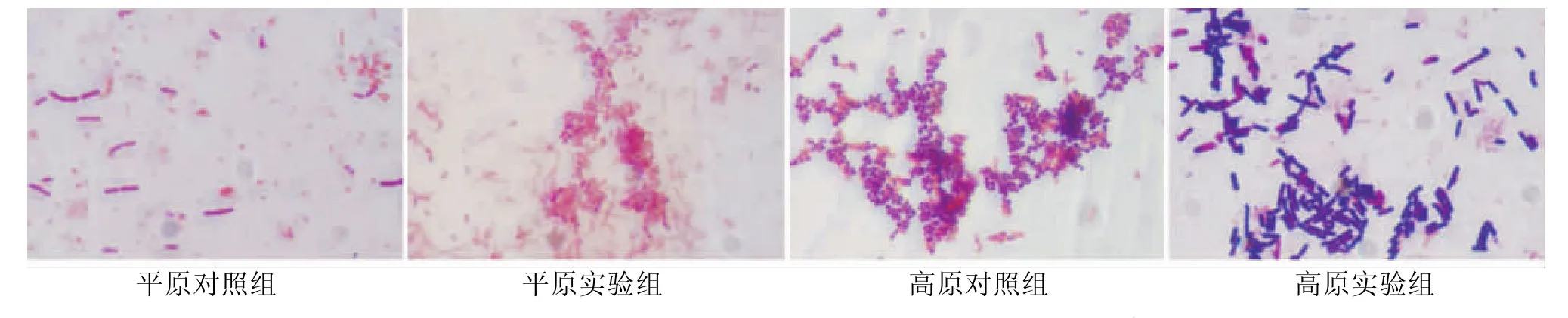
图1 各组龈下菌斑细菌的镜下形态(革兰氏染色,×1000)
3 讨论
牙周病是微生物所致的慢性感染性疾病,其发生发展与宿主防御机制、细菌之间相互作用、细菌在牙周定植的数量水平等诸多因素有关[7]。已有研究表明,菌斑细菌中以G-厌氧菌与牙周病的关系最为密切[3],内毒素(endotoxin)是 G-细菌细胞壁外膜中的脂多糖(lipopolysaccharide,LPS)成分,普遍存在于菌斑、唾液、龈沟液、炎症的牙龈和病变牙骨质中,在细菌死亡或裂解时可释放进入牙龈组织、牙髓组织或根尖周组织中,一方面对宿主细胞有直接损伤作用;另一方面可使宿主细胞致敏,当炎症创伤时,足够量的内毒素又可进入牙龈的小血管,造成牙周组织的损坏[8]。许多研究表明[9-10]内毒素是牙周炎症的重要病因之一,其水平与细菌种类、数量及牙周炎临床炎症程度等密切相关。
由于牙周炎的发病机制比较复杂,建立稳定、可靠、能够真实模拟人牙周炎发病情况的动物模型一直是研究牙周病的关键点之一。目前,用于建立牙周炎模型的动物有许多种,其中最常见的有啮齿类、灵长类、犬等,选择兔作为建模对象,特别是模拟高原低氧环境下建立兔牙周炎模型国内外尚未见报道。常用的制备牙周炎动物模型的刺激因素有正畸丝结扎,高糖饮食,特异菌接种以及免疫抑制等[5],本研究结合前两种最常用的方法成功建立了兔高原、平原牙周炎模型,并通过各项检测证实高原实验组与平原实验组在牙周临床指标及牙周菌群等方面均存在显著差异,相比以往常用的大鼠牙周炎模型,此建模方法操作简便,利于观察,为今后研究高原牙周病的发病机制、病理生理提供了良好的动物模型基础。
本研究结果显示:平原组龈下菌斑中细菌种类单一,以G-杆菌、球菌为主;而高原组中G-杆菌、球菌,G+杆菌、球菌,均占一定比例,进一步验证了高原低氧环境下菌群的多样性[4]。高原实验组兔龈沟液pH值、活菌数、内毒素水平均高于其余各组,提示高原低氧环境更适于G-厌氧菌的生长,与国内学者陈媛,杨生岳等的研究结果一致[11-12]。尽管平原组中龈下菌斑以G-杆菌、球菌为主,但其内毒素水平却显著低于高原组,说明高原组中的G-杆菌、球菌活跃度明显增强,导致更多的内毒素释放。此外,本结果还显示:龈沟液pH值、活菌数与 AL、PLI、GI呈正相关(P <0.05),内毒素水平与AL呈正相关(P<0.05),表明细菌的种类、数量越多,内毒素水平越高,引发牙周炎症的严重程度则越高。龈沟液pH值与牙周袋深度、龈下厌氧菌丛的生长情况、局部氧化还原电势等牙周微环境等多种因素有关[13]。根据以上结果我们推测:高原低压低氧的特殊环境更有利于内毒素含量较高的G-厌氧菌的定居,使得牙周袋内氧气消耗增加,氧化还原电势降低,pH值升高。
本研究对平原常氧及高原低氧环境下兔龈下菌斑中定植的细菌种类,数量,内毒素水平及其对牙周炎临床表现的影响进行了初步探讨,证实了兔高原及平原牙周炎模型的可行性,而不同菌种的分布比例及不同菌种在牙周炎发生发展过程中的作用机制还有待进一步探讨。
[1]王雯雯,李红英.驻青海高原3年某部战士社区牙周指数的变化[J].解放军预防医学杂志,2009,27(1):46 -47.
[2]肖娴,张纲,李焰,等.驻高原和平原官兵口腔健康状况调查[J].解放军预防医学杂志,2010,28(1):40 -41.
[3]Hajishengallis G.Complement and periodontitis[J].Biochem Pharmacol,2010,80(12):1992 -2001.
[4]肖娴,孔燕,张纲,等.模拟高原低氧环境下大鼠牙周炎致病菌多样性的实验研究[J].牙体牙髓牙周病学杂志.2009,19(9):517-520.
[5]吴世莲,刘丽.牙周炎动物模型的研究概况[J].口腔医学,2006,26(5):385 -387.
[6]孔燕,肖娴,张纲,等.模拟高原条件下大鼠龈沟液中TNF-α,PGE2,IL -8 与牙周炎的相关性研究[J].实用口腔医学杂志,2010,26(5):602 -604.
[7]Niemiec BA.Periodontal disease[J].Top Companion Anim Med,2008,23(2):72 -80.
[8]Muthukuru M,Jotwani R,Cutler CW.Oral mucosal endotoxin tolerance induction in chronic periodontitis[J].Infect Immun,2005,73(2):687 -694.
[9]Carratu P,Amato M,Riccitiello F,et al.Evaluation of leakage of bacteria and endotoxins in teeth treated endodontically by two different techniques[J].J Endod,2002,28(4):272 -275.
[10]Tang HM,Torabinejad M,Kettering JD.Leakage evaluation of root end filling materials using endotoxin[J].J Endod,2002,28(1):5 -7.
[11]陈媛.西宁地区518株呼吸道标本培养阳性结果分析及耐药性调查[J].高原医学杂志,2007,17(2):54 -55.
[12]杨生岳,贺巍,冯恩志,等.高原地区慢性阻塞性肺疾病合并肺心病急性加重期患者下呼吸道感染的病原菌分布特点及耐药性分析[J].中华临床医师杂志(电子版),2011,5(1):209-211.
[13]Marcelino SL,Gaetti-Jardim Jr E,Nakano V,et al.Presence of periodontopathic bacteria in coronary arteries from patients with chronic periodontitis[J].Anaerobe,2010,16(6):629-632.

