甲状旁腺激素对人牙囊前体细胞核因子κB受体激活因子配体和骨保护素mRNA表达的影响
荆晓艳,贾 智,刘大勇,赵梦明
(天津医科大学口腔医院,天津 300070)
牙齿萌出过程受许多因素的调节,包括细胞和 细胞因子间的相互作用。牙囊前体细胞分泌的细胞因子如巨噬细胞集落刺激因子-1(CSF-1)、单核细胞趋化蛋白-1(MCP-1)、骨保护素(osteoprotegerin,OPG)、上皮生长因子(EGF)、核因子 κB受体激活因子配体(receptor activator of nuclear fac-tor kappa-B ligand,RANKL)等,不仅有促进单核细胞募集的作用,还可促进其分化为破骨细胞,使牙槽骨吸收形成牙齿萌出通道,是牙齿萌出的重要调控物质[1-2]。近年来又有研究发现,牙胚萌出过程中甲状旁腺激素(parathyroid hormone,PTH)与相应受体结合发生障碍时,牙槽骨不G能吸收形成萌出道,说明PTH也是一种不可缺少的重要细胞调节因子[3-5]。PTH主要由成釉器星网状层细胞分泌,与临近的牙槽骨和牙囊间充质中的受体结合,调控细胞的分化。PTH与牙囊前体细胞分泌的促牙槽骨吸收的细胞因子间的相互作用尚未见相关报道。本研究通过体外培养人牙囊前体细胞,观察PTH对RANKL和OPG mRNA表达的影响。
1 材料和方法
1.1 主要试剂和仪器
重组人甲状旁腺激素1-84(上海起福生物科技有限公司);α-MEM培养液(Hyclone公司,美国);优级胎牛血清(PAA公司,德国);胰蛋白酶(Gibco公司,美国);引物(上海生工);TransZol Up、TransScript Two-Step RT-PCRsuperMix、DNA marker(全式金,北京);琼脂糖、梯度PCR仪(MJ Research公司,美国),倒置显微镜和照相系统(O-lympus公司,日本),凝胶成像分析仪(Vitbertourmat公司,法国)。
1.2 人牙囊前体细胞的体外培养和纯化
选择12~15岁因正畸治疗需要拔除第三磨牙的病人,取其埋伏阻生的下颌第三磨牙的牙囊组织,立即置预冷的含100 U/mL青霉素、100 mg/mL链霉素的PBS液中保存(4 h内用于实验)。在超静工作台内将牙囊组织用PBS液反复冲洗后,剪成0.5mm ×0.5mm ×0.5 mm 大小的组织块,均匀置于直径35 mm的无菌培养皿中,再置37℃、50mL/L CO2孵箱中,4 h后加入1 mL含100 mL/L胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的α-MEM培养液,3 d后半量换液,待细胞由组织块爬出后每3 d更换1次培养液,15 d后细胞融合,用含 EDTA 为0.2 mg/mL的2.5 mg/mL胰蛋白酶液消化,并按1∶2进行传代。利用细胞对胰蛋白酶消化时间的不同,以排除混杂的上皮细胞,达到纯化牙囊前体细胞的目的,约传代2次即可纯化细胞,取第3~5代细胞用于实验。在此期间,每日均用倒置相差显微镜观察细胞形态。
1.3 RT-PCR检测PTH作用下人牙囊前体细胞RANKL、OPG mRNA 的表达
1.3.1 人牙囊前体细胞的处理
取生长状态良好的第4代人牙囊前体细胞,用含0.2 mg/mL EDTA的2.5 mg/mL的胰蛋白酶溶液消化后,制成单细胞悬液,以2×103/cm2接种到直径为60 mm的培养皿,待细胞融合达80%左右后,进行如下实验。
1.3.1.1 不同浓度PTH对人牙囊前体细胞的作用
取上述培养的人牙囊前体细胞,分为4个实验组和1个对照组,4个实验组分别加入含PTH终末浓度为0.1、1、10、100 ng/mL 的 α - MEM 培养液;对照组加不含PTH的α-MEM培养液进行培养。培养2 h后去原培养液,PBS冲洗3次,加入1 mL TransZol使细胞充分裂解后,再按以下步骤提取总RNA:0.2 mL氯仿剧烈涡旋抽提分层,10000 r/min 4℃离心15 min,取无色水相上层,0.5 mL异丙醇析出沉淀,10000 r/min4℃离心10 min,弃上清,用1 mL无RNA酶的750 ml/L乙醇洗涤沉淀,5000 r/min 4℃离心5 min,弃上清,室温干燥形成胶状沉淀,将胶状沉淀充分溶于10 μL RNA溶解液后,取出1 μL稀释100倍,用紫外分光光度计分别测定280 nm和260 nm处的吸光度值(OD),以评定其浓度和纯度。然后再根据测定值调整RNA标本浓度为 1 μg/μL。
1.3.1.2 100 ng/mL PTH 刺激不同时间对人牙囊前体细胞的作用
取上述培养的人牙囊前体细胞,分为不用PTH刺激的空白对照组、100 ng/mL PTH刺激2、4、8 h组,分别于加样培养各时间点去原培养液,PBS冲洗3次,加入1 mL TransZol使细胞充分裂解后,按1.3.1.1 RNA 提取步骤提取总 RNA。
1.3.2 人牙囊前体细胞cDNA第一链合成和多聚酶链反应(PCR)
采用TransScript Two-Step RT-PCR superMix试剂盒。cDNA第一链合成20 μL体系:总RNA,50 ng~ 5 μg(5 ~ 500 ng);Anchored Oligo(dt)18(0.5 μg/μL)1μL;2 × TS Reaction Mix,10 μL;Trans-Script RT/RI Enzyme Mix,1 μL,Rnase-free Water to 20 μL。PCR 扩增 RANKL、OPG 和内参 GAPDH:OPG引物序列:上游引物:5'-CACAAATTGCAGTGTCTTTGGT - 3',下游引物:5'-AGGTGAGGTTAGCATGTCCAAT-3',产生 386 bp的 cDNA片段;RANKL引物序列:上游引物:5'-ATCACAGCACATCAGAGCAGAG-3',下游引物:5'-GGACAGACTCACTTTATGGGAACC-3',产生 126 bp 的 cDNA 片段。GAPDH引物序列:上游引物:5'-GTCAGTGGTGGACCTGACCT - 3',下 游 引 物:5'-AGGGGAGATTCAGTGTGGTG-3',产生413 bp的 cDNA片段。PCR 25 μL 反应体系:cDNA,1 μL;上游引物1 μL;下游引物 1 μL;2 × TransTaqTMHiFi PCR SuperMixⅡ,12.5 μL;ddH2O,8.5 μL。反应条件为:94 ℃ 变性5 min后,94 ℃变性30 sec,OPG56℃RANKL、GAPDH 58℃退火 30 sec,72℃延伸 1 min,35个循环,后72℃再延伸10 min。PCR产物行溴化乙啶染色(EB染色)琼脂糖凝胶电泳,观察,照相。
1.3.3 灰度值分析
用Quantity One软件进行灰度值分析,以样品灰度值与同一样品GAPDH的灰度值之比作为评价RANKL、OPG表达量的指标,采用软件绘制折线图观察比较两基因的表达量。
1.4 统计学分析
以上均为5次独立重复的实验,所得数据采用SPSS 16.0软件进行方差分析,两两比较用SNK-q检验,检验水准α=0.05。
2 结果
2.1 牙囊前体细胞的培养和纯化
牙囊前体细胞组织块法原代培养5 d左右可见部分组织块周围有细胞呈放散状爬出,大部分细胞为长梭形或纺锤形,呈成纤维细胞样形态,少部分呈多角形或不规则三角形,还可见到部分混杂的立方形扁平细胞,7 d后可见组织块周围细胞生长旺盛,去除组织块后,约14~20 d左右细胞融合达80%,利用细胞对胰蛋白酶消化时间的不同,经两次传代后细胞形态基本为成纤维样或多角形(图1),细胞得到纯化。

图1 体外培养的人牙囊前体细胞
2.2 不同浓度PTH对人牙囊前体细胞RANKL和OPG mRNA表达的影响
随着 PTH 浓度(0.1、1、10、100 ng/mL)增高,牙囊前体细胞RANKL mRNA的表达量逐渐增加,OPG mRNA的表达量逐渐降低,且不同浓度PTH作用各组之间RANKL和OPG mRNA的表达量均有显著差异(P <0.05)(图2~3,表1)。
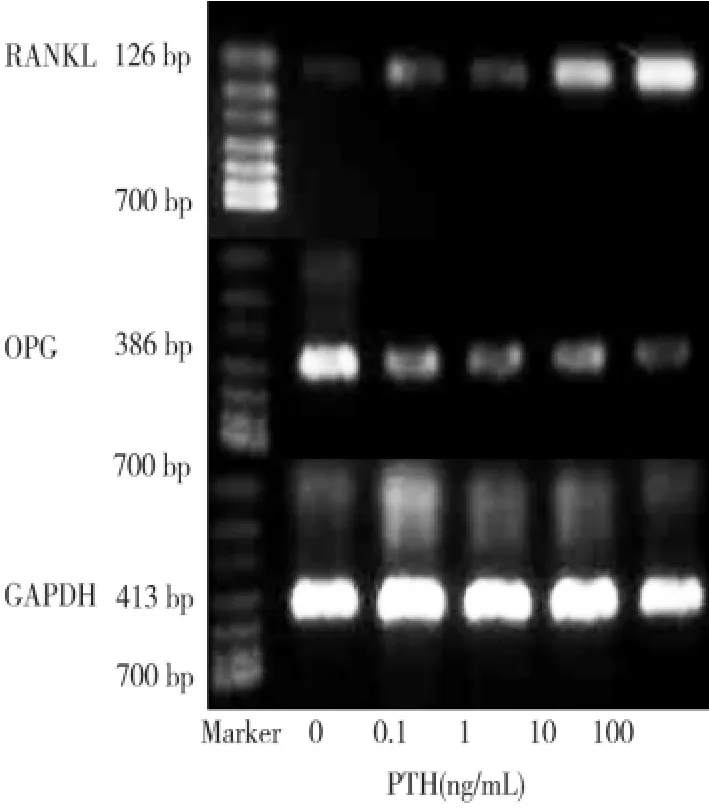
图2 不同浓度PTH作用下RANKL mRNA和OPG mRNA的表达

图3 不同浓度PTH作用下RANKL mRNA和OPG mRNA的相对灰度值比较
表1 不同浓度PTH作用下RANKL mRNA和OPG mRNA的相对灰度值()

表1 不同浓度PTH作用下RANKL mRNA和OPG mRNA的相对灰度值()
不同字母为各浓度组间P<0.05
PTH浓度(ng/mL)RANKL/GAPDH OPG/GAPDH A 0.0 0.164 ±0.0114A 0.678 ±0.00840.1 0.184 ±0.0114B 0.356 ±0.0114B 1.0 0.206 ±0.0152C 0.342 ±0.0084C 10.0 0.386 ±0.0182D 0.328 ±0.0084C 100.0 0.582 ±0.0109E 0.284 ±0.0089D
2.3 100 ng/mL PTH作用不同时间对人牙囊前体细胞表达RANKL和OPG mRNA的影响
RANKL mRNA随PTH作用时间增加表达量逐渐增加,OPG mRNA的表达量逐渐减低。且不同的作用时间下RANKL和OPG mRNA的表达量均有统计学差异(P<0.05)(图4~5,表2)。

图4 RANKL mRNA和OPG mRNA在PTH(100 ng/mL)不同作用时间的表达

图5 RANKL mRNA和OPG mRNA在PTH(100 ng/mL)不同作用时间的相对灰度值比较
表2 PTH作用不同时间RANKL mRNA和OPG mRNAp的相对灰度值()

表2 PTH作用不同时间RANKL mRNA和OPG mRNAp的相对灰度值()
不同字母为各时间点之间P<0.05
作用时间(h)RANKL/GAPDH OPG/GAPDH 00.376 ±0.0114A 0.804 ±0.0089A 0.502 ±0.0083B 0.514 ±0.0089B 40.566 ±0.0114C 0.300 ±0.0070C 80.710 ±0.0100D 0.234 ±0.00542 D
3 讨论
牙齿的萌出是一个复杂而且受到严密调控的过程[6],在此过程中既有牙槽骨、牙胚的组织学改变,也有牙囊前体细胞、成骨细胞、破骨细胞等细胞学的改变,并且有多种细胞因子参与,其中破骨细胞的分化、活化、牙槽骨的吸收是牙齿萌出的关键。
许多研究[7]表明牙囊前体细胞分泌的多种细胞因子可调节破骨细胞的形成和牙槽骨的吸收,其中主要有巨噬细胞集落刺激因子-1(CSF-1)、单核细胞趋化蛋白-1(MCP-1)、RANKL和OPG等。金作林等[8-9]研究表明,牙齿萌出过程中牙囊前体细胞分泌的促破骨细胞分化因子之间有相互影响和作用,如 IL-10,TNF-α,BMP-2 等。
甲状旁腺激素(PTH)是重要的钙平衡调节激素,与口腔颌面部发育和牙齿发育密切相关。现已了解PTH与破骨细胞的分化有着不可分割的作用,但破骨细胞上并无PTH受体[10],PTH主要通过成骨细胞介导的OPG-RANKL-RANK系统调节破骨细胞生成。骨保护素(OPG)是 Tsuda等[11](1997)发现的一种骨代谢因子,属于肿瘤坏死因子受体超家族中的一员,由成骨细胞-基质细胞合成,是生理性的抑制破骨细胞性骨吸收的因子。RANKL是肿瘤坏死因子受体配体超家族成员11(TNFSF 11),由317个氨基酸残基组成,属Ⅱ型跨膜蛋白,在体内以膜结合型和可溶性羧基末端两种形式存在,两种类型均可与饵受体OPG结合而失去生物学活性,OPG与RANKL之间竞争性结合是调控破骨细胞分化、增殖、凋亡以及发挥生理作用的最重要的途径。
Inaam A.Nakchbandi等[12]研究发现:牙囊前体细胞少量表达Ⅰ型PTH受体,在牙齿萌出的过程中作为靶细胞介导破骨细胞的形成。也有体外研究表明[13]PTH以剂量依赖和时间依赖方式下调胎鼠颅盖骨成骨细胞中OPG基因表达,同时上调RANKL基因的表达。牙囊是牙齿萌出不可缺少的部分,牙囊前体细胞表达OPG和RANKL,参与调节牙齿萌出时牙槽骨的吸收。本研究对体外培养的人牙囊前体细胞给予了不同浓度和不同作用时间的PTH刺激,检测RANKL和OPG mRNA的表达情况,发现PTH可下调人牙囊前体细胞OPG的表达,上调RANKL的表达,推测PTH可能在局部环境中与牙囊前体细胞和成骨细胞结合,通过反比例调节RANKL和OPG mRNA的表达,使破骨细胞前体细胞向骨吸收区域聚集,促进其融合成多核破骨细胞,引起牙槽骨吸收,参与牙齿萌出道的形成。
[1]Que BG,Wise GE.Tooth eruption molecules enhance MCP-1 gene expression in the dental follicle of the rat[J].Dev Dyn,1998,212(3):346-351.
[2]Wise GE,Lumpkin SJ,Huang H,et al.Osteoprotegerin and osteoclast differentiation factor in tooth eruption [J].J Dent Res,2000,79(12):1937-1942.
[3]Frazier-Bowers SA,Wright JT,Simmons D,et al.Primary failure of eruption and PTH1R:the importance of a genetic diagnosis for orthodontic treatment planning[J].Am J Orthod Dento-facial Orthop,2010,137(2):160.e1 -160.e7.
[4]Frazier-Bowers SA,Puranik CP,Mahaney MC,et al.The etiology of eruption disorders - further evidence of a'genetic paradigm'[J].Semin Orthod,2010,16(3):180 -185.
[5]Kelly AL,Pomarico L,de Souza IP,et al.Cessation of dental development in a child with idiopathic hypoparathyroidism:a 5-year follow-up[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2009,107(5):673-677.
[6]Wise GE.Cellular and molecular basis of tooth eruption [J].Orthod Craniofac Res,2009,12(2):67-73.
[7]Harokopakis-Hajishengallis E.Physiologic root resorption in primary teeth:molecular and histological events[J].J Oral Sci,2007,49(1):1-12.
[8]钱红,金作霖,顾泽旭,等.白细胞介素-10对体外培养人牙囊细胞集落刺激因子-1表达的影响[J].实用口腔医学杂志,2009,25(3):393-396.
[9]孙海燕,张永宽,金作霖,等.BMP-2对体外培养人牙囊细胞表达OPG和RANKL的影响[J].中国美容医学,2010,19(9):1313-1316.
[10]Houpis CH,Tosios KI,Papavasileiou D,et al.Parathyroid hormone-related peptide(PTHrP),parathyroid hormone/parathyroid hormone-related peptide receptor 1(PTHR1),and MSX1 protein are expressed in central and peripheral giant cell granulomas of the jaws[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2010,109(3):415-424.
[11]Tsuda E,Goto M,Mochizuki S,et al.Isolation of a novel cytokine from human fibroblasts that specifically inhibits osteoclastogenesis[J].Biochem Biophys Res Commun,1997,234(1):137-142.
[12]Nakchbandi IA,Weir EE,insogna KL,et al.Parathyroid hormone-related protein induces spontaneous osteoclast formation via a paracrine cascade[J].Proc Natl Acad Sci U S A,2000,97(13):7296-7300.
[13]Yao SF,Pan F,Wise GE,et al.Chronological gene expression of parathyroid hormone-related protein(PTHrP)in the stellate reticulum of the rat:implications for tooth eruption[J].Arch Oral Biol,2007,52(3):228 -232.
[14]朱显军,张学军,李蓬秋,等.国产重组人甲状旁腺素1-34联合钙尔奇D治疗原发性骨质疏松症的疗效与安全性观察[J].实用医院临床杂志,2011,8(2):120 -121.
[15]易玲娴,翁土军,苏南,等.重组人甲状旁腺激素1-34促进小鼠间充质干细胞增殖及骨向分化[J].第三军医大学学报,2011,33(3):262-265.
[16]Qin L,Raggatt LJ,Partridge NC,et al.Parathyroid hormone:a double-edged sword for bone metabolism[J].Trends Endocrinol Metab,2004,15(2):60-65.

