斜带石斑鱼转化生长因子β1(TGF-β1)基因的克隆及表达分析*
平海林,吴金英,徐胜威,胡开顺,段志刚
(中山大学生命科学学院水生经济动物研究所∥广东省水生经济动物良种繁育重点实验室,广东 广州 510275)
转化生长因子β(TGF-β)主要由巨噬细胞、成纤维细胞和血小板产生[1],能参与调节多种细胞功能,例如细胞增殖、分化、存活、迁移以及免疫细胞的活化和失活等[2]。进化研究表明,TGF-β基因相当保守,其配体、受体和与家族蛋白有关的信号分子在节肢动物中也存在,表明该基因在10亿年前就已存在[3]。哺乳动物中发现TGF-β有3种异构体:TGF-β1、2、3,其中TGF-β1在所有免疫细胞中都有所表达,并在出现各种压力和多种疾病信号后,参与细胞反应[4]。如阻断免疫细胞TGF-β1的表达,会导致疾病,并伴随慢性炎症的纤维化过程[5],寄生虫病中,TGF-β1分泌可以阻断巨噬细胞活化,并削弱它们的氧化反应[6],人类腹腔和肠道炎症疾病中,TGF-β1信号减少[7]。在免疫系统中,成熟的TGF-β1多肽是一种强有力的细胞分化调节剂和免疫抑制剂,并能下调许多细胞因子的表达。例如,TGF-β1通过Smad3信号通路抑制巨噬细胞生长[8],通过诱导TGF-β靶基因Id3抑制B细胞的增殖[9],也可以诱导结缔组织生长因子(CTGF),促使伤口上的成纤维细胞增殖[10]。
在鱼类研究中,TGF-β1序列已经从虹鳟、斑马鱼、鲤鱼、草鱼、金鱼、真鲷和海鲈中克隆得到[11-17],其功能研究报道主要如下:哺乳类重组TGF-β1可以抑制虹鳟巨噬细胞呼吸爆发活动和头肾白细胞产生巨噬细胞活化因子[18-19];可以诱导草鱼外周血液淋巴细胞的增殖,也可以阻断由植物血凝素或者脂多糖刺激引起的草鱼外周血液淋巴细胞的增殖[14];可以抑制斑马鱼卵细胞成熟,其作用的多位点包括LHR, 20β HSD 和mPR-β[12,20]。重组金鱼TGF-β1蛋白能够诱导金鱼成纤维细胞(CCL71)的增殖,对TNF-α活化巨噬细胞的硝化氧化反应有下调作用[15]。在大西洋鲑中,TGF-β1下调可导致上皮内淋巴细胞敏化性增强,不能维持正常的远端肠道黏膜的完整性[21]。
本研究通过中间片段克隆并结合RACE技术,克隆得到了斜带石斑鱼EpinepheluscoioidesTGF-β1 cDNA全长序列,并通过Realtime PCR技术检测了该基因在健康斜带石斑鱼不同组织的分布情况,还检测了用PolyI:C或ConA刺激斜带石斑鱼头肾淋巴细胞不同时间后,TGF-β1基因的表达情况。
1 材料和方法
1.1 实验鱼和样品的采集
实验用健康斜带石斑鱼,2龄,长25~30 cm,体质量约700 g,购自大亚湾水产实验中心,实验前至少暂养1周。取样时先用 MS-222(Sigma,美国)麻醉实验鱼并抽出血液,再取所需各组织样品,用液氮速冻保存,然后放于 -80 ℃冰箱备用。
1.2 TGF-β1 cDNA的克隆和测序
用常规Trizol(Invitrogen,美国)抽提法从斜带石斑鱼肾脏中提取总RNA,将总RNA用反转录试剂盒(TOYOBO,日本)反转录合成cDNA第一链,并以此作为模板利用简并引物(表1)扩增TGF-β1中间片段,然后利用特异性引物(表1)结合RACE技术得到全长TGF-β1 cDNA序列。PCR产物连接到pMD19-T 载体中(TaKaRa,日本),序列测序由华大基因公司完成。
1.3 生物信息学分析
用BLAST程序搜索基因库分析TGF-β1分子的同源性,通过DNAtools 6.0分析开放读码框和相应的氨基酸序列。多重比对通过CLUSTAL W(www.ebi.ac.uk/clustalw)来实现。通过Mega 3.1软件的N-J方法来构建进化树。
1.4 Realtime PCR分析
Realtime PCR分析所用仪器为ABI的PRISM-7900。每个实验样品设3个重复,根据TGF-β1基因序列合成定量用特异性引物(表 1),以斜带石斑鱼的β-肌动蛋白cDNA作为内参,分析TGF-β1 mRNA的表达谱。
1.5 细胞孵育和免疫刺激
实验鱼先用MS-222麻醉并抽出血液,断头后取出头肾,用RPMI-1640培养基(Invitrogen,美国)洗除表面血液,并将组织块在冰上剪碎,研磨成单细胞,过300目筛得到单细胞悬浮液。4 ℃,2 000 r/min 离心10 min,用RPMI-1640 培养基洗涤沉淀两次,去上清,加入4 mL组织培养液重悬细胞。将细胞悬液小心地铺在3 mL淋巴细胞分离液(GE Healthcare,瑞士)中,19 ℃,1 500 r/min 离心50 min,收集淋巴细胞,然后转入培养瓶中,在27 ℃,φ=5% CO2的条件下培养5 h之后除去粘附细胞,收集悬浮细胞,重新培养在六孔板中,再向培养基中加入50 μg/mL的 PolyI:C(Amersham Bio-science,美国)或10 μg/mL 的ConA(Sigma,美国),以没加刺激物的细胞做阴性对照,设2、4、8、16和24 h 5个时间段,每个条件组设3个重复。通过离心收集细胞,加入1 mL Trizol用于总RNA的提取,最后用Realtime PCR分析TGF-β1的表达情况。

表1 引物序列和用途
1.6 统计分析
统计数值采用算术平均数 ± 标准差来表示(n=3)。统计差异性用单因子方差分析中的LSD和Duncan’s检测,0.05和0.01水平用来指示差异的显著性,所有数据采用SPSS Statistics 16.0软件分析。
2 结 果
2.1 斜带石斑鱼TGF-β1 cDNA全长序列
利用中间片段非特异性扩增并结合RACE技术,克隆得到了斜带石斑鱼TGF-β1 cDNA全长序列(GenBank 登录号为GQ503351),全长为2 477 bp,5′非编码区为47 bp,3′非编码区为1 269 bp,开放读码框(Open Reading From, ORF)为1 161 bp,编码一种含386个氨基酸的多肽,包括含信号肽的前导肽和含112个氨基酸的成熟肽。在3′非编码区polyA前共有5个在细胞因子上常见的mRNA不稳定点(ATTTA)和一个多聚腺苷酸加尾信号(AATAAA)。
2.2 斜带石斑鱼TGF-β1的同源性和系统进化分析
选取的其它物种及其基因在GenBank的氨基酸序列号列举如下:斜带石斑鱼Epinepheluscoioides,ACV96791;海鲈Moronechrysops×Moronesaxatilis,AAD46997;真鲷Sparusaurata,AAN03842;虹鳟Oncorhynchusmykiss,CAA67685;斑马鱼Daniorerio,AAI62361;大西洋鲑Salmosalar,ACN11294;草鱼Ctenopharyngodonidella,ABU84814;鲤鱼Cyprinuscarpio,AAF22573;金鱼Carassiusauratus,ABU55371;蝾螈Ambystomamexicanum,ABX24523;牛Bostaurus,AAA30778;马Equuscaballus,AAD49431;猪Susscrofa,AAC83807;挪威鼠Rattusnorvegicus,AAH76380;家鼠Musmusculus,AAH13738;长尾猴Chlorocebusaethiops,AAA35369;人Homosapiens,AAH01180。
氨基酸序列比对结果显示,在前导肽区域有整合素结合位点(RGD)和KEX-Furin样蛋白酶识别位点(RKKR);成熟肽区域有36位点的脯氨酸和46位点的甘氨酸以及由9个半胱氨酸组成的典型的“cysteine knot”结构(图 1)。用MEGA3.1邻接法构建TGF-β1家族进化树结果表明,斜带石斑鱼和其他鱼类进化树在同一分支上,与海鲈亲缘关系最近,与两栖类和哺乳类亲缘关系较远(图 2)。

图1 斜带石斑鱼TGF-β1的氨基酸序列与已知的其它鱼类序列的比较
2.3 斜带石斑鱼TGF-β1的组织表达分析
Realtime PCR 结果表明,斜带石斑鱼TGF-β1基因在肾脏、头肾、脾脏、鳃、肝脏、肠道、心脏、肌肉、脑、性腺、眼各组织中均有表达,其中在肾脏中表达最高,其次是头肾和脾脏,在肌肉和眼中表达最少(图 3)。
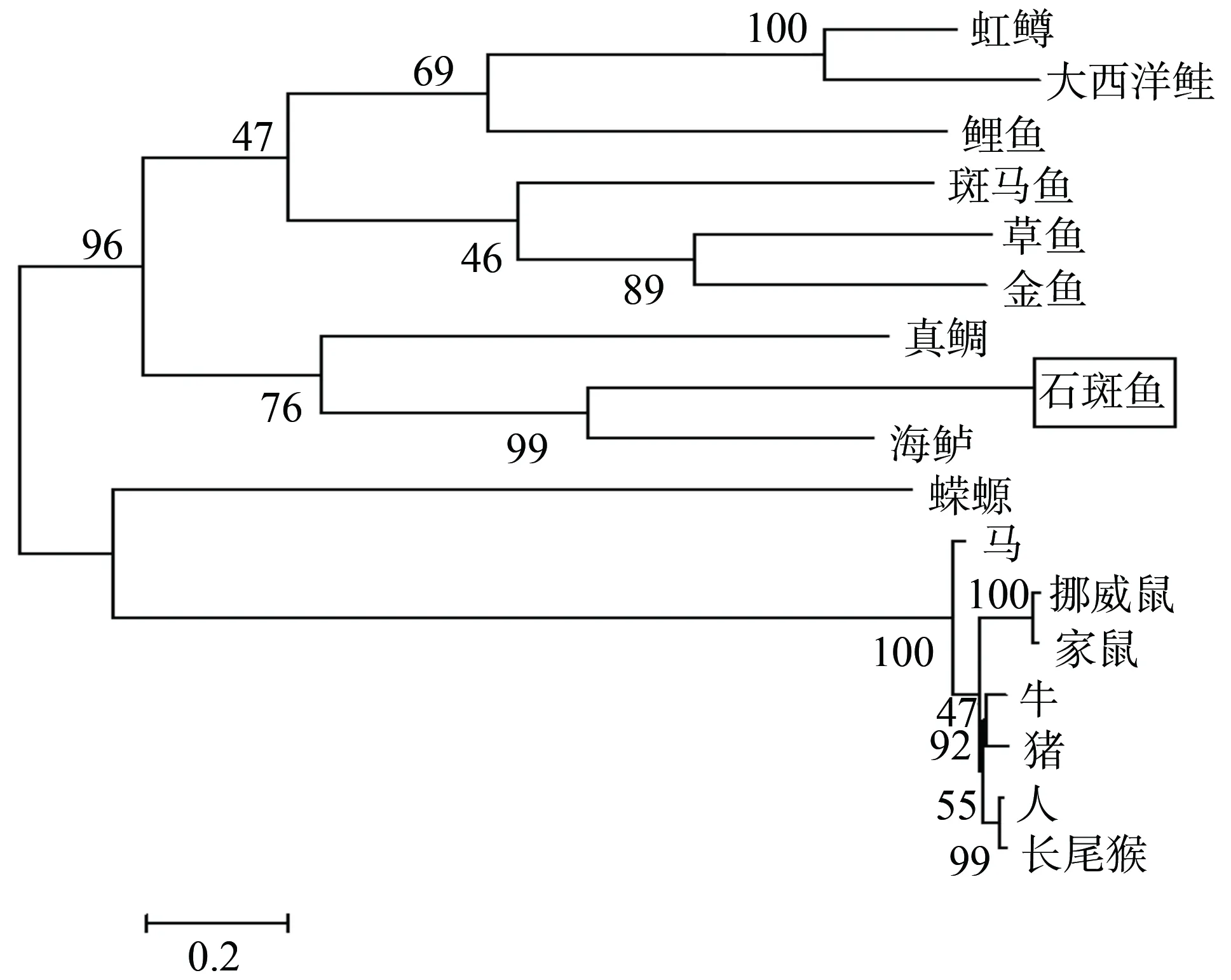
图2 斜带石斑鱼和其它动物TGF-β1氨基酸序列的系统进化数构建

图3 TGF-β1在健康斜带石斑鱼各组织中的表达分析
2.4 斜带石斑鱼TGF-β1在刺激头肾淋巴细胞中的表达分析
Realtime PCR 结果表明,用PolyI:C或ConA刺激头肾淋巴细胞后,斜带石斑鱼TGF-β1表达量都明显上升,刺激4 h后达到最高,其中ConA组是对照组表达量的27倍,PolyI:C组是对照组的3倍。刺激4 h后表达量均有所下降,其中用PolyI:C刺激头肾淋巴细胞16、24 h后,TGF-β1基本无表达,而用ConA刺激实验组,虽然在4 h后TGF-β1表达量有所下降,但一直高于对照组(P<0.05),特别在刺激4、8、16 h后,表达量显著高于对照组(P<0.01)(图 4)。

图4 斜带石斑鱼TGF-β1在刺激头肾淋巴细胞中的表达
3 讨 论
本研究克隆得到了斜带石斑鱼TGF-β1全长cDNA序列,在成熟肽区域,具有和其他鱼类一样保守的9个半胱氨酸组成的典型的“cysteine knot”结构[12,15,17,22],其中的8个半胱氨酸以成对的方式形成分子中心区的4对链内二硫键,结合第9个半胱氨酸形成链间二硫键一起形成TGF-β二聚体[11]。整合素结合位点(RGD)能够与整合素特异结合,例如能够与αvβ6特异结合,从而使潜活型的TGF-β1活化[23],KEX-Furin样蛋白酶识别位点(RKKR)可以使前体蛋白转化为成熟蛋白,另有研究显示C型胶原蛋白酶也可通过此位点裂解TGF-β前期复合物[11],以及成熟肽36位点的脯氨酸和46位点的甘氨酸,都表明斜带石斑鱼TGF-β1具有超家族特征标志[22],延续了TGF-β1基因在进化过程中的保守性。
TGF-β1基因在所取斜带石斑鱼的各个组织中都表达,而在虹鳟和草鱼中,TGF-β1基因在肝脏中检测不到表达[11,14],在鲤鱼肌肉中检测不到表达[13],表明TGF-β1在鱼类各组织中的表达具有一定差异性。在硬骨鱼类,像草鱼和斑马鱼,肾脏是主要的B细胞产生和结合位点[24];虹鳟中,发育中的B细胞在头肾中成熟,然后迁移到脾脏或者后肾的活化位点[25];脾脏是免疫球蛋白M在软骨鱼类表达的第一个站点[26],斜带石斑鱼TGF-β1基因在肾脏、头肾、脾脏中高表达,表明TGF-β1基因在斜带石斑鱼免疫系统中可能具有潜在功能。
用PolyI:C和ConA刺激斜带石斑鱼头肾淋巴细胞后,TGF-β1基因表达量升高,这与在鲤鱼头肾白细胞中观察到的结果一致[13]。另有报道表明,在金鱼和虹鳟中,用LPS和rTNF-α刺激的巨噬细胞中,TGF-β1基因表达量也上升[15,27]。因此,斜带石斑鱼TGF-β1的表达量在刺激后有所上升,表明了TGF-β1对类似有丝分裂类因子的刺激,与其它典型的细胞因子一样做出了积极反应,对淋巴细胞的活化是必不可少的[28]。在刺激超过4 h后,可能是前4 h大幅增加的TGF-β1抑制了淋巴细胞的增殖,从而使TGF-β1表达量下降,有研究报告表明,LPS和ConA可诱导鲤鱼外周血液淋巴细胞的增殖[29],而rTGF-β1可以阻断由PHA和LPS诱导的草鱼外周血液淋巴细胞的增殖[14],表明TGF-β1在调控鱼类淋巴细胞的增殖方面和哺乳类具有相似的作用,但其作用的分子机制还有待进一步研究。
TGF-β1作为一种多效应的细胞免疫因子,其功能在哺乳动物中研究较多,作用的效果取决于多项因素,如分泌的时间,浓度,受体的表达,细胞分化的周期等[30-32],但是在鱼类,对TGF-β1的功能研究还比较少,有待进一步发展和完善。
参考文献:
[1] TAKEHARA K. Growth regulation of skin fibroblast[J]. Dermatology Science, 2000, 24: 70-77.
[2] LI Ming O, SANJABI S, ROBERTSON A K, et al. Transforming growth factor-beta regulation of immune responses[J]. Annual Review Immunology, 2006, 24: 99-146.
[3] NEWFELD S J, WISOTZKEY R G, KUMAR S. Molecular evolution of a developmental pathway: phylogenetic analyses of transforming growth factor-beta family ligands, receptors and Smad signal transducers[J]. Genetics, 1999, 152: 783-795.
[4] LETTERIO J J, ROBERTS A B. TGF-beta: a critical modulator of immune cell function[J]. Clinical Immunology and Immunopathology, 1997, 84: 244-250.
[5] BORDER W A, NOBLE N A. Transforming growth factor beta in tissue fibrosis[J]. New England Journal Medicine, 1994, 331: 1286-1292.
[6] TSUNAWAKI S, SPORN M, DING A, et al. Deactivation of macrophages by transforming growth factor-beta[J]. Nature, 1988, 334: 260-262.
[7] MONTELEONE G, KUMBEROVA A, CROFT N M, et al. Blocking Smad7 restores TGF-beta1 signaling in chronic inflammatory bowel diseases[J]. Journal Clinical Investigation, 2001, 108: 601-609.
[8] WERNER F, JAIN M K, FEINBERG M W, et al. Transforming growth factor-beta1 inhibition of macrophage activation is mediated via Smad3[J]. Journal Biology Chemistry, 2000, 275: 36653-36658.
[9] KEE B L, RIVERA R R, MURRE C. Id3 inhibits B lymphocyte progenitor growth and survival in response to TGF-beta[J]. Nature Immunology, 2001, 2: 242-247.
[10] KOTHA P D, FRAZIER K S, WELPLY A, et al. Transforming growth factor beta induces anchorage-independent growth of NRK fibroblasts via a connective tissue growth factor-dependent signaling pathway[J]. Cell Growth Differentiation, 1997, 8: 61-68.
[11] HARDIE L J, LAING K J, DANIELS G D, et al. Isolation of the first piscine transforming growth factor beta gene: analysis reveals tissue specific expression and a potential regulatory sequence in rainbow trout (Oncorhynchusmykiss)[J]. Cytokine, 1998, 10: 555-563.
[12] KOHLI G, HU Siqin, PENG Chun, et al. Cloning of transforming growth factor-beta1 (TGF-beta1) and its type II receptor from zebrafish ovary and role of TGF-beta1 in oocyte maturation[J]. Endocrinology, 2003, 144: 1931-1941.
[13] ZHAN Yin, JIMMY K. Molecular isolation and characterisation of carp transforming growth factor beta 1 from activated leucocytes[J]. Fish Shellfish Immunology, 2000, 10: 309-318.
[14] YANG Mu, ZHOU Hong. Grass carp transforming growth factor-β1(TGF-β1): Molecular cloning, tissue distribution and immunobiological activity in teleost peripheral blood lymphocytes[J]. Molecular Immunology, 2008, 45: 1792-1798.
[15] GEORGE H, PATRICK C H, ELAINE C, et al. Molecular and functional characterization of goldfish (CarassiusauratusL.) transforming growth factor beta[J]. Developmental and Comparative Immunology, 2008, 32: 654-663.
[16] TAFALLA C, ARANGUREN R, SECOMBES C J, et al. Molecular characterisation of sea bream (Sparusaurata) transforming growth factor beta1[J]. Fish Shellfish Immunology, 2003, 14: 405-421.
[17] HARMS C A, HORNE W A, FULLER F J, et al. Cloning and sequencing hybrid striped bass (Moronesaxatilis×M.chrysops) transforming growth factor-beta (TGF-beta) and development of a reverse transcription quantitative competitive polymerase chain reaction(RT-qcPCR) assay to measure TGF-beta mRNA of teleost fish[J]. Fish Shellfish Immunology, 2000, 10: 61-85.
[18] JANG S I, HARDIE L J, SECOMBES C J. The effects of transforming growth factor β1 on rainbow troutOncorhynchusmykissmacrophage respiratory burst activity[J]. Developmental and Comparative Immunology, 1994, 18: 315-323.
[19] JANG S I, HARDIE L J, SECOMBES C J. Elevation of rainbow troutOncorhynchusmykissmacrophage respiratory burst activity with macrophage derived supernatants[J]. Journal of Leukocyte Biology, 1995, 57: 943-947.
[20] TAN Qian, ZAGRODNY A, PENG Chun, et al. Regulation of membrane progestin receptors in the zebrafish ovary by gonadotropin, active, TGF-β and BMP-15[J]. Molecular and Cell Endocrinology, 2009, 312: 72-79.
[21] EINAR L, MICHAEL H P, XU Cheng, et al. Decreased expression of TGF-b, GILT and T-cell markers in the early stages of soybean enteropathy in Atlantic salmon (SalmosalarL.)[J]. Fish Shellfish Immunology, 2009, 27: 65-72.
[22] DAVID W B, ANDREW S L. Evolution of the transforming growth factor-beta superfamily[J], Progress in Growth Factor Research, 1994, 5: 99-107.
[23] ANNES J, MUNGER J, RIFKIN D. Making sense of latent TGFβ activation[J]. Journal Cell Science, 2003, 116: 217-224.
[24] TOMAS B, BLEU C C. The evolutionary history of lymphoid organs[J]. Nature Immunology, 2007, 8: 131-135.
[25] ZWOLLO P, COLE S, BROMAGE E, et al. B cell heterogeneity in the teleost kidney: evidence for a maturation gradient from anterior to posterior kidney[J]. The Journal of Immunology, 2005, 174: 6608-6616.
[26] MIRACLE A L, ANDERSON M K, LITMAN R T, et al. Complex expression patterns of lymphocyte-specific genes during the development of cartilaginous fish implicate unique lymphoid tissues in generating an immune repertoire[J]. International Immunology, 2001, 13: 567-580.
[27] BRUBACHER J L, SECOMBES C J, ZOU J, et al. Constitutive and LPS-induced gene expression in a macrophage-like cell line from the rainbow trout (Oncorhynchusmykiss)[J]. Developmental and Comparative Immunology, 2000, 24: 565-574.
[28] LETTERIO J J, ROBERTS A B. Regulation of immune responses by TGF-β[J]. Annual Review of Immunology, 1998, 16: 137-161.
[29] REYNAUD S, DESCHAU X P. The effects of 3-methylcholanthrene on lymphocyte proliferation in the common carp (CyprinuscarpioL.)[J]. Toxicology, 2005, 211: 156-164.
[30] DERYNCK R, ZHANG Ye. Smad-dependent and Smad-independent pathways in TGF-beta family signaling[J]. Nature, 2003, 425: 577-584.
[31] WAHL S M. Transforming growth factor-beta: innately bipolar[J].Current Opinion in Immunology, 2007, 19: 55-62.
[32] WAHL S M, SWISHER J, CHEN W, et al. TGF-beta: the perpetrator of immune suppression by regulatory T cells and suicidal T cells[J]. Journal of Leukocyte Biology, 2004, 76: 15-24.

