毛冬青中三萜皂苷类化合物的分离(Ⅲ)*
张翠仙,林朝展,杨金燕,熊天琴,邓洁薇,韦瑀龙,赵钟祥,祝晨蔯
(广州中医药大学中药学院,广东 广州510006)
毛冬青为冬青科(Aquifoliacae)冬青属(IlexL.)植物毛冬青IlexpubescensHook. Et. Arn.的干燥根,是我国岭南地区习用中药。具有活血通脉、消肿止痛、清热解毒之功效,临床上广泛应用于治疗冠心病、心绞痛和脉管炎等疾病,疗效确切[1]。前期药理活性研究表明毛冬青总三萜皂苷具有明显降低血浆粘度的作用。在此生理活性指导下,前期对其乙醇提取物乙酸乙酯萃取部位的化学成分进行了研究[2-3]。现对其正丁醇部位进行分离,得到5个三萜皂苷化合物。经理化性质及波谱方法鉴定其结构为mussaendoside R(1)[4-5]、ziyu-glycosideⅠ(2)[6]、Lucyoside H(3)[7-9]、ilexoside A(4)[10]、ilexoside O (5)[10]。其中化合物1,2,3为首次从该植物中分离得到。

图1 从毛冬青中分离得到的化合物1,2,3,4,5结构示意图
1 结果与讨论
化合物1白色无定型粉末,φ=10%硫酸乙醇TLC于105 ℃加热显紫红色,Liebermann- Burchard和Molish反应呈阳性,表明该化合物可能为三萜皂苷类化合物。结合该化合物的1H NMR 、13C NMR及DEPT 谱(7个甲基、11个亚甲基、16个次甲基和8个季碳)得出分子C42H68O14,不饱和度9。NMR显示1具有1个孤立羧羰基[δC177.1(s)],1个双键[δC127.7(d), 138.8(s)和δH5.51(1H, brt)],除此外无任何其他不饱和信息,暗示此化合物含有7环。NMR还显示该化合物结构中具有2个连氧亚甲基[δC64.1(t), 62.2(t),δH3.81(m, 1H), 4.31(m, 1H), 4.38(m, 1H), 4.44(m, 1H) ],8个连氧次甲基[δC74.4 (d),78.9(d),71.1(d),79.2(d),74.1 (d),78.9 (d),71.1 (d),79.2 (d),δH5.03(m, 1H), 4.75(m, 2H), 4.41(m, 1H),4.29(t, 8.5,1H),4.22(t, 8.5, 1H),4.03(br d, 9.5, 1H),3.93(t, 8.5, 1H)]和1个连氧季碳[δC73.4(s),δH5.13(1H, brs, 19α-OH)]。HPLC-ESI-MSn给出m/z819 [M+Na]+,657 [M+Na-162]+暗示化合物1可能含葡萄糖。同时NMR数据显示有两个端基质子信号δC106.2 (d),95.8 (d),δH5.37 (1H, d, 8.5 Hz, 3-O-Glc- 1′-H),6.32(1H, d, 8.5 Hz, 28-O-Glc-1″-H)表明1为二糖五环三萜皂苷,且分别为醇苷和酯苷键。
将化合物1进行酸水解,糖的GLC分析结果表明,得到2个糖且均为β-D-葡萄糖。比较1苷元部分和ilexgenin B[10]的NMR数据(见表1),二者基本相同。只是C-3信号由δC78.2位移至δC88.7。向低场位移了10.5,而C-28信号由δC180.7(s)位移至177.0(s),向高场位移了3.7,表明该化合物是以ilexgenin B为苷元的三萜皂苷,其C-3羟基和C-28羧基均被苷化,形成双糖链皂苷。将化合物1的数据与mussaendoside R[4-5]对照,基本一致。确定1为mussaendoside R。该化合物系首次从该植物中分得。

表1 化合物1,2,3苷元13C NMR(125 MHz)数据(溶剂:吡啶)
化合物2白色无定型粉末,φ=10%硫酸乙醇TLC于105 ℃加热显紫红色,Liebermann-Burchard和Molish反应呈阳性。HPLC-ESI-MSnm/z1 555.5[2M+Na]+、789.5[M+Na]+,627.3[M+Na- Glc]+,667.3 [M+K-Xyl]+分别出现碎片离子峰。结合NMR及DEPT 谱数据[7个甲基、11个亚甲基、15个次甲基和8个季碳]得出分子,分子式为C41H66O13,不饱和度9。NMR显示2具有1个孤立羧羰基[δC177.1(s)],1个双键[δC127.7(d), 138.8(s)和δH5.51(1H, brt)],除此外无任何其他不饱和信息,暗示此化合物含有7环。同时NMR数据显示2有两个端基质子信号δC106.2 (d),95.8 (d),δH5.37(1H, d, 8.5 Hz,3-O-Glc-1-H),6.32(1H, d,8.5 Hz, 28-O-Glc- 1-H),结合HPLC-ESI-MSn给出1 555.5[2M+Na]+、789.5[M+Na]+,627.3[M+Na-162]+,667.3 [M+K-132]+暗示化合物2含有六碳糖和五碳糖,且为醇苷和酯苷。
比较化合物2和1的NMR数据发现二者十分相似,区别在于苷元中C-18信号由δC47.4位移至δC54.7,向低场位移了7.3。30-CH3为α构型时C-18位移值与β构型相比较[10],向低场位移(δC46.6→53.2),故从C-18位移值δC54.6可推断该化合物30-CH3为α-CH3构型。而糖部分由两个六碳糖转变为一个五碳糖和一个六碳糖。将2水解后TLC显示二糖依次为阿拉伯糖和葡萄糖。
将2波谱数据(表1和2)与文献报道的ziyu-glycosideⅠ的光谱数据对照[6],基本一致。确定2为ziyu-glycoside Ⅰ(3-O-α-L-arabinopyranosyl pomolic acid 28-O-β-D- glucopyranosyle- ster)。该化合物为首次从该植物中分离得到。
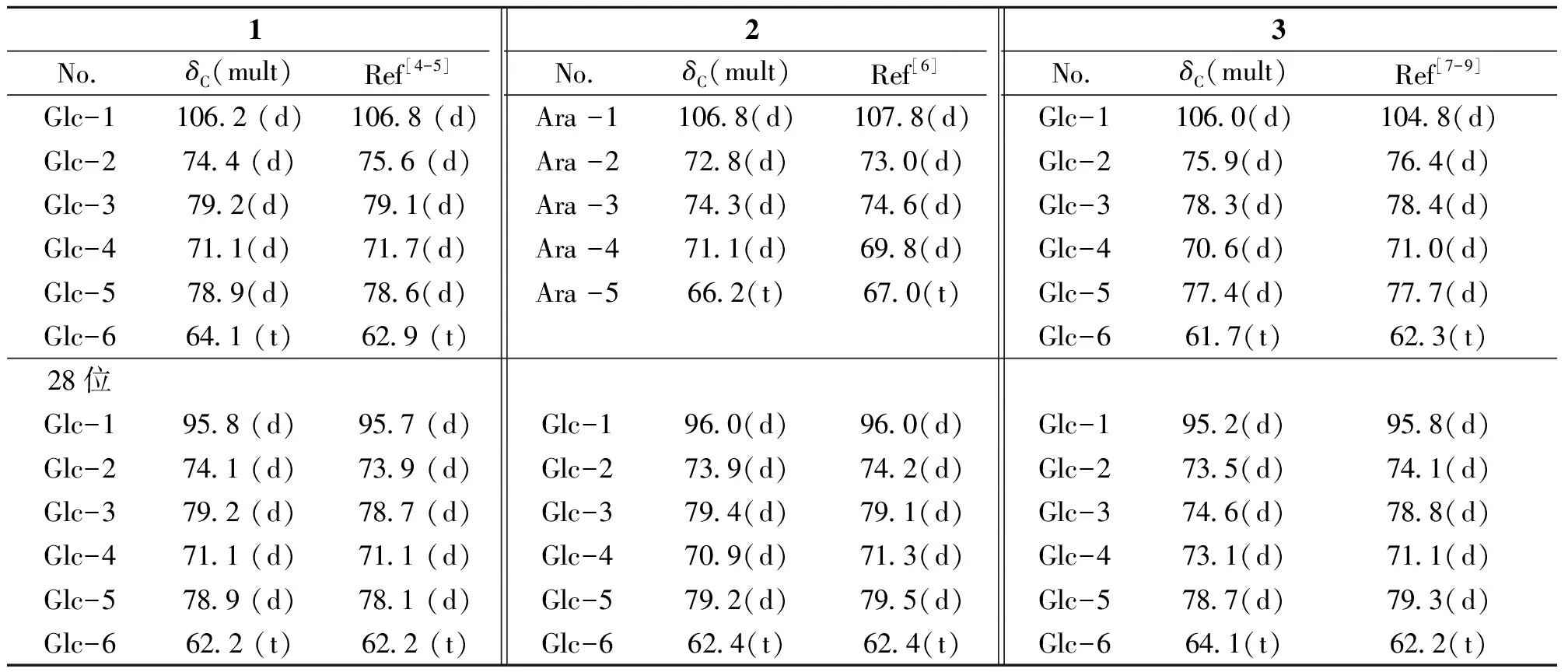
表2 化合物1,2,3糖部分13C NMR(125 MHz)数据(溶剂:吡啶)
化合物3的结构鉴定白色无定型粉末,φ=10%硫酸乙醇TLC于105 ℃加热显紫红色,Liebermann-Burchard和Molish反应呈阳性,表明该化合物可能为三萜皂苷类化合物。HPLC- ESI-MSnm/z803.2[M+Na]+结合该化合物的1H NMR 、13C NMR及DEPT谱(7个甲基、12个亚甲基、15个次甲基和8个季碳)得出分子式:C42H68O13,不饱和度9。
NMR显示3具有1个孤立羧羰基[δC175.0(s)],1个双键[δC123.2(d), 143.5(s)和δH4.74(1H, br s)],除此外无任何其他不饱和信息,暗示此化合物含有7环。同时NMR数据显示3有两个端基质子信号δC106.0 (d),95.2 (d),δH5.37(1H, d, 8.5 Hz,3-O-Glc-1′-H),6.33(1H, d, 8.0 Hz, 28-O-Glc-1″-H),结合HPLC-ESI-MSn给出803.2[M+Na]+,641.2[M+Na- 162]+暗示化合物3含有六碳糖和五碳糖,且为醇苷和酯苷。
比较化合物3和1的NMR数据,发现二者十分相似,只是苷元部分在1H NMR的高场区7个甲基全部为单峰质子信号[δH0.82 (s, 1H),0.91(s, 1H),0.95(s, 1H),0.96(s, 1H),1.10(s, 1H),1.27(s, 1H)和1.30(s, 1H)];且13C NMR中减少一个连氧季碳[73.4(s)]信号。将化合物3进行酸水解,糖的GLC分析结果表明,得到两个糖且均为β-D-葡萄糖。将3与Lucyoside H的NMR数据对照,基本一致。确定3为Lucyoside H[7-9],即齐墩果酸-3-O-β-D-吡喃葡萄糖-28-O-β-D-吡喃葡萄糖苷。该化合物系首次从该植物中分得。
2 实验部分
2.1 仪器、试剂及药材
北京泰克光学仪器厂X-6型熔点仪;美国Finnigan公司LCQDECAXP高效液相色谱-质谱联用仪;瑞士Bruker公司 AVANCE AV 400超导核磁共振仪。层析硅胶(200~300目)为青岛海洋化工厂产品;溶剂和试剂均为广州化学试剂厂分析纯。
实验药材购自广州致信中药饮片有限公司,经广州中医药大学中药学院祝晨蔯研究员鉴定为冬青科植物毛冬青IlexpubescensHook. Et. Arn.的干燥根,样品保存于广州中医药大学中药学院中药质量分析研究室(编号MDQ2001-1)。
2.2 提取与分离
毛冬青根(10 kg),粉碎,用乙醇(φ=70%,30 L)于室温下浸提5次。将提取液合并,减压浓缩得棕褐色黏稠膏状物(1.6 kg)。浸膏加水分散后依次用乙酸乙酯、正丁醇分配萃取,萃取液减压浓缩,正丁醇部位得到棕褐色浸膏(400 g)。正丁醇部位(140 g)分两次上D101大孔吸附树脂,依次用水、φ=30%、φ=60%、φ=95%乙醇洗脱,TLC跟踪。从φ=60%洗脱部分,经反复硅胶柱层析、ODS柱层析、Sephadex LH-20柱层析等方法分离纯化得到化合物5(69 mg),4(70 mg),2(85 mg),3(68 mg),1(27 mg)。
2.3 化合物的酸水解
化合物(5 mg)用φ=9%HCl水溶液在90 ℃条件下水解5 h,反应结束后冷却,反应液直接用HPLC检测,与标准D-木糖、D-葡萄糖和L-鼠李糖对照。
2.4 化合物的物理常数和波谱数据
化合物1:白色无定型粉末,TLC,φ=10%硫酸乙醇105 ℃加热显紫红色,Liebermann- Burchard和Molish反应呈阳性。1H NMR δH(Pyr-d5): 6.32(1H, d, 8.5), 5.51(1H, brt), 5.37 (1H, d, 8.5), 5.13(1H, brs);δH3.81(m, 1H), 4.31(m, 1H), 4.38(m, 1H), 4.44(m, 1H);δH5.03(m, 1H), 4.75(m, 2H), 4.41(m, 1H),4.29(t, 8.5,1H),4.22(t, 8.5,1H),4.03(br d, 9.5,1H),3.93(t, 8.5,1H),3.23(1H, t, 12), 3.17(1H, s), 3.17(m, 1H), 2.60 (t, 9.0, 1H), 2.46 (t, 9.0, 1H), 1.73(3H, s), 1.42 (3H, s), 1.17 (3H, s), 1.15(3H, s), 0.98 (3H, d, 7), 0.93 (3H, s), 0.87 (3H, s), 0.74 (d, 9.0, 1H)。13C NMRδC(Pyr-d5)见表1和表2; HPLC-ESI-MSnm/z819 [M+Na]+, 657 [M+Na-162]+。
化合物2:白色无定型粉末,TLC,φ=10%硫酸乙醇105 ℃加热显紫红色,Liebermann- Burchard和Molish反应呈阳性。1H NMR,δH(Pyr-d5): 6.35(1H, d, 7.5),5.52(1H, brs), 5.08(1H, brs), 4.77(1H, d, 6.8), 4.37(m, 1H), 4.36(m, 1H), 4.34(m, 1H), 4.08(m, 1H), 3.73(m, 1H), 3.22(1H, m), 3.20(1H, s), 1.27(3H, s), 1.21(3H, s), 0.98(3H, s), 0.92(3H, s), 0.82(1H, brd, 9.6), 1.70(3H, s), 1.43(3H, s), 1.01(3H, d, 7.2);13C NMRδC(Pyr-d5)见表1和表2; HPLC-ESI-MSnm/z1 555.5[2M+Na]+, 789.5[M+ Na]+, 627.3[M+Na-Glc]+, 667.3 [M+K-Xyl]+。
化合物3:白色无定型粉末,φ=10%硫酸乙醇 TLC于105 ℃加热显紫红色,Liebermann- Burchard和Molish反应呈阳性;1H NMRδH(Pyr-d5): 5.37 (1H, d, 8.5 Hz, 3-O-Glc-1′-H), 6.33 (1H, d, 8.0 Hz, 28-O-Glc-1″-H), 4.74(1H, br s), 0.82 (s, 1H),0.91(s, 1H),0.95(s, 1H),0.96(s, 1H),1.10(s, 1H),1.27(s, 1H)和1.30(s, 1H);13C NMRδC(Pyr-d5)见表1和表2; HPLC-ESI -MSn,m/z: 803.2[M+Na]+。
化合物4:白色无定型粉末,TLC,φ=10%硫酸乙醇105 ℃加热显紫红色,Liebermann- Burchard和Molish反应呈阳性。1H NMR,δH(Pyr-d5): 6.35(1H, d, 7.8), 5.52(1H, brs), 5.10(1H, brs), 4.83(1H, d, 7.5), 3.36(1H, dd, 12.0, 3.6), 3.20(1H, s), 0.84(br d, 5.0) , 1.75(3H, s), 1.42(3H, s), 1.31(3H, s), 1.10(3H, s), 1.00(3H,d, 7.2), 0.94 (3H, s), 1.03(3H, s);13C NMRδC(Pyr-d5): 38.9(t, C-1), 26.8(t, C-1), 88.7 (d, C-2), 39.6(s, C-3), 55.9(d, C-4), 18.7(t, C-5), 33.5(t, C-6), 40.4(s, C-7), 47.8(d, C-8), 37.0 (s, C-9), 24.7(t, C-10), 127.6 (d, C-11), 138.8 (s, C-12), 42.1(s, C-13), 29.2 (t, C-14), 26.8(t, C-15), 48.3(s, C-16), 47.2(d, C-17), 73.4(s, C-19), 42.8(d, C-20), 24.0 (t, C-21), 31.8(t, C-22), 28.2(q, C-23), 15.6(q, C-24), 16.0 (q, C-25), 17.5(q, C-26), 24.3(q, C-27), 177.0(s, C-28), 29.7 (q, C-29), 16.9(q, C-30), 107.6(d, C-1′), 75.5(d, C-2′), 78.6(d, C-3′), 71.2(d, C-4′), 67.1(d, C-5′), 95.8(d, C-1″), 74.1(d, C-2″), 79.2(d, C-3″), 71.1(d, C-4″), 78.9(d, C-5″), 62.2(d, C-6″); HPLC-ESI-MSnm/z: 1 555.5[2M+Na]+, 789.5[M+ Na]+, 805.3[M+ K], 627.3[M+Na-Glc]+, 643.3[M+K -Glc]+和511.5[M+K-Glc-Xyl]+。
化合物5: 白色无定型粉末,TLC,φ=10%硫酸乙醇105 ℃加热显紫红色,Liebermann- Burchard和Molish反应呈阳性。1H NMRδH(Pyr-d5): 6.39(1H, s), 6.32(1H, d, 8.0), 5.79(1H, d, 7.6), 5.49(1H, brs), 5.08 (1H, brs), 5.04(m, 3H), 4.88(1H, d, 6.8), 4.77(dd, 3.4, 1.2, 1H), 4.69(dd, 9.2, 3.2, 1H), 4.39~4.51(m, H), 4.26~4.36(m, H), 4.11(m, H), 4.08(m, H), 4.06(m, H), 3.88(m, 1H), 3.72(t, 11.8, 1H), 3.62(s, 1H), 3.26 (1H, dd, 11.6, 4.4), 3.17(1H, s), 2.62(tt, 12.0, 4.5, 1H), 2.48(td, 12.0, 4, 1H), 1.77(3H, d, 6.4), 1.70(3H, s), 1.37(3H, s), 1.32(3H, s), 1.10(3H, s), 1.08(3H, s), 0.97(3H, d, 7.2), 0.88(3H, s), 0.84(1H, brd, 11.6);13C NMRδC(Pyr-d5): 38.6(t, C-1), 26.6(t, C-2), 89.4(d, C-3), 39.5(s, C-4), 55.8(d, C-5), 18.5(t, C-6), 33.3(t, C-7), 40.2(s, C-8), 47.5(d, C-9), 36.8(s, C-10), 24.5(t, C-11), 127. 4(d, C-12), 138.6(s, C-13), 41.9(s, C-14), 29.0(t, C-15), 26.4(t, C-16), 48.1(s, C-17), 47.0(d, C-18), 73.2(s, C-19), 42.6(d, C-20), 23.8(t, C-21), 31.6(t, C-22), 28.2(q, C-23), 15.4(q, C-24), 15.8(q, C-25), 17.3(q, C-26), 24.1(q, C-27), 176.8(s, C-28), 29.5(q, C-29), 16.5(q, C-30), 105.5(d, C-1′), 79.2(d, C-2′), 77.6(d, C-3′), 71.0(d, C-4′), 66.4(t, C-5′), 102.1(d, C-1″), 79.1(d, C-2″), 79.0(d, C-3″), 72.44(d, C-4″), 78.8(d, C-5″), 63.1(t, C-6″), 101.8(d, C-1‴), 71.1(d, C-2‴), 72.4(d, C-3‴), 74.1(d, C-4‴), 69.3(d, C-5‴), 18.8(q, C-6‴), 95.6(d, C-1″″), 73.9(d, C-2″″), 78.8(d, C-3″″), 70.9(d, C-4″″), 78.2(d, C-5″″), 63.2(t, C-6″″); HPLC-ESI-MSnm/z:1 097.6[M+Na]+, 1 113.2[M+K]+, 935.4[M+Na-Glc]+, 951.2[M+K-Glc]+, 967.3[M+K-Rha]+, 789.4[M+Na-Glc-Rha]+, 627.2 [M+Na-Glc-Rha-Glc]+, 477.1[M+Na-Glc- Rha -Glc-Xyl]+。
参考文献:
[1] LIU L, WANG J R, ZHOU H, et al. Saponins derived fromIlexpubescensand method of purifying the same [P]. CODEN: USXXCO US 2008119420 A1,2008.
[2] 张翠仙, 杨金燕, 林朝展, 等. 毛冬青中三萜皂苷类化合物的NMR归属 [J]. 中山大学学报:自然科学版, 2009, 48(1):42-45.
[3] 杨金燕, 张翠仙, 赵钟祥, 等. 毛冬青中三萜类化合物的分离和归属[J]. 天然产物研究与开发, 2009, 21(增刊):17.
[4] ZHAO W M, XU J P, QIN G W, et al., Saponins fromMussaendapubescens[J]. Phytochem, 1995, 39(1): 191-193
[5] 李维林, 吴菊兰, 任冰如, 等. 枸骨的化学成分[J]. 植物资源与环境学报, 2003, 12(2): 1- 5.
[6] TAKETA A T C, BREITMAIER E, SCHENKEL E P. Triterpenes and triterpenoidal glycosides from the fruits ofIlexparaguarinensis(Maté)[J]. J Braz Chem Soc, 2004, 15(2): 205.
[7] DU Q Z, GAO S J. Preparative separation of saponins from theLuffaCylindeica(L.) Roem. by slow rotary countercurrent chromatography[J]. J Liq Chroma & Related Tec, 2006,29(16): 2451-2456.
[8] LIANG L, LIU C, LI G, et al. Studies on the chemical structure of lucyoside R from leaves ofLuffacylindricaRoem[J]. Acta Pharm Sin, 1997, 32 (10): 42-45.
[9] 杨国宏, 周建, 马兴元, 等. 辽东樬木叶中苷类成分的化学研究[J]. 中草药,1995,26(10): 514-517.
[10] HIDAKA K, ITO M, MATSUDA Y, et al. New trierpene saponins fromIlexpubescens[J]. Chem Pharm Bull,1987, 35(2): 524.

