不同贮藏性青花菜花球的抗氧化特性
李进才 , 赵习姮
(1. 天津大学化工学院,天津 300072;2. 天津大学农业与生物工程学院,天津 300072)
青花菜(Brassica oleracea L.Var.italica)花球采后易黄花衰老,品质下降较快,衰老速度不仅与流通、贮藏环境条件有关,品种本身所具有的贮藏性也有较大影响.采后青花菜花球的衰老与绿色花球细胞内活性氧超氧阴离子(O2-)和过氧化氢(H2O2)等造成的氧化伤害有关.同时与消除活性氧的抗氧化特性有密切联系:在采后青花菜不同贮藏温度[1-2]、包装方式[2]、化学物质[3-4]及冷热激处理[5]等保鲜研究中都观测到,在衰老速度发生变化时,伴随有抗氧化酶活性和抗氧化物质含量的变化.
不同青花菜品种,采后花球的衰老速度有一定差异,即花球的贮藏性不同.研究青花菜花球的抗氧化特性与贮藏性的关系,可以为青花菜耐贮藏品种选育、保鲜技术研究等提供重要基础理论信息.为此,笔者选取耐贮藏性不同的春季栽培 2个品种和秋季栽培 2个品种,将采后花球贮藏于 20,℃条件下,在贮藏开始时和 4,d后,测定了花球呼吸速率、衰老生理指标(叶绿素、蛋白质和丙二醛(MDA)含量)和抗氧化特性指标(O2-)和H2O2含量,抗氧化酶超氧化物岐化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化氢酶(APX)活性,抗氧化物质抗坏血酸(AsA)和β-胡萝卜素(β-Car)含量).
1 材料与方法
1.1 供试材料
供试青花菜品种在前期贮藏性试验选定,春季栽培 6月下旬采收“绿颜”(Green face)和“城堡”(Castle),秋季栽培 11月下旬采收“爱国者”(Patriot)和“高地”(Heights),采收基准为所有花蕾清晰可见,无花蕾开放.
1.2 呼吸速率测定
每个青花菜品种供试6个花球,采收后贮藏于20,℃恒温条件下.贮藏3 h后(作为贮藏开始时)每个品种取3个花球分别称重后放入温度20,℃、容积1,L的密封容器中,每30,min抽取密封容器中气体0.2,mL,用气相色谱仪(DFM-1000,Shimadzu)测定0~90,min的CO2浓度,据30,min间隔的CO2浓度差算出呼吸速率.测定条件为 TCD型检测器,Porapak Q和Molecular sieve组合色谱柱,柱温80,℃,氦气流量80,mL/min.贮藏4,d后,再次测定花球呼吸速率.
1.3 花蕾取样
每次测定呼吸速率后,迅速进行花蕾取样,每个样品 2,g,低温-80,℃保存,用于衰老生理指标和抗氧化特性指标测定.
1.4 衰老生理指标测定
叶绿素含量测定采用丙酮分光光度比色法,蛋白质含量测定采用 Folin-酚试剂法,MDA含量测定用硫代巴比妥酸法.
1.5 抗氧化特性指标测定
O2¯定量采用 Li等[6]的方法,H2O2定量采用Okuda等[7]的方法.SOD活性测定采用氮蓝四唑光还原法,CAT、POD和 APX活性测定分别采用 Zhang等[5]、Kochba等[8]和 Nakano等[9]的方法.AsA 定量采用2,6-二氯酚靛酚还原滴定法.β-Car定量采用液相色谱法,用 80%丙酮磨碎抽出后,加乙醚和水萃取,萃取液在暗处吹气态氮蒸发除去有机溶剂后,加乙醚 1,mL溶解,用于液相色谱分析.液相色谱仪系统为 L-6200泵和 L-4200 UV-VIS检测仪,采用Kaseisorb LC ODS-120-5(4.6,mm×250,mm)色谱柱,柱温 30,℃,检出液 5.0,μL,移动相为 50%乙酸乙酯、10%乙腈和 40%甲醇的混合溶液(均为体积分数),流速0.7,mL/min,检出波长450,nm.
1.6 数据分析
以上指标均重复测定3次,用Excel 2000软件进行数据分析,以“平均值±标准偏差”表示,用 t-检验法进行差异显著性检验.
2 结果与分析
2.1 呼吸速率及衰老生理指标
采后青花菜花球,随着呼吸代谢的不断进行,绿色花球逐渐黄花衰老,品质持续下降.20,℃贮藏开始时的花球呼吸速率,春季栽培的“绿颜”低于“城堡”,秋季栽培的“爱国者”低于“高地”,贮藏4,d后也具有相同趋势.贮藏开始时,花球衰老生理指标叶绿素、蛋白质和MDA含量在“绿颜”与“城堡”、“爱国者”与“高地”之间均无显著差异;但贮藏 4,d后,叶绿素和蛋白质含量是“绿颜”高于“城堡”、“爱国者”高于“高地”,MDA含量是“绿颜”低于“城堡”、“爱国者”低于“高地”(见表 1).这些结果表明:青花菜花球与一般果蔬一样,具有呼吸速率较低、衰老慢、耐贮藏的生理特性,“绿颜”比“城堡”衰老慢,耐贮藏,“爱国者”比“高地”衰老慢,耐贮藏.
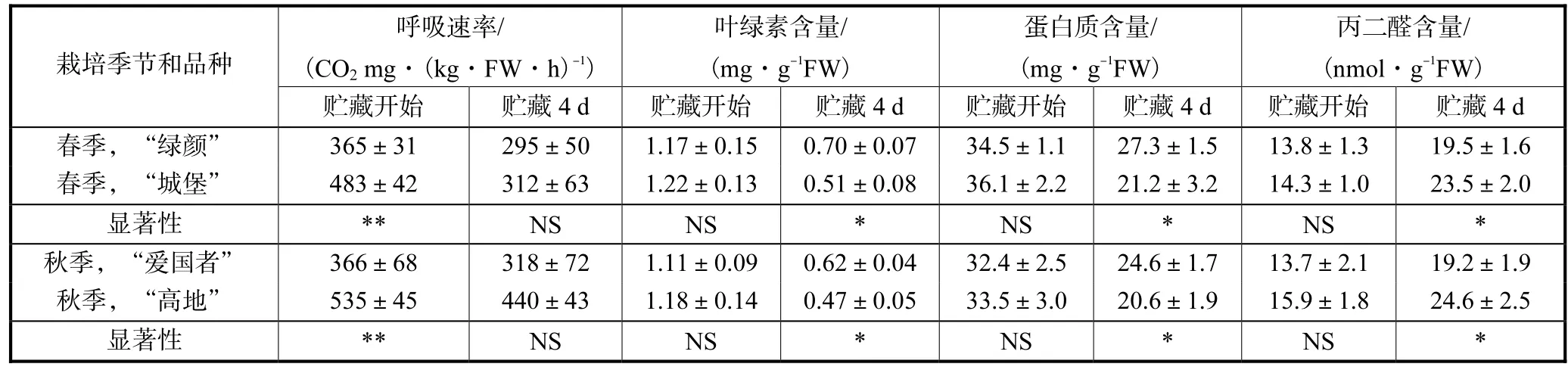
表1 不同贮藏性青花菜花球在20 ℃贮藏条件下的呼吸速率、叶绿素、蛋白质和丙二醛含量Tab.1 Respiratory rate and contents of chlorophyll,protein and malondialdehyde of broccoli floret cultivars with different storability at 20 ℃
2.2 活性氧含量
采后青花菜花球的生理代谢仍在不断进行;但由于离开了母体植株,花球生理代谢需要的水分和养分只能来源于肥大花茎;供不应求造成的水分和养分胁迫,会造成活性氧的大量发生与累积,使花球受到氧化胁迫.贮藏开始时,花球的O2¯和H2O2含量是“绿颜”低于“城堡”、“爱国者”低于“高地”,贮藏4,d后也具有相同趋势(见表 2):表明耐贮藏品种花球受到的氧化胁迫程度较低.
2.3 抗氧化酶活性
在植物细胞内,SOD可歧化O2¯为H2O2和H2O,CAT可将H2O2分解为O2和H2O,POD和APX可以酶促 H2O2还原为 H2O,这些抗氧化酶的活性越大,消除活性氧效率越高[10].贮藏开始时,花球的 SOD、CAT、POD和APX 活性均是“绿颜”小于“城堡”、“爱国者”小于“高地”;贮藏期间,SOD、CAT和POD活性的上升幅度均是“绿颜”大于“城堡”、“爱国者”大于“高地”,APX活性的下降幅度是“绿颜”小于“城堡”、“爱国者”小于“高地”;贮藏4,d后,POD活性仍是“绿颜”小于“城堡”,“爱国者”小于“高地”(见表 3).耐贮藏品种的抗氧化酶活性,贮藏开始时虽然较低,但贮藏期间 SOD、CAT和POD活性较大幅度的上升,可以有效地提高消除活性氧效率, APX活性小幅下降也有利于消除活性氧.
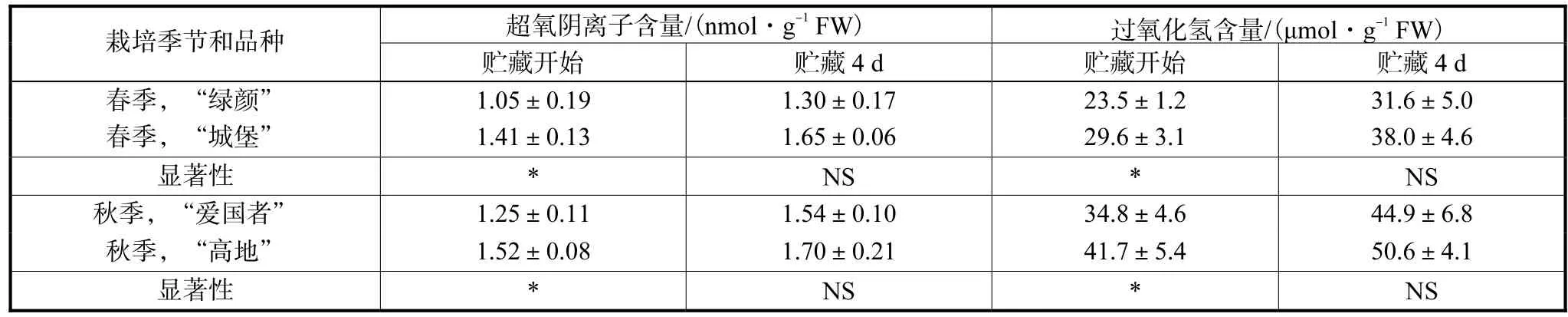
表2 不同贮藏性青花菜花球在20 ℃贮藏条件下的超氧阴离子和过氧化氢含量Tab.2 Superoxide anion and hydrogen peroxide contents of broccoli floret cultivars with different storability at 20 ℃
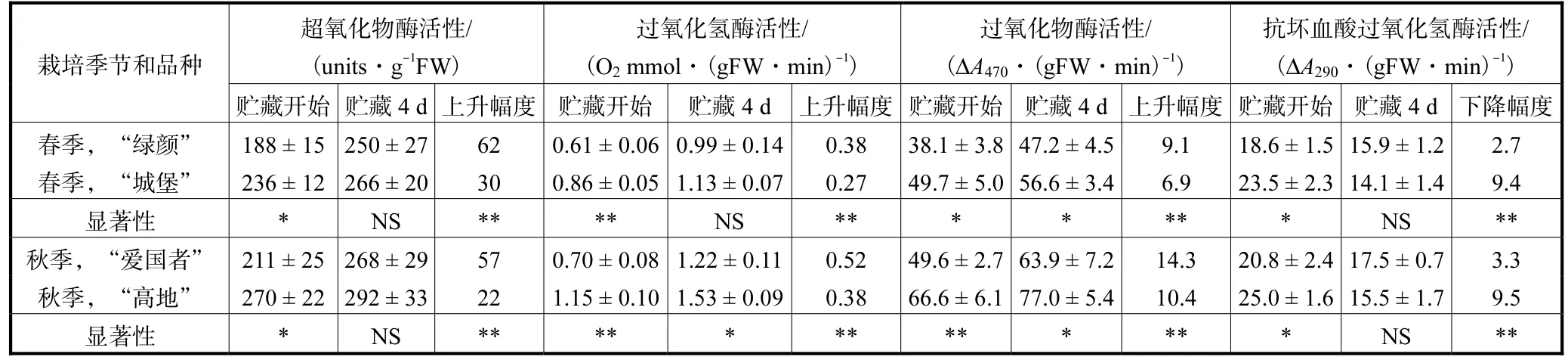
表3 不同贮藏性青花菜花球在20 ℃贮藏条件下的超氧化物酶、过氧化氢酶、过氧化物酶和抗坏血酸过氧化氢酶活性Tab.3 Activities of superoxide dismutase,catalase,peroxidase and ascorbate peroxidase of broccoli floret cultivars with different storability at 20 ℃
2.4 抗氧化物质含量
抗氧化物质 AsA、β-Car等对消除植物细胞内的活性氧也具有重要作用[10-11].贮藏开始时,花球的AsA 和β-Car含量在“绿颜”与“城堡”、“爱国者”与“高地”之间没有显著差异,但贮藏4 d后,“绿颜”高于“城堡”、“爱国者”高于“高地”,贮藏期间AsA和β-Car含量的下降幅度是“绿颜”小于“城堡”、“爱国者”小于“高地”(见表4).
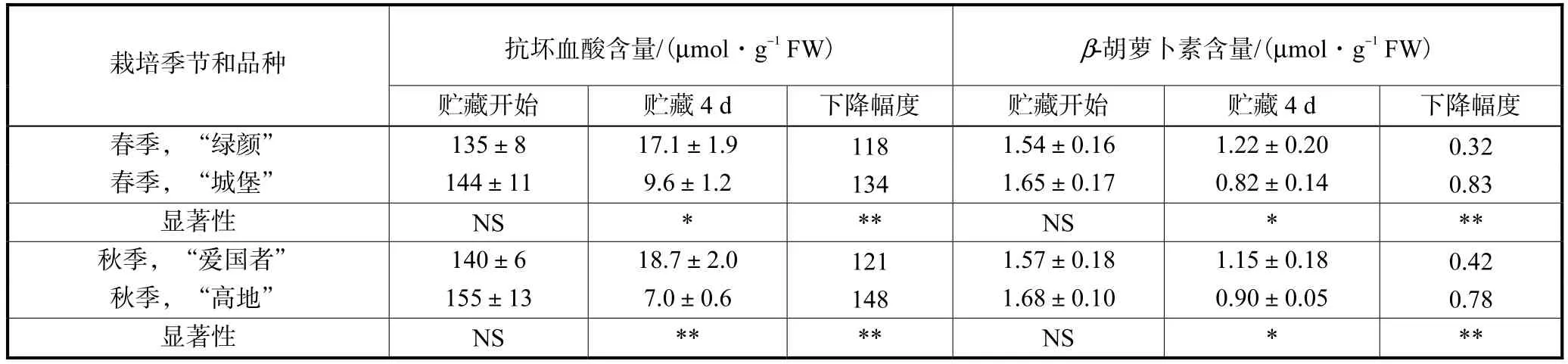
表4 不同贮藏性青花菜花球在20 ℃贮藏条件下的抗坏血酸和β-胡萝卜素含量Tab.4 Ascorbic acid and β-carotene contents of broccoli floret cultivars with different storability at 20 ℃
3 讨 论
3.1 活性氧与贮藏性
在植物细胞内,活性氧 O2¯ 和 H2O2可以和多种化合物进行氧化反应,还可以通过 Haber-Weiss、Fenton反应形成氧化性更高的羟自由基(·OH);过量的活性氧会氧化伤害生物大分子叶绿素、蛋白质及膜脂质等,加速细胞衰老[11].MDA 为膜脂质过氧化反应的终产物,MDA积累越多表明细胞衰老程度越高.在 20,℃贮藏 4,d期间,与不耐贮藏的品种“城堡”和“高地”比较,“绿颜”和“爱国者”由叶绿素、蛋白质含量下降幅度较小和MDA含量增加幅度较小(见表 1)表现出的耐贮藏性,可能与其活性氧含量低(见表 2)而受到的氧化伤害少有密切关系.同绿色青花菜花球类似,植物叶片的衰老与活性氧的形成和累积也密切相关,O2·¯ 和 H2O2含量多的叶片,叶绿素含量少,MDA积累多[12-13].
3.2 抗氧化酶与贮藏性
植物细胞在受到一定程度的氧化胁迫时,抗氧化酶会因受到较多活性氧诱导,活性上升,以提高自身的消除活性氧效率,抵御氧化胁迫[1].贮藏开始时,不耐贮藏品种“城堡”和“高地”的抗氧化酶SOD、CAT、POD 和 APX 活性高于耐贮藏品种“绿颜”和“爱国者”(见表 3)的原因,可能是由于活性氧含量较高(见表 2),受到了较高程度的氧化胁迫诱导.耐贮藏品种的抗氧化酶活性虽然较低,由于活性氧的生成和累积较少,叶绿素、蛋白质及膜脂质等受到的氧化伤害少(见表 1).这种青花菜花球在贮藏开始时(采收时)抗氧化酶活性较低,可以说是耐贮藏品种的一个抗氧化特性.
贮藏期间,SOD、CAT和POD活性的上升幅度,耐贮藏品种“绿颜”和“爱国者”大于不耐贮藏品种“城堡”和“高地”(见表 3).Zhang等[5]也报道,冷热激处理后的青花菜花球,衰老延缓,抗氧化酶活性上升幅度较大.类似的研究报道还有,抗低温黄瓜品种,低温下抗氧化酶活性上升幅度大于不抗低温品种[14];干旱驯化后的小麦,干旱胁迫时抗氧化酶活性上升幅度大于未经干旱驯化的小麦[15].青花菜花球在贮藏期间抗氧化酶活性较大幅度的上升,有效提高了其消除活性氧效率,是耐贮藏品种的又一个抗氧化特性.
APX酶促H2O2的还原反应是以AsA为电子供体,APX 活性与 AsA 含量有密切关系[11].采后青花菜花球在AsA含量减少的同时,伴随有APX活性下降[1],在乙醇保鲜处理研究中也观测到 AsA 含量高的处理,APX 活性较大[3].贮藏期间,耐贮藏品种“绿颜”和“爱国者”的APX活性下降幅度小于不耐贮藏品种“城堡”和“高地”(见表 3),可能也是依赖于耐贮藏品种较高的 AsA 含量(见表 4).这种在贮藏期间花球 APX活性下降幅度较小,也是青花菜耐贮藏品种的一个抗氧化特性.
3.3 抗氧化物质与贮藏性
植物细胞内的抗氧化物质 AsA、β-Car等也可以消除活性氧,AsA可以捕捉活性氧,抑制膜脂质的过氧化,β-Car能抑制活性氧发生,消除叶绿体内的高氧化性单线态氧(1O2)[10-11].青花菜花球的抗氧化物质 AsA 和β-Car含量较高,但采后合成很少[1,3-4].贮藏期间花球AsA和β-Car含量的下降幅度,耐贮藏品种“绿颜”和“爱国者”小于不耐贮藏品种“城堡”和“高地”(见表 4),说明耐贮藏品种花球在贮藏期间抗氧化物质的损耗较慢,较高的消除活性氧效率维持时间较长,这是青花菜耐贮藏品种的另一个抗氧化特性.
4 结 语
耐贮藏青花菜品种与不耐贮藏品种比较,采后花球衰老慢,采收时抗氧化酶活性低,20,℃贮藏 4,d期间,SOD、CAT和 POD 活性的上升幅度大,APX 活性和 AsA、β-Car含量下降幅度小.这些抗氧化特性可作为青花菜耐贮藏品种选育的育种生理指标及贮藏、流通管理的监测生理指标进行应用.在采后青花菜利用低温、薄膜等方法抑制呼吸的同时,如能结合利用抗氧化特性,保鲜效果会更好.
[1] 李進才,前澤重禮,中野浩平. 異なる貯蔵温度下におけるブロッコリ ー 花らいの抗酸化酵素活性および抗酸化物質含量と老化との関係[J]. 園芸学学会雑誌,2004,73(4):399-403.Li Jincai,Maezawa Shigenori,Nakano Kohei. Correlations between antioxidative enzyme activities and antioxidative substrates and senescence in broccoli (Brassica oleracea L. )flower buds at different storage temperatures[J]. Journal of the Japanese Society for Horticultural Science,2004,73(4):399-403(in Japanese).
[2] Starzyńska A,Leja M,Mareczek A. Physiological changes in the antioxidant system of broccoli flower buds senescing during short-term storage,related to temperature and packaging[J]. Plant Science,2003,165(6):1387-1395.
[3] Mori T,Terai H,Yamauchi N,et al. Effects of postharvest ethanol vapor treatment on the ascorbateglutathione cycle in broccoli florets[J]. Postharvest Biology and Technology,2009,52(1):134-136.
[4] Yuan Gaofeng,Sun Bo,Yuan Jing,et al. Effect of 1-methylcyclopropene on shelf life,visual quality,antioxidant enzymes and health-promoting compounds in broccoli florets[J]. Food Chemistry,2010,118(3):774-781.
[5] Zhang Zi,Nakano Kohei,Maezawa Shigenori. Comparison of the antioxidant enzymes of broccoli after cold or heat shock treatment at different storage temperatures[J]. Postharvest Biology and Technology,2009,54(2):101-105.
[6] 李 進 才 ,前澤 重 禮 ,中野浩平. 亜硝酸法による植物組組内 のスー パ ー オ キシドの簡 便定量法[J]. 園芸学研究,2002,1(4):279-282.Li Jincai,Maezawa Shigenori,Nakano Kohei. Determination of superoxide by nitrite ion method[J]. Horticultural Research,2002,1(4):279-282 (in Japanese).
[7] Okuda T,Matusda Y,Yamanaka A,et al. An abrupt increase in the level of hydrogen peroxide in leaves of winter wheat is caused by cold treatment[J]. Plant Physiology,1991,97(3):1265-1267.
[8] Kochba J,Lavee S,Spiegel-Roy P. Differences in peroxidase activity and isoenzymes in embryogenic and nonembryogenic “Shamouti” orange ovular callus lines[J].Plant Cell Physiology,1977,18(2):463-467.
[9] Nakano Y,Asada K. Hydrogen peroxide is scavenged by ascobate-specific peroxidase in spinach chloroplast[J]. Plant Cell Physiology,1981,22(5):867-880.
[10] Mittler R. Oxidative stress,antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7(9):405-410.
[11] Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions[J]. Plant Physiology,2006,141(2):391-396.
[12] Guo Yanping,Zhou Huifen,Zhang Liangcheng. Photosynthetic characteristics and protective mechanisms against photooxidation during high temperature stress in two citrus species[J]. Scientia Horticulturae,2006,108(3):260-267.
[13] Xu Sheng,Li Jianlong,Zhang Xinguan,et al. Effects of heat acclimation pretreatment on changes of membrane lipid peroxida-tion,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J]. Environmental and Experimental Bot-any,2006,56(3):274-285.
[14] Shen W,Nada K,Tachibana S. Effect of cold treatment on enzymic and nonenzymic antioxidant activities in leaves of chilling-tolerant and chilling-senstive cucumber(Cucumis sativus L.)cultivars[J]. Journal of the Japanese Society for Horticultural Science,1999,68(5):967-973.
[15] Khanna-Chopra R,Selote D. Acclimation to drought stress generates oxidative stress tolerance in droughtresistant than -susceptible wheat cultivar under field conditions[J]. Environmental and Experimental Botany,2007,60(2):276-283.

