四种改良剂对Cu、Cd复合污染土壤中Cu、Cd形态和土壤酶活性的影响
杜志敏,郝建设,周静,高倩圆,祝红红,徐琳,崔红标,李辉信
1. 中国科学院南京土壤研究所,江苏 南京 210008;2. 中国科学院武汉植物园,湖北 武汉 430074;3. 南京农业大学资源与环境科学学院,江苏 南京 210095;4. 郑州大学化工与能源学院,河南 郑州 450001;5. 安徽农业大学资源与环境科学学院,安徽 合肥 230036
土壤重金属污染面积大,污染物具有在土壤中移动性差、滞留时间长、不能被微生物降解等特点,因此治理和修复的难度大[1,2]。Cu是动植物生长必需的微量元素之一,同时也是重要的污染重金属。Cd是植物体不需要的元素,生物毒害性强。土壤重金属污染,尤其是冶炼厂周边土壤重金属的污染防治是土壤环境保护工作的重中之重[3]。土壤环境中重金属的毒性不仅与其总量有关,更大程度上由其形态分布决定,不同的形态产生不同的环境效应,直接影响到重金属的毒性、迁移及在自然界的循环[4,5]。根据Tessier[6]及其相应的改进方法[7]将土壤中重金属分为可交换态(EX)、碳酸盐结合态(CAB)、铁锰氧化物结合态(OxiB)、有机结合态(OrgB)和残渣态(ResB)。土壤重金属污染会减弱土壤酶活并导致土壤肥力降低[8,9]。国内外研究[10-12]指出土壤EX态重金属可较好反映其生物有效性和移动性,显著影响土壤中各种酶活的大小,通过测定土壤重金属化学形态特别是EX态含量及土壤酶活性可以评价施入改良剂的修复效果。
前人对改良剂修复单一重金属污染土壤的研究较多[13],复合污染土壤多为室内盆栽试验[14,15],不能很好反映改良剂田间修复实际情况。本试验以黑麦草(Lolium perenneL.)作为修复植物,研究石灰、磷灰石、蒙脱石和凹凸棒石4种无机化学改良剂及其不同添加剂量,在田间条件下原位修复重金属Cu、Cd复合污染土壤,采用土壤重金属化学提取性和土壤酶活性变化作指标评价修复效果,以期为改良剂野外推广应用提供参考。
1 材料与方法
1.1 供试材料
供试改良剂:供试改良剂产地及其基本理化性质见表1。
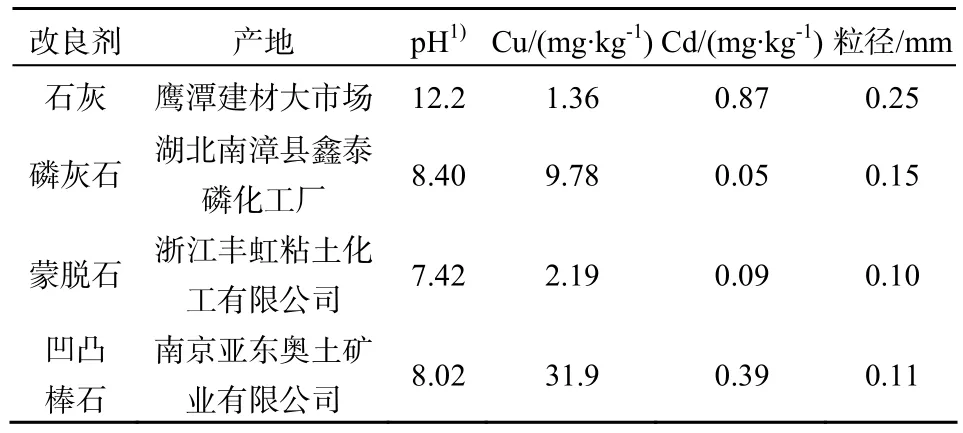
表1 供试改良剂基本理化性质Table 1 Basic physico-chemical properties of the test amendments
供试植物:黑麦草(Lolium perenneL.),江苏“大华”牌,属于重金属富集植物[16,17],购自江苏省大华种业集团有限公司临海分公司。
供试复合肥:湖北“三宁”牌,(N,P2O5,K2O的质量分数各为15%,总养分45%),购自湖北三宁化工股份有限公司。
1.2 试验设计
田间概况:试验地点位于江西省贵溪市滨江乡柏里村陈家村小组(28。12' N, 116。55' E),受贵溪某冶炼厂重金属污染的水稻田。试验田块,多年废弃,现已有沙化现象,酸化叠加重金属铜镉等污染。供试土壤基本理化性质为:有机质,30.8 g·kg-1;碱解氮,163 mg·kg-1;速效磷,63.7 mg·kg-1;速效钾,66.2 mg·kg-1;全 Cu,797 mg·kg-1;有效 Cu,418 mg·kg-1;全 Cd,0.84 mg·kg-1;有效 Cd,0.65 mg·kg-1;pH(土水质量比12.5∶),4.64;容重,1.31 g·cm-3;机械组成(%),2~0.05 mm,62.6;0.05~0.002 mm,24.6;<0.002 mm,12.8。
试验处理:以石灰、磷灰石、蒙脱石和凹凸棒石为污染土壤改良剂进行种植黑麦草的田间试验,试验共设 13个处理。不加改良剂的对照处理记为CK;石灰添加量为 0.1%(占供试污染土壤耕作层(0~17 cm)土壤质量百分比,下同)、0.2%和0.4%的处理分别记为 S1、S2和 S3;磷灰石添加量为0.58%、1.16%和2.32%的处理分别记为L1、L2和L3;蒙脱石添加量为 1%、2%和 4%的处理分别记为M1、M2和M3;凹凸棒石添加量为1%、2%和3%的处理分别记为A1、A2和A3。每处理重复3次,共计 39个试验小区,采用单因素设计、随机区组田间排列。小区田埂用防渗聚乙烯塑料薄膜包裹,埂宽0.3 m,高出地面0.2 m,地下深度0.3 m,每小区面积(3×2 m2)。各小区田间管理方式一致。
试验过程:2009年12月1日,小区均匀撒上改良剂,充分混匀并平整土地,各小区浇水100 kg。12月8日播种黑麦草(播种量为0.02 kg·小区-1),施加复合肥(0.5 kg·小区-1)。2010年4月16日在黑麦草抽穗时采集根际土壤样品。土壤样品一部分自然风干后直接进行酶活性测定,另一部分风干后过尼龙筛待测。
1.3 样品测定与数据处理
土壤样品分析采用常规分析方法[18]。土壤 pH按土水质量比 1∶2.5,酸度计(pH S-2C,上海康仪公司)测定。土壤全Cu、全Cd采用硝酸-高氯酸-氢氟酸-高氯酸全量分解法消解,土壤Cu、Cd化学形态分级及提取采用朱嬿婉等 1989年修改后的Tessier连续提取法[7]提取,原子吸收分光光度计法(GBC 932AA,澳大利亚)测定。
土壤酶活性测定[19]:土壤脲酶活性采用靛酚蓝比色法,土壤酸性磷酸酶活性采用磷酸苯二钠比色法,土壤过氧化氢酶活性采用容量法。
采用Microsoft excel 2003和Windows spss13.0进行数据的统计分析。
2 结果与讨论
2.1 改良剂对土壤pH的影响
对照处理pH较低,施用改良剂后土壤pH有不同程度提高(图 1)。施用石灰能显著提高土壤pH,低中高3种剂量均与对照处理达到显著差异,且施用量越大,pH提高幅度也越大;高剂量石灰处理pH提高幅度最大,比对照pH增加了1.08个单位,与其余 12种处理均达到显著差异水平。磷灰石、蒙脱石和凹凸棒石对土壤pH的提高与石灰类似,但幅度低于石灰处理,这与石灰本身pH较高有一定关系。土壤pH增加会较弱土壤有机/无机胶体及土壤黏粒对重金属离子的吸附能力,使土壤中重金属有效性降低,减少可交换态重金属离子数量[20, 21]。
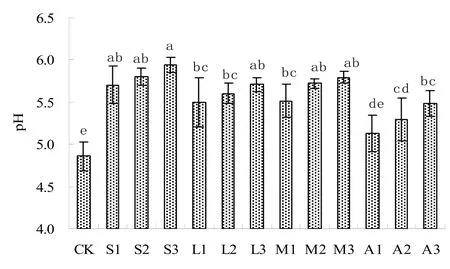
图1 改良剂对土壤pH的影响Fig. 1 Effects of amendments on Soil pH
2.2 改良剂对土壤铜、镉形态的影响
土壤环境中重金属的毒性不仅与其总量有关,更大程度上由其形态分布决定,不同的形态产生不同的环境效应,直接影响到重金属的毒性、迁移及在自然界的循环[5]。重金属化学形态与重金属的生物有效性密切相关[22],对土壤中各形态重金属的化学提取能定性地区分重金属在土壤多相体系中的结合状态和结合能量大小及其相应的生物有效性。化学形态提取法分析并结合植物吸收等测试,可以推测控制土壤重金属有效性的因素和生成的重金属-盐类沉淀或络合物形式[23,24],所以化学形态提取法在土壤化学研究中已成为最为普遍的方法。
由表2、表3可知,CK处理土壤中EX态Cu所占比例较大,占总量的19.2%,重金属Cu生物毒害性较高。施用改良剂明显降低了土壤EX态Cu、Cd含量(M1处理除外),促进Cu向生物毒害性低的形态转化,效果显著的是石灰和磷灰石处理。与对照相比,高剂量石灰使EX态Cu、Cd含量分别降低了 96.4%~98.6%、16.8%~31.9%,高剂量磷灰石使EX态Cu、Cd含量分别降低了92.0%~97.2%、18.3%~27.7%,碳酸盐结合态和铁锰氧化物结合态所占比例增加。蒙脱石(低剂量除外)和凹凸棒石处理使EX态Cu降低了10.4%~30.5%,碳酸盐结合态和铁锰氧化物结合态含量增加。石灰和磷灰石降低EX态Cu效果较好,主要是由于改良剂对土壤pH的提高,因此,对于酸性和中性偏酸性重金属污染土壤,石灰和磷灰石是良好的修复剂。土壤中Cd的EX态含量较高(27%~50%),这与Allace[11]指出的 Cd在土壤中生物有效性高,活性较强,很容易被作物吸收而污染食物链,危及人类健康的结果一致。试验中改良剂对Cd的钝化不如对Cu的钝化效果明显。

表2 改良剂对土壤Cu各形态含量的影响Table 2 Effects of amendments on the concentrations of Cu forms in soil
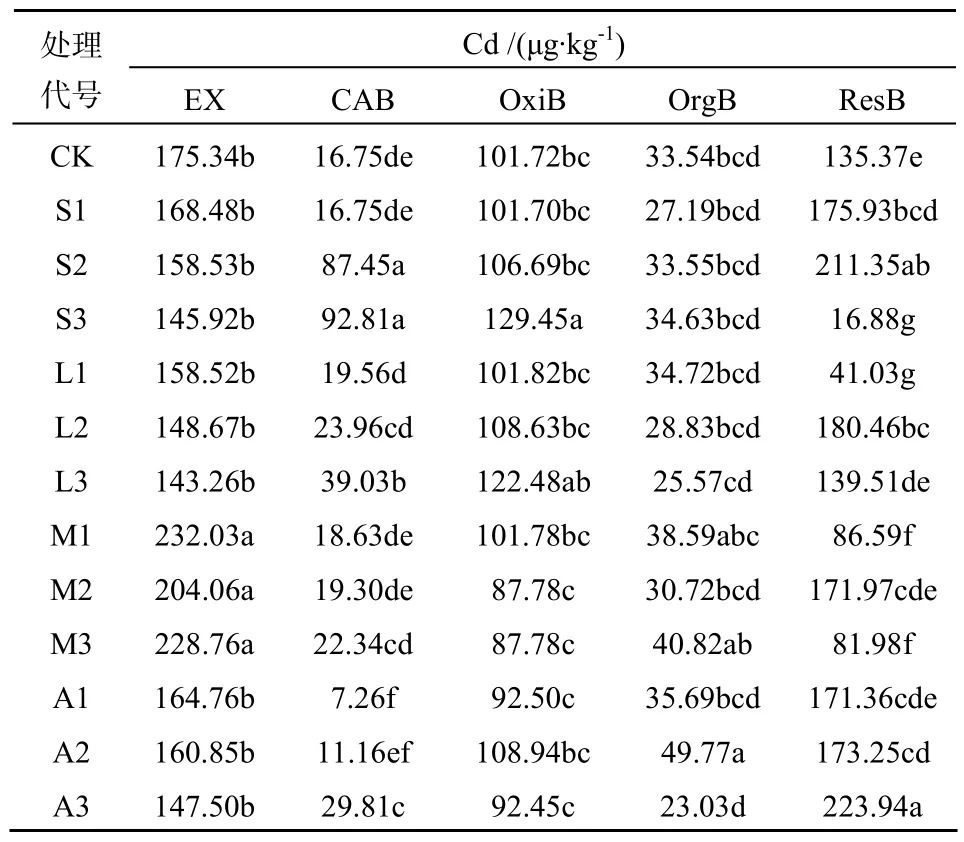
表3 改良剂对土壤Cd各形态含量的影响Table 3 Effects of amendments on the concentrations of Cd forms in soil
2.3 改良剂对土壤酶活性的影响
土壤酶活性易受土壤物理性质、化学性质和生物活性的影响,环境污染对土壤酶活性影响,可在一定程度上对环境状况起到指示作用[25]。土壤酶活性受重金属抑制的主要原因:一方面,重金属直接影响土壤酶活性,占据土壤酶的活性中心或与酶分子的巯基、胺基、羧基结合,破坏酶活性基团的空间结构,使酶本身失去催化能力,并抑制酶的合成;另一方面,重金属通过影响土壤微生物的生长繁殖,减少微生物体内酶的合成及分泌,间接影响土壤酶活性[26-28]。
2.3.1 改良剂对土壤脲酶活性的影响
脲酶是一种将酰胺态有机氮化物水解为植物可以直接利用的无机态氮化物的酶,是尿素胺基水解酶类的通称。脲酶活性一定程度上反映土壤的供氮水平与能力,与土壤中氮循环体系密切联系。由图2可以看出,对照处理土壤脲酶活性最低,仅为0.09 mg·g-1,施用改良剂后有不同程度增加,增加幅度较大的石灰和磷灰石处理。高剂量石灰处理脲酶达到最高值,比对照处理增加了79.0%,其次是高剂量磷灰石处理,比对照增加了67.2%;对于同一种改良剂处理,脲酶活性增加幅度均随改良剂添加剂量增加而增大。

图2 改良剂对土壤脲酶活性的影响Fig. 2 Effects of amendments on the activity of urease
2.3.2 改良剂对土壤酸性磷酸酶活性的影响
土壤磷酸酶能酶促磷酸酯水解,酶促作用是能释放出正磷酸。土壤酸性磷酸酶是酸性土壤有机磷矿化的重要动力,能够催化磷酸单酯水解及无机磷酸释放,是参与生物磷代谢的重要酶类。由图3可以看出,对照处理土壤酸性磷酸酶活性最低,仅为1.89 mg·g-1,施用改良剂后有不同程度增加(M1处理除外),增加幅度较大的石灰和磷灰石处理。高剂量石灰处理酸性磷酸酶最高,比对照处理增加了42.2%,其次是高剂量磷灰石处理,比对照处理增加了47.3%;对于同一种改良剂处理,酸性磷酸酶活性增加幅度均随改良剂添加剂量增加而增大。
2.3.3 改良剂对土壤过氧化氢酶活性的影响
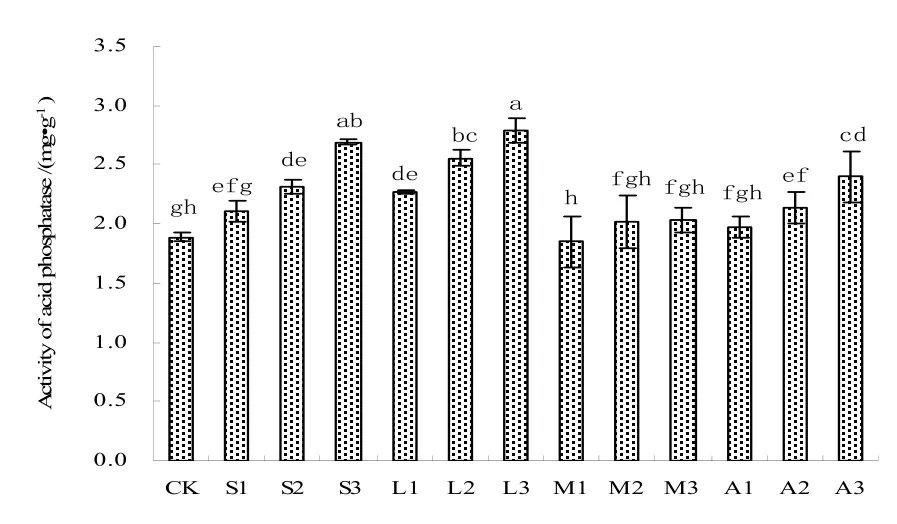
图3 改良剂对土壤酸性磷酸酶活性的影响Fig. 3 Effects of amendments on the activity of acid phosphatase
过氧化氢酶属于氧化还原酶,与土壤有机质含量和微生物数量有关。过氧化氢酶在土壤中对过氧化氢的酶促分解有利于防止过氧化氢对生物体的毒害作用。由图4可以看出,对照处理土壤过氧化氢酶活性最低,仅为0.35 mL·g-1,施用改良剂后有不同程度增加,增加幅度较大的石灰和磷灰石处理。高剂量石灰处理过氧化氢酶最高,为对照处理的2.5倍,其次是高剂量磷灰石处理,为对照处理的2.2倍;对于同一种改良剂处理,过氧化氢酶活性增加幅度均随改良剂添加剂量增加而增大。蒙脱石的加入对土壤酶活性受重金属胁迫没有明显影响,这可能因为蒙脱石和酶对铜离子竞争吸附,酶强于蒙脱石,蒙脱石对铜离子的吸附是以电性吸附为主的交换吸附[29]。
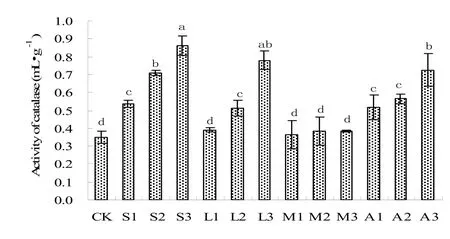
图4 改良剂对土壤过氧化氢酶活性的影响Fig. 4 Effects of amendments on the activity of catalase
2.4 改良剂处理下土壤pH、Cu、Cd含量与土壤酶活性的相关性分析
利用SPSS软件,对重金属复合污染下,各处理土壤酶活性与土壤pH、土壤EX态Cu、Cd含量、土壤Cu、Cd全量进行相关性分析。由表4可以看出,田间试验中土壤酶活性与土壤Cu、Cd全量没有达到显著相关,与EX态Cu、Cd含量呈显著或极显著负相关关系,说明以土壤重金属形态分析来研究重金属对土壤酶活性的影响比用重金属全量更为准确。土壤脲酶、酸性磷酸酶和过氧化氢酶活性均与土壤pH呈显著或极显著正相关关系,说明提高土壤pH有利于减轻重金属的毒害作用,增加土壤酶活性。此外,土壤中Cu与酶活性的相关性优于Cd,说明试验中土壤Cu含量对土壤酶活性影响较大。
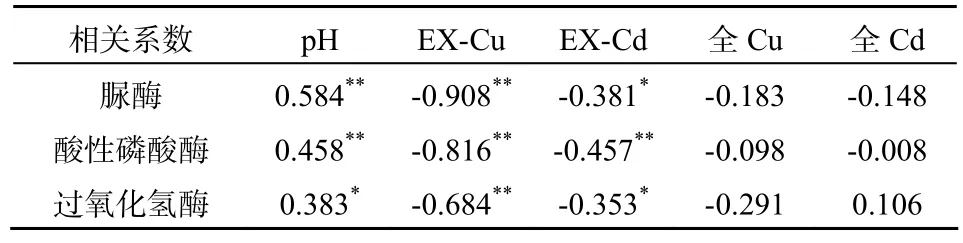
表4 土壤酶活性和土壤pH、土壤Cu和Cd含量的关系Table 4 Correlation coefficients of activities of soil enzyme with soil pH,and concentrations of Cu and Cd in soil
3 结论
施用改良剂提高了土壤pH并使土壤Cu由对植物有效性大的可交换态向对植物有效性小的碳酸盐结合态、铁锰氧化物结合态和有机结合态转化。土壤pH是影响重金属Cu形态的关键因素。4种改良剂降低可交换态Cu效果较好的是石灰和磷灰石,与对照相比,高剂量石灰和高剂量磷灰石处理分别使可交换态Cu降低了95.9%、94.6%。试验中改良剂对Cd的钝化不如对Cu的钝化效果好。
改良剂不同程度的提高了土壤脲酶、酸性磷酸酶和过氧化氢酶活性(M1处理除外),改良剂对土壤酶活性增加幅度均随其添加剂量增加而增大。与对照相比,高剂量石灰(S3)和磷灰石(L3)处理,分别使土壤脲酶活性增加了79.0%、67.2%,使土壤酸性磷酸酶活性增加了42.2%、47.3%,使土壤过氧化氢酶活性增至对照处理的2.5倍、2.2倍。
土壤脲酶、酸性磷酸酶和过氧化氢酶活性均与土壤pH呈显著或极显著正相关关系,相关系数分别为0.584、0.458、0.383,提高土壤pH有利于减轻重金属的毒害作用,增加土壤酶活性。土壤EX态Cu、Cd含量与土壤酶活性均呈显著或极显著负相关关系。土壤中Cu与土壤酶活性的相关性优于Cd,说明试验中土壤Cu含量对土壤酶活性影响较大。
石灰、磷灰石施用于铜镉复合污染土壤能显著提高土壤pH,降低重金属Cu、Cd活性,增加土壤酶活性,在重金属污染土壤修复中具有较好的应用前景。
[1] 崔德杰, 张玉龙. 土壤重金属污染现状与修复技术研究进展[J]. 土壤通报, 2004, 35(3): 366-370.CUI Dejie, ZHANG Yulong. Current situation of soil contamination by heavy metals and research advances on the remediation techniques[J]. Chinese Journal of Soil Science, 2004, 35(3): 366-370.
[2] 王立群, 罗磊, 马义兵, 等. 重金属污染土壤原位钝化修复研究进展[J]. 应用生态学报, 2009, 20 (5): 1 214-1 222.WANG Liqun, LUO Lei, MA Yibing, et al. In situ immobilization remediation of heavy metals-contaminated soils: A review[J]. Chinese Journal of Applied Ecology, 2009, 20(5): 1214-1222.
[3] 王汉卫, 王玉军, 陈杰华, 等. 改性纳米碳黑用于重金属污染土壤改良的研究[J]. 中国环境科学, 2009, 29(4): 431-436.WANG Hanwei, WANG Yujun, CHEN Jiehua, et al. Application of modified nano-particle black carbon for the remediation of soil heavy metal pollution[J]. China Environmental Science, 2009, 29(4):431-436.
[4] 俞慎. 红壤铜污染的物理化学行为和生物学表征[D]. 杭州: 浙江大学, 2002.YU Shen. Physicochemieal and biological characterization of copper contamination in red soils[D]. Hangzhou: Zhejiang University, 2002:78-90.
[5] QIAO L, GOEN H O. The effect of clay amendment on speciation of heavy metals in sewage sluge[J]. Water Science and Technology, 1996,34(7-8): 413-420.
[6] TESSIER A, CAMPBELL P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51: 844-851.
[7] 朱嬿婉, 沈壬水, 钱钦文, 等. 土壤中金属元素的五个组分的连续提取法[J]. 土壤, 1989, 21(3): 163-166.ZHU Yanwan, SHEN Renshui, QIAN Qinwen, et al. Successive extraction method of five fractions of heavy metals in soils[J]. Soils,1989, 21(3): 163-166.
[8] 刘霞, 刘树庆, 王胜爱. 河北主要土壤中重金属镉、铅形态与土壤酶活性的关系[J]. 河北农业大学学报, 2002, 25(1): 33-37.LIU Xia, LIU Shuqing, WANG Shengai, et al. The relationship between heavy metal forms and soil enzymatic activities in the main soils of Hebei province[J]. Journal of Agricultural University of Hebei,2002, 25(1): 33-37.
[9] OCONNOR C S, LEEP N W, EDWARDS R, et al. The combined use of electrokinetic remediation and phytoremediation to decontaminated metal-polluted soils: a laboratory-scale feasibility study[J].Environmental Monitoring and Assessment, 2003, 84:141-158.
[10] 章明奎, 方利平, 周翠. 污染土壤重金属的生物有效性和移动性评价: 四种方法比较[J]. 应用生态学报, 2006, 17 (8): 1501-1504.ZHANG Mingkui, FANG Liping, ZHOU Cui. Evaluation of heavy metals bioavailability and mobility in polluted soils: A comparison of four methods[J]. Chinese Journal of Applied Ecology, 2006, 17 (8): 1 501-1 504.
[11] ALLACE A. Dose-response curves for zinc, cadmium and nickel in combination of one, two, or three[J]. Soil Science, 1989,147(6):401-410.
[12] RANHAWA H S, SINGH S P. Zinc fractions in soils and their availability to maize[J].IndianSociety of Soil Science, 1995, 43 (2):293-294.
[13] 徐明岗, 张青, 曾希柏. 改良剂对黄泥土镉锌复合污染修复效应与机理研究[J]. 环境科学, 2007, 28 (6): 1 361-1 366.XU Minggang, ZHANG Qing, ZENG Xibai. Effects and mechanism of amendments on remediation of Cd-Zn contaminated paddy soil[J].Environmental Science, 2007, 28 (6): 1361-1366.
[14] 郝秀珍, 周东美, 薛艳, 等. 天然蒙脱石和沸石改良对黑麦草在铜尾矿砂上生长的影响[J]. 土壤学报, 2005, 42(3): 434-439.HAO Xiuzhen, ZHOU Dongmei, XUE Yan, et al. Ryegrass growth in Cu mine tailings amended with natural montmorillonite and zeolite[J].Acta Pedologica Sinica, 2005, 42(3): 434-439.
[15] 郝秀珍, 周东美, 王玉军, 等. 泥炭和化学肥料处理对黑麦草在铜矿尾矿砂上生长影响的研究[J]. 土壤学报, 2004, 41(4): 645-648.HAO Xiuzhen, ZHOU Dongmei, WANG Yujun, et al. Study of ryegrass growth in copper mine tailing treated with peat and chemical fertilizer[J]. Acta Pedologica Sinica, 2004, 41 (4): 645-648.
[16] 王晨, 王海燕, 赵琨, 等. 硅对镉、锌、铅复合污染土壤中黑麦草生理生化性质的影响[J]. 生态环境, 2008, 17(6): 2240-2245.WANG Chen, WANG Haiyan, ZHAO Kun, et al. Effects of silicon on physiological and biochemical properties of ryegrass under the compound pollution of Cd, Zn and Pb[J]. Ecology and Environment,2008, 17(6): 2240-2245.
[17] 杨小波, 吴庆书. 城市生态学[M]. 北京: 科学出版社, 2005.YANG Xiaobo, WU Qingshu. Urban Ecology[M]. Beijing: Science Press, 2005.
[18] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社,1999.LU Rukun. Analytical methods of soil and agro-chemistry[M]. Beijing:China Agricultural Science and Technology Press, 1999.
[19] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 295-323.GUAN Songyin. Soil enzyme and its research methodology[M].Beijing: Agricultural Press, 1986: 295-323.
[20] COTTER-HOWELLS J, CAPORN S. Remediation of contaminated land by formation of heavy metal phosphates[J]. Applied Geochemistry, 1996, 11: 335-342.
[21] NAIDU R, BOLAN N S, KOOKANA R S. Ionic-strength and pH effects on the absorption of cadmium and the surface charge of soils[J].Euro J Soil Sci, 1994, 45: 419-429.
[22] 雷鸣, 廖柏寒, 秦普丰, 等. 土壤重金属化学形态的生物可利用性评价[J]. 生态环境, 2007, 16(5): 1 551-1 556.LEI Ming, LIAO Bohan, QIN Pufeng, et al. Assessment of bioavailability of heavy metal in contaminated soils with chemical fractionation[J]. Ecology and Environment, 2007, 16(5): 1 551-1 556.
[23] CHEN S B, ZHU Y G, MA Y B. The effect of grain size of rock phosphate amendment on metal immobilization in contaminated soils[J]. Journal of Hazardous Materials, 2006, 134: 74-79.
[24] BOLAN N S, ADRIANO D C, DURAISAMY P, et al. Immobilization and phytoavailability of cadmium in variable charge soils[J]. Effect of phosphate addition. Plant and Soil, 2003, 250: 83-94.
[25] KIZILKAYA R, ASKIN T, BAYRAKLI B, et al. Microbiological characteristics of soils contaminated with heavy metals[J]. European Journal of Soil Biology, 2004, 40(2): 95-102.
[26] BAATH E. Effects of heavy metals in soil on microbial processes and populations: A review[J]. Water Air Soil Pollution, 1989, 335-379.
[27] 周礼恺, 张志明, 曹承绵, 等. 土壤的重金属污染与土壤酶活性[J].环境科学学报, l985, 5(2): l76-183.ZHOU Likai, ZHANG Zhiming, CAO Chengmian, et al. Heavy metal pollution and enzymatic activity of soil[J]. Acta scientiae circumstantiae, l985, 5(2): l76-183.
[28] 杨志新, 刘树庆. 重金属Cd、Zn、Pb复合污染对土壤酶活性的影响[J]. 环境科学学报, 200l, 2l(1): 60-63.YANG Zhixin, LIU Shuqing. Effect of compound pollution of heavy metals on soil enzymic activities[J]. Acta scientiae circumstantiae,200l, 2l(1): 60-63.
[29] ZHANG Z Z, SPARKS D L. Sodium-copper exchange on Wyoming montmorillonite in chloride,perchlorate, nitrate, and sulfate solutions[J]. Soil Science Society of America Journal. 1996, 60:1750-1757.

