不同紫云英基因型对难溶性磷吸收利用的影响
兰忠明,张辉,吴一群,林新坚
福建省农业科学院土壤肥料研究所,福建 福州 350013
据统计,全世界约有43%的耕地缺磷[1],而我国有 2/3的耕地缺磷[2],因此土壤中的磷素不足是提高作物产量的主要限制因素之一[3]。如果通过传统方法施用磷肥,磷极易被土壤固定,主要表现在肥料中速效磷很容易被土壤中的钙、铁、铝氧化物固定,达不到增加土壤有效磷的目的[4-6]。事实上,在一部分磷缺乏的土壤上,全磷的含量并不低,主要问题是大部分磷以难溶性磷酸盐形式(如 Ca-P、Al-P和Fe-P等)存在,很难被植物吸收利用。如何利用土壤中蕴藏的大量难溶性磷显得极为重要[6]。大量研究结果表明,不同植物种类及同一植物种类的不同基因型在吸收利用难性磷酸盐能力方面存在非常显著的差异[7-13]。利用作物自身的生理、遗传特点,筛选与选育磷高效利用的作物基因型,充分利用土壤中潜在丰富的磷素,挖掘高效活化无效磷的作物品种,在理论研究和生产应用上都有重要意义[14]。
绿肥作物在农业生态系统中占有重要地位,它具有减少水土流失、增加土壤有机质含量、改良土壤性状的作用,同时也能通过吸收和活化为其他作物提供大量的有效养分,其中包括磷[15]。紫云英(Astragalus sinicus)属于豆科黄耆属(AstragalusL.)是越年生草本植物,多在秋季套播于晚稻田中,作早稻的基肥,是我国稻田最主要的绿肥作物,也是一种优质的豆科牧草和蜜源作物。紫云英除用作绿肥外,还能直接或青贮紫云英作饲料,营养价值颇高,个别基因型还具有药用价值[16]。在我国红壤地区的大部分土壤中,P主要是以难溶性的铁磷化合物(Fe-P)和铝磷化合物(Al-P)形式存在的,土壤P素的植物有效性主要取决于植物对难溶性P的利用能力[13]。目前有关豆科作物对难溶性磷吸收利用能力和机理已有相关报道,但紫云英对 Al-P和Fe-P的吸收利用未见报道。本文通过砂培试验研究5个不同紫云英基因型对不同形态P化合物的吸收利用能力,旨在明确其利用难溶性磷能力差异,为进一步筛选高效利用难溶性磷的基因型品种以促进土壤中难溶性磷的释放、减少磷肥有效磷的固定,提高磷素的利用率,对促进农业生产的持续高效发展具有重大的现实意义。
1 材料与方法
1.1 供试材料
前期研究[17]表明,不同的紫云英种质资源通过SSR分子遗传标记筛选出SSR位点多态性,通过聚类分析发现紫云英品种之间在遗传方面存在显著的基因型差异。本砂培(石英砂)试验[17]从中筛选出5个具有代表性紫云英基因型品种分别为:闽紫 6号、闽紫1号、浙紫5号、弋江籽、余江大叶。闽紫1号和闽紫6号为福建省农业科学院土壤肥料研究所自主选育,弋江籽、余江大叶、浙紫5号分别为安徽、江西、浙江省引进的品种(基因型)。供试的磷源有:磷酸二氢钾 KH2PO4(K-P)(化学纯),两种常见难溶性磷酸盐化合物:磷酸铝(AlPO4)(Al-P)和磷酸铁(FePO4.2H2O)(Fe-P),这两种化合物均为分析纯,购自SIGMA公司。Al-P和Fe-P水溶性大小(指的是水溶性磷质量分数占全磷质量分数的百分数)分别为0.081%、0.29%,pH值(化合物与水之质量比为1∶10)大小分别为5.43和3.41。
1.2 试验设计
砂培试验:移栽整齐一致的闽紫1号、闽紫6号、弋江籽、余江大叶、浙紫5号紫云英幼苗于不同磷源处理中。供试磷源为 KH2PO4(K-P)、AlPO4(Al-P)、FePO4.2H2O(Fe-P)、不施用磷(CK)。称取1.18 g Al-P、1.81 g Fe-P、1.32 g K-P,均相当于纯磷100 mg·kg-1。石英砂与不同磷源充分混合均匀后,装桶。每桶装石英砂3.0 kg。各处理除磷源不同外,其它营养元素用量均一致,并以营养液形式淋入。营养液配方采用缺磷的霍格兰营养液和阿农微量元素混合液,具体为:Ca(NO3)20.95 g·L-1、KNO30.61 g·L-1、MgSO4.7H2O 0.49 g·L-1、NH4NO30.04 g·L-1,酒石酸铁 0.005 g·L-1,微量元素 H3BO32.86 g·L-1、MnCl2·4H2O 1.81 g·L-1、ZnSO4·7H2O 0.22 g·L-1、CuSO4·5H2O 0.08 g·L-1、H2MoO4·4H2O 0.09 g·L-1。试验采用完全随机设计,每处理3次重复。紫云英在砂培条件下生长90 d后收获,测定紫云英地上部、地下部生长性状、生物量及植株的磷质量分数。
1.3 分析测定方法
1.3.1 紫云英生长性状、生物量:紫云英生长90 d后性状、生物量测定。
1.3.2 植株地上部、地下部干物质量和吸磷量:收获植株后,先用自来水冲洗干净,再用去离子水将植株冲洗几遍,然后分为地上部和地下部。将鲜样先在105 ℃下杀青30 min,再在75 ℃下烘48 h至恒重,测定其干物质量。最后用粉碎机磨细,相当于100目,自封袋保存,供元素质量分数分析测定。植物样品用H2S04(浓)-H2O2消煮,采用钼蓝比色法测植株全磷[18]。
1.4 数据处理
本文数据为 3次重复的平均值,进行方差法分析,并用LSD进行多重比较。数据分析均在Microsoft Excel 2003和DPS 12.5软件上进行的。
2 结果与分析
2.1 不同紫云英基因型在难溶性磷中生长状况
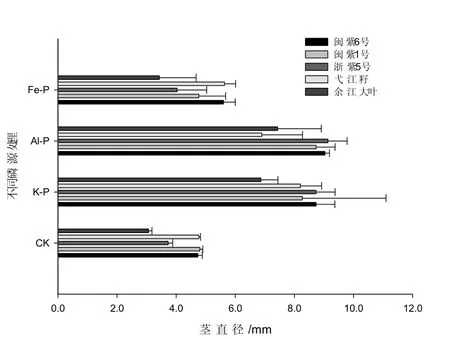
图1 紫云英基因型在不同磷源中的茎直径差异Fig. 1 Genotypic variation in stem diameter with different P sources
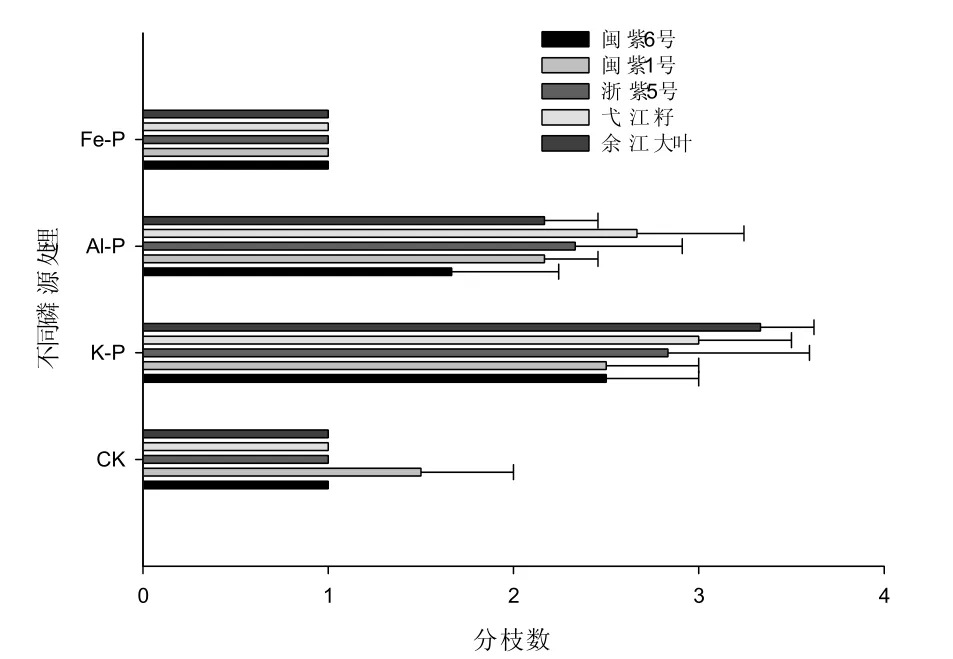
图2 紫云英基因型在不同磷源中的分枝数差异Fig. 2 Genotypic variation in branch number with different P sources

表1 紫云英基因型在不同磷源中的株高差异Table 1 Genotypic variation in plant height with different P sources cm
不同磷源处理条件下,从株高、茎直径、分枝数方面来看(表 1、图 1、图 2),基本上都表现为K-P>Al-P>Fe-P>CK,且两种难溶性磷处理之间差异达到显著或极显著水平,说明不同紫云英基因型在低磷胁迫时对难溶性铝磷、铁磷都表现出一定的活化吸收能力。在相同磷源条件下,不同紫云英基因型在生长方面也表现出一定的基因型差异。闽紫6号、闽紫1号、浙紫5号植株高大,茎秆粗壮,叶片较大,分枝力中等。弋江籽和余江大叶植株较矮小、茎秆较细,叶片较小,但分枝较多。在K-P和Al-P处理条件下,紫云英基因型分枝数间差异显著,余江大叶、弋江籽和浙紫5号分枝多于闽紫6号和闽紫1号。在CK和Fe-P处理条件下,紫云英基因型分枝之间差异不显著,CK和Fe-P处理相对于K-P和Al-P处理分枝数少2~3倍多,说明在低磷或缺磷胁迫条件下对紫云英的分枝数影响很大。
2.2 紫云英对难溶性磷利用的干物质量基因型差异
如表2所示,相同P处理下,5个紫云英基因型在地上部、地下部及总干物质量方面均存在显著或极其显著差异,绝大部分都表现为闽紫 6号>闽紫1号>浙紫5号>弋江籽>余江大叶。不同P处理下,紫云英基因型之间差异也达到显著或极其显著水平,对 5个紫云英基因型的影响均表现为K-P>Al-P>Fe-P>CK;大多数紫云英基因型Al-P的地上部、地下部及总干物质量都显著大于Fe-P,说明紫云英在难溶性铝磷、铁磷吸收利用方面,紫云英更容易吸收利用Al-P。在低磷条件下闽紫1号和闽紫6号干物质量分别在Al-P和Fe-P中最高。在总干物质量方面,闽紫6号、闽紫1号、浙紫5号、弋江籽和余江大叶在Al-P和Fe-P处理中分别比CK显著提高了 73.07%、71.63%、77.11%、75.35%、83.66%,以及32.63%、30.92%、14.79%、39.71%、38.52%。
2.3 不同紫云英基因型对难溶性磷的吸磷量利用差异
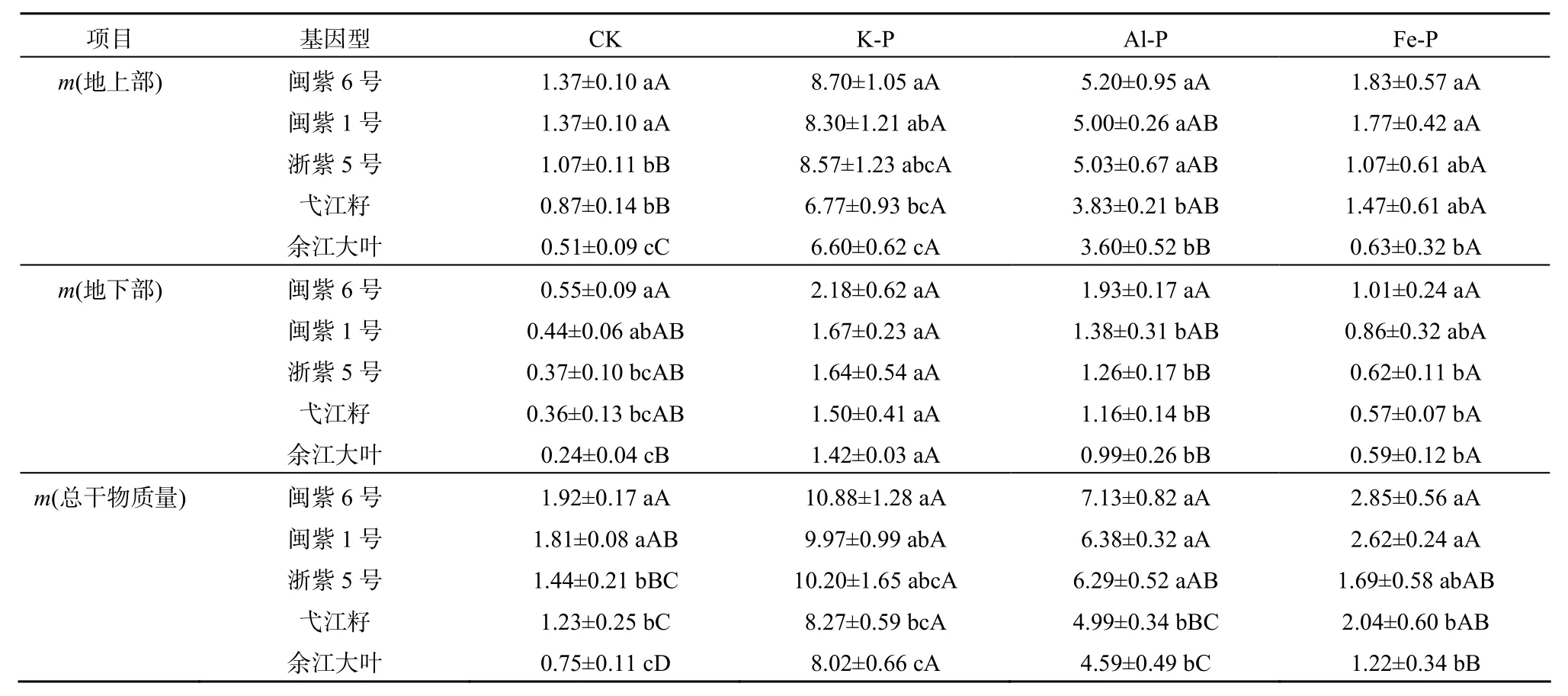
表2 不同磷处理对紫云英干物质量的影响Table 2 Effect on dry weight in different P treatments g
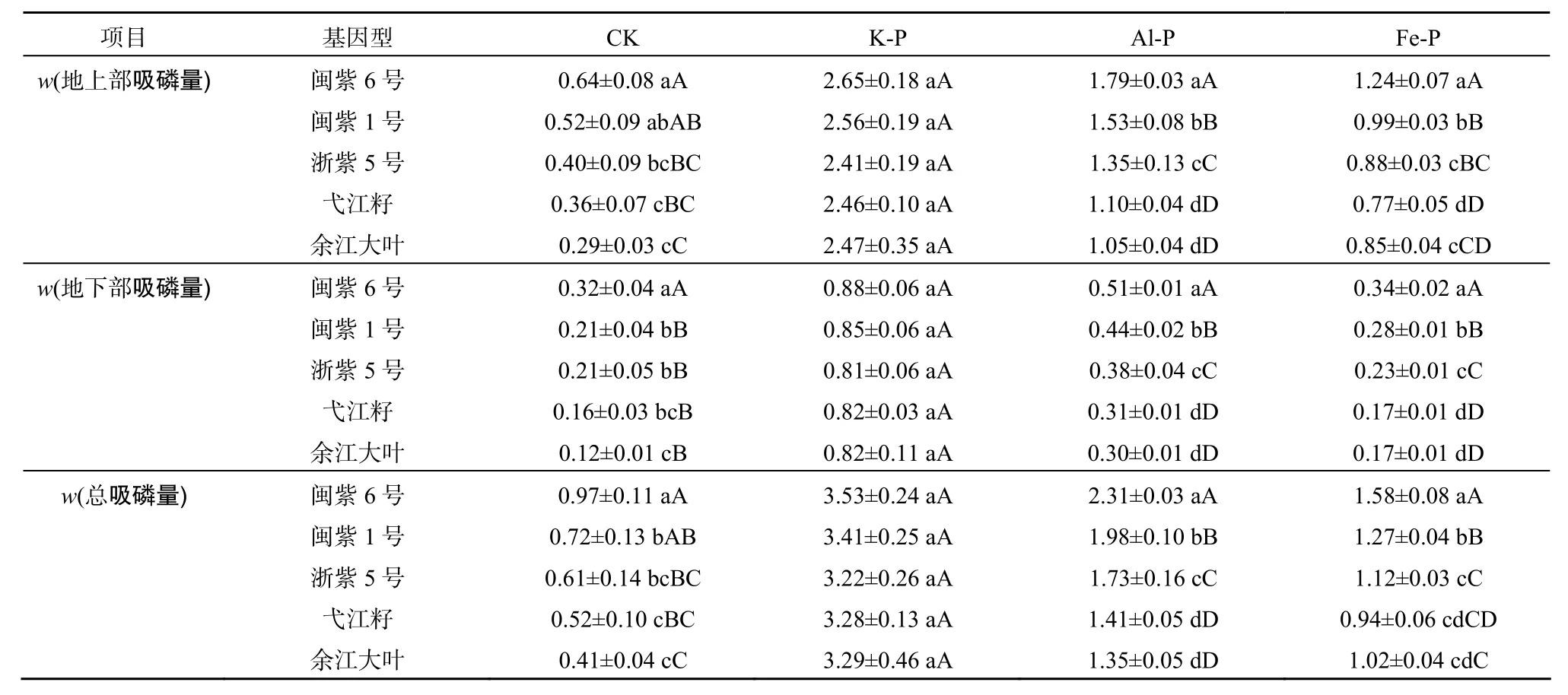
表3 紫云英基因型在不同处理时吸磷量差异Table 3 Genotypic variation in P uptake from different P sources μg·g-1
由表3可以看出,不同处理紫云英基因型间地上部、地下部及总吸磷量存在差异。不同磷源处理下、地上部、地下部及总吸磷量均为 K-P>Al-P>Fe-P>CK,即对不同磷源的吸收能力均以水溶性磷酸盐K-P最高,不供应磷(CK)时最低,这与李健梅等[19]在研究磷胁迫条件下油菜、肥田萝卜对难溶性磷的活化与利用结果一致。紫云英各基因型在利用难溶性磷方面,差异也明显,地上部、地下部及总吸磷量均为Al-P>Fe-P处理,这与赵明等[13]在菜豆上研究结果类似。闽紫6号、闽紫1号、浙紫5号、弋江籽和余江大叶在地上部吸收 Al-P能力分别比Fe-P增加了 30.73%、35.29%、34.81%、30%和19.05%;地下部吸收Al-P能力分别比Fe-P增加了33.33%、36.36%、39.47%、45.16%和 43.33%;总吸磷量吸收Al-P能力分别比Fe-P增加了31.60%、35.86%、35.26%、33.33%和24.44%。闽紫 6号和闽紫1号在吸磷量方面都显著高于弋江籽和余江大叶。在K-P处理条件下,紫云英各基因型之间地上部、地下部及总吸磷量差异均不显著,地上部吸磷量以闽紫6号为最高,浙紫5号最低。地下部吸磷量及总吸磷量均以闽紫6号为最高,余江大叶为最低。总吸磷量经双因素方差分析可以看出,不同磷源处理之间差异达到极其显著水平(P<0.01),紫云英不同基因型之间差异也达到显著水平(P<0.05),但交互差异不明显(表4)。地上部和地下部不同磷源处理之间差异都达到显著或极显著,紫云英不同基因型之间差异不明显,然而地上部交互差异达到极其显著水平(P<0.01)(表5、表6)。
2.4 不同紫云英基因型植株吸磷量与生物量的关系
不同紫云英基因型地上部、地下部干物质量及总鲜质量、总干物质量与植株吸磷量相关回归关系如图3~图6所示。由图可见:不同磷处理下,地上部、地下部干物质量及总鲜质量均与植株不同部位含磷量分布呈一元线性回归趋势。ANOV检验的显著水平0.00<α=0.01,达到极其显著水平。即紫云英植株地上部、地下部干物质量及总干鲜质量增加时,植株吸收磷的养分质量分数也随着增加,呈显著地正相关。从图7不同磷处理总干物质量与总吸磷量关系可以看出,CK和Al-P处理总干物质量与总吸磷量拟合回归关系显著,但对水溶性K-P处理和Fe-P相关回归关系效果不明显,说明紫云英对难溶性磷吸收利用时,对 Al-P吸收富集优于 Fe-P。本试验从另外一个侧面也表明了,磷效率高的基因型(体现在生物量与吸磷量多)闽紫6号、闽紫1号、浙紫5号比磷效率低的弋江籽和余江大叶在吸磷量和生物量方面表现优越。这对作为筛选优势绿肥紫云英品种来说意义重大,因为磷效率高的基因型在紫云英盛花期翻压入土后可以很大程度上减少化肥施用量,为作物优质高产打下良好的营养基础。因此,植物磷营养效率基因型差异表现在植物吸收磷素能力状况,即磷效率高的基因型能够在土壤有效磷含量较低的条件下同样可以活化、吸收、利用土壤中难溶态磷或适应磷胁迫的不良环境,从而有效地维持其正常的生长发育[20]。
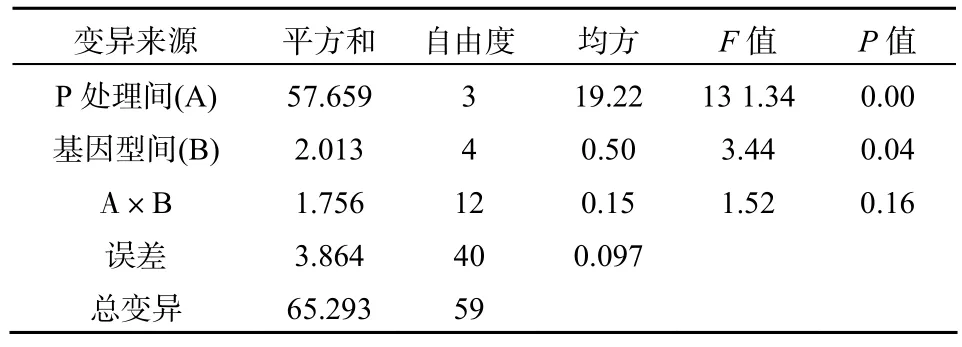
表4 总吸磷量双因素方差分析Table 4 Double factors variance analysis in total P uptake
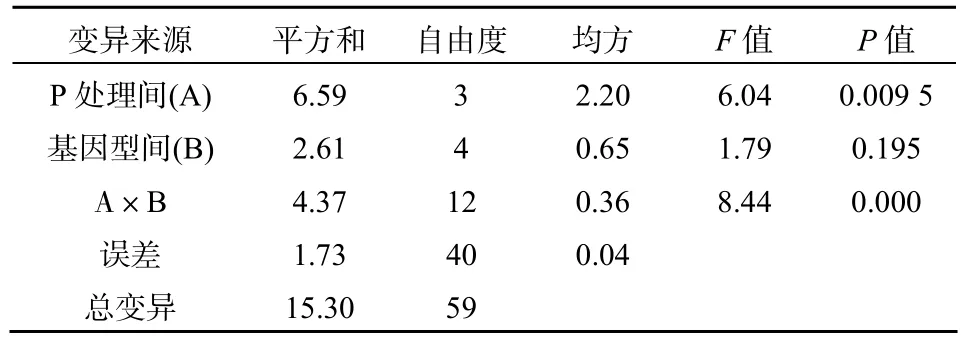
表5 地上部双因素方差分析Table 5 Double factors variance analysis in above ground P uptake
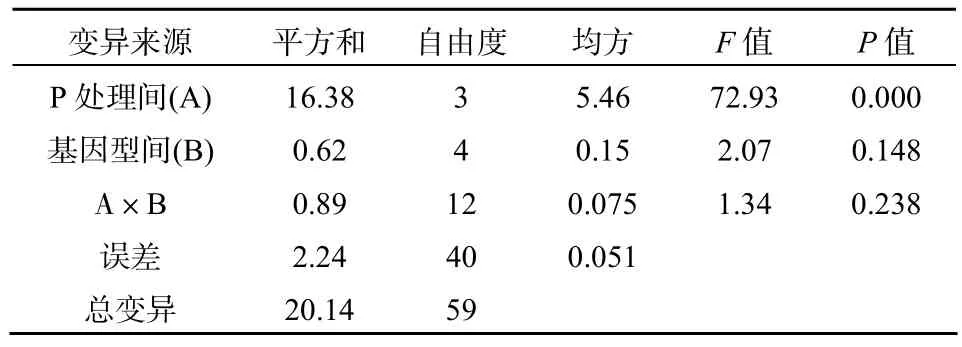
表6 地下部双因素方差分析Table 6 Double factors variance analysis in underground P uptake

图3 地上部干物质量与吸磷量变化Fig. 3 Variation between above ground dry weight and P uptake

图4 地下部干物质量与吸磷量变化Fig. 4 Variation between under ground dry weight and P uptake

图5 总鲜质量与吸磷量变化Fig. 5 Variation between total fresh weight and P uptake

图6 总干物质量与吸磷量变化Fig. 6 Variation between total dry weight and P uptake
3 讨论

图7 不同磷处理总干物质量与总吸磷量关系Fig. 7 Relationship between total dry weight and total P uptake from different P treatments
筛选和培育具有利用较强利用难溶性磷酸盐能力的作物基因型是缓解土壤磷素有效性低下的有效途径之一[21]。不同基因型对难溶性磷酸盐利用吸收能力方面的研究均有报道,如白羽扇豆[22-24]、木豆[7,9]、大麦[25]和菜豆[12-13]等。本研究结果表明,当以难溶性Fe-P或Al-P作为单独磷源时,5个紫云英基因型的干物质量、吸磷量都存在显著的基因型差异,这表明这5个紫云英基因型在吸收利用难溶性磷酸盐方面存在差异。因此,从理论上讲,从现有的紫云英种质资源中筛选具有较强利用难溶性磷酸盐能力的基因型是可行的。以上试验结果也可看出,紫云英在不同磷源中的生长性状、生物量以及植株不同部位的吸磷量有很大差异。紫云英在难溶性磷的生长状况介于CK和K-P之间。在吸收利用难溶性磷时,地上部、地下部及总吸磷量均是Al-P>Fe-P。这与Shen等[12]在研究豆科作物结果一致。说明紫云英更易吸收Al-P来满足其自身的营养需要,Al-P对作物的生物有效性要大于Fe-P。郭再华等[26]研究了不同水稻对难溶性有机磷、铝磷和磷矿粉的吸收,其研究表明,水稻耐低磷品种(99011、508、580和99112)对难溶性磷吸收存在显著基因型差异,其中低磷胁迫时,水稻508吸磷量最多,水稻580的磷利用效率最高。本研究结果表明,紫云英各基因型在吸收利用难溶性铝、铁也存在很大的基因型差异,来自福建农科院选育的闽紫6号和闽紫1号对磷的吸收能力要强于浙江的浙紫5号、安徽弋江籽和江西的余江大叶。这可能是因为闽紫 6号和闽紫1号对难溶性磷的磷吸收量及生物量均高于其它3个品种,表明闽紫6号和闽紫1号对难溶性磷具有较强的溶解吸收能力。本研究中的 Al-P和 Fe-P作为难溶性磷源,其水溶性大小顺序为Fe-P>Al-P。但在砂培试验紫云英的生长中,发现各基因型紫云英在吸收利用难溶性磷时,地上部、地下部及总吸磷量均是 Al-P>Fe-P。究其原因其一可能与难溶性磷的形态有关。尽管Fe-P和Al-P都是难溶性磷,但试验结果表明紫云英根系更易吸取Al-P来进行营养生长;其二受其酸度影响,Fe-P的pH值为3.41,而Al-P的pH为5.43。Fe-P作为难溶性磷源,尽管其水溶性值要高于Al-P,但由于其pH较低,紫云英根系在这样的微域环境中会受到明显的抑制。其三与紫云英根系分泌物有关。低磷胁迫时,闽紫6号和闽紫1号比浙紫5号、弋江籽和余江大叶吸收的难溶性磷酸盐多,这可能与这两种基因型根分泌物的种类或数量有关,尤其是某些特异根分泌物的分泌有关。Ae等[7]研究发现,木豆在缺磷的土壤上生长良好,主要原因是木豆能大量分泌番石榴酸类物质,这些物质能与Fe3+离子螯合,释放磷酸根,从而改善作物磷素营养。植物对难溶性磷吸收过程会在很大程度上受到其它因素如根系形态、根系磷素吸收动力学特性等的影响[27]。根系形态学方面的改变无疑会改善根系对土壤中水溶性P的吸收状况,使植物更有利于吸收土壤中的P素,而对于难溶性磷的吸收则有其它机制,如缺P诱导根系酸性磷酸酶的释放和有机酸分泌等,它们对活化吸收土壤中难溶性P有特殊功效[28,29]。这些根际营养变化特征的差异为进一步探讨磷高效基因型高效吸磷机理提供了科学依据。
4 结论
(1)不同紫云英基因型对难溶性磷酸盐吸收利用差异显著。紫云英在难溶性Al-P和Fe-P的生长状况介于CK和K-P之间。在吸收利用难溶性磷时,地上部、地下部及总吸磷量均是Al-P>Fe-P。
(2)闽紫6号和闽紫1号对难溶性磷的磷吸收量及生物量均高于浙紫5号、弋江籽和余江大叶。因此,从目前紫云英种质资源中筛选高效利用难溶性磷的基因型是可行的。
(3)紫云英生物量增加时,植株吸收的磷养分质量分数也随着增加,二者拟合相关显著。CK和Al-P处理总干物质量与总吸磷量拟合回归关系显著,但对水溶性K-P处理和Fe-P相关回归关系效果不明显。
[1] 刘建中, 李振声, 李继云.利用植物自身潜力提高土壤中磷的生物有效性[J].生态农业研究, 1994, 2(1): 16-23.LIU Jianzhong, LI Zhensheng, LI Jiyun. Utilization of plant potentialities to enhance the bio-efficiency of phosphorus in soil[J]. Chinese Journal of Eco-Agriculture, 1994, 2(1): 16-23.
[2] 李继云, 刘秀娣, 周伟, 等.有效利用土壤营养元素的作物育种新技术研究[J].中国科学: B辑, 1995, 25(1): 41-48.Li Jiyun, LIU Xiudi, ZHOU Wei, et al. Research on crop breeding research of new technologies through effective use of soil nutrients[J].Sciences in China: Series B, 1995, 25(1): 41-48.
[3] HINSINGER P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: a review[J].Plant Soil,2001, 237(2):173-195.
[4] 李庆逵.现代磷肥研究的进展[J].土壤学进展, 1986, (2): 1-7.LI Qingkui. Progress of the study of modern phosphate fertilizer[J].Progress in Soil Sciences, 1986, (2): 1-7.
[5] 孔宏敏, 何圆球, 吴大付, 等.长期施肥对红壤旱地作物产量和土壤肥力的影响[J].应用生态学报, 2004, 15(5): 782-786.KONG Hongmin, HE Yuanqiu, WU Dafu, et al. Effect of long-term fertilization on crop yield and soil fertility of upland red soil[J].Chinese Journal of Applied Ecology, 2004,15(5):782-786.
[6] 严小龙, 张福锁.植物营养遗传学[M].北京: 中国农业出版社,1997:36-79.YAN Xiaolong, ZHANG Fusuo. Plant nutritional genetics[M].Beijing:Chinese Agricultural Press, 1997, 36-79.
[7] AE N, ARIHARA J,OKADA K, et al. Phosphorus uptake bypigeonpeaand its role in cropping systems of the Indian subcontinent[J].Science, 1990, 248(54): 477-480.
[8] OTANI T, AE N. Phosphorus (P) uptake mechanisms of crops grown in soils with low P status: I .Screening of crops for efficient P uptake[J]. Soil Science and Plant Nutrition, 1996, 42(1): 155-163.
[9] SUBBARAO U V, AE N, OTANI T. Genetic variation in acquisition,and utilization of phosphorus from iron-bound phosphorus inpigeonpea[J]. Soil Science and Plant Nutrition, 1997, 43(3): 511-519.[10] WISSUWA M, AE N. Genotypic variation for phosphorus uptake from hardly soluble iron-phosphate in groundnut (Arachis hypogae,I.)[J].Plant and Soil, 1999, 206(2): 163-171.
[11] OSBORNE I D, RENGEL Z. Genotypic differences in wheat for uptake and utilization of P from iron phosphate[J]. Australia Journal of Agricultural Research, 2002, 53(7): 837-844.
[12] SHEN H, YAN X L, ZHAO M, et al. Exudation of organic acids incommonbeanas related to mobilization of aluminum- and iron-bound phosphates[J]. Environmental Expeprimental Botany, 2002, 48(1):1-9.
[13] 赵明, 沈宏, 严小龙.不同菜豆基因型根系对难溶性磷的活化吸收[J]. 植物营养与肥料学报, 2002, 8(4): 435-440.ZHAO Ming, SHEN Hong, YAN Xiaolong. Mobilization and uptake of insoluble phosphorus by different common bean genotypes[J].Plant Nutrition and Fertilizer Science, 2002, 8(4): 435-440.
[14] 普晓英, 赵大伟, 曾亚文, 等. 低磷胁迫下大麦磷高效基因型的筛选[J]. 生态环境学报, 2010, 19(6): 1329-1333.PU Xiaoying, ZHAO Dawei, ZENG Yawen, et al. Screening of genotypes with high phosphorus efficiency for barley under low phosphorus stress[J].Ecology and Environmental Sciences, 2010,19(6): 1329-1333.
[15] 曹卫东, 黄鸿翔. 关于我国恢复和发展绿肥若干问题的思考[J].中国土壤与肥料, 2009, (4): 1-3.CAO Weidong, HUANG Hongxiang. Ideas on restoration and development of green manures in China[J]. Soils and Fertilizers Sciences in China, 2009, (4):1-3.
[16] 林多胡, 顾荣申.中国紫云英[M]. 福州: 福建科学出版社, 2000:1-20.LIN Duofu, GU Rongshen.Chinese Milk Vetch[M]. Fuzhou: Fujian Scientific Press, 2000: 1-20.
[17] 陈坚, 张辉, 朱炳耀, 等. 紫云英 SSR分子标记的开发及在品种鉴别中的应用[J]. 作物学报, 2011, 37(8) : 1-5.CHEN Jian, ZHANG Hui ZHU Bingyao, et al. Development of microsatellite makers forAstragalus L.and its application for variety identification[J]. Acta Agronomic Sinica, 2011, 37(8) 1-5.
[18] MURPHY J, RILEY J P. A modified single solution method for determination of phosphate in natural waters[J]. Analytica Chimica Acta, 1962, 27:31-36.
[19] 李健梅, 曹一平.磷胁迫条件下油菜, 肥田萝卡对难溶性磷的活化与利用[J].植物营养与肥料学报, 1995, 1(3):36-41.LI Jianmei, CAO Yiping. Mobilization and utilization of sparingly soluble P byrapeandradishunder P-defeciency[J]. Plant Nutrition and Fertilizer Science, 1995, 1(3): 36-41.
[20] 王庆仁, 李继云, 李振声.植物高效利用土壤难溶态磷研究动态及展望[J]. 植物营养与肥料学报, 1998, 4(2): 107-116.WANG Qingren, LI Jiyun, LI Zhensheng. Dynamics and prospect on studies of high acquisition of soil unavailable phosphorus by plants[J].Plant Nutrition and Fertilizer Science, 1998, 4(2): 107-116.
[21] 李永夫, 罗安程, 魏兴华, 等.水稻利用难溶性磷酸盐的基因型差异及其与根系分泌物活化特性的关系[J].中国水稻科学, 2006, 20(5):493-498.LI Yongfu, LUO Ancheng, WEI Xinghua, et al. Genotypic variation of rice in utilization of sparingly soluble phosphate and its relationship with mobilization characteristic of root exudation[J]. Chinese Journal of Rice Science, 2006, 20(5) : 493-498.
[22] GARDNER W K, PARBERY D G, BARBER D A. The acquisition of phosphorus byLupinus albus L.:I .Some characteristics of the soil/root interface[J]. Plant and Soil, 1982, 68(1): 19-32.
[23] GARDNER W K, PARBERY D G, BARBER D A. The acquisition of phosphorus byLupinus, albus L.II.The effect of varying phosphorus supply and soil type on some characteristics of the soil/root interface[J]. Plant and Soil, 1982, 68(1): 33-41.
[24] GARDNER W K, BARBER D A, PARBERY D G. The acquisition of phosphorus byLupinus albus L.III.The probable mechanism by which phosphorus movement in the soil/root interface is enhanced[J]. Plant and Soil, 1983, 70(1): 107-124.
[25] GAHOONIA T S, ASMAR F, GIESE H, et al. Root-released organic acids and phosphorus uptake of two barley cultivars in laboratory and field experiments[J]. European Journal of Agronomy, 2000, 12(3/4):281-289.
[26] 郭再华, 贺立源, 徐才国.不同耐低磷水稻基因型秧苗对难溶性磷的吸收和利用[J]. 作物学报, 2005, 31: 1322-1327.GUO Zaihua, HE Liyuan, XU Caiguo. Uptake and use of sparingly soluble phosphorus by rice genotypes with different P-efficiency[J].Acta Agronomica Sinica, 2005, 31: 1322-1327.
[27] 沈宏, 杨存义, 范小威, 等. 大豆根系分泌物和根细胞壁对难溶性磷的活化[J].生态环境, 2004, 13(4): 633-635.SHEN Hong, YANG Cunyi, FAN Xiaowei, et al. Mobilization of sparingly soluble phosphates by root exudates and root cell wall of soybean seedings[J]. Ecology and Enviroment, 2004, 13(4): 633-635.
[28] GEIERSON P F. Organic acids in the rhizosphere of Banksia integri-folia L.F[J].Plant and Soil, 1992, 144: 259-265.
[29] DUFF S M G, SARATH G, PLAXTON W C. The role of acid phosphatases in plant phosphorus metabolism[J]. Physiologia Plantarum, 1994, 90: 791-800.

