hTERT启动子引导的NIS基因重组腺病毒的构建
董伟伟,谭 建,王 澎,李 玮
(天津医科大学总医院核医学科,天津300052)
端粒酶是一种核糖核蛋白体,由RNA与蛋白质构成的复合体,是一种特殊的反转录RNA依赖性DNA聚合酶[1]。而端粒酶逆转录酶(hTERT)是其催化亚单位,是端粒酶激活的限速因素。现在研究证实,hTERT启动子可以接到很多治疗基因的表达,比如caspase-8、bax、白喉毒素A、胸苷激酶、rev-caspase-6、FADD和TRAIL,细胞毒性作用被限制在端粒酶表达阳性的肿瘤细胞系内。所以,hTERT启动子在肿瘤的靶向性治疗中是一个很有希望的肿瘤特异性启动子[2-3]。钠碘转运体基因(NIS)是一个膜内糖蛋白,它将碘转运入甲状腺滤泡细胞内是Na+/K+ATP依赖性[4]。转染NIS后非甲状腺来源的恶性肿瘤可以摄取碘,这一点在如前列腺癌、结肠癌[5]、乳腺癌、肝癌[6]、肺癌[7]等肿瘤中得到证实。但是NIS基因介导的基因治疗依然存在着很多问题,例如在非甲状腺细胞中表达NIS基因虽然能引起快速的碘内流,但是也伴随着快速的碘外流,这就限制了其对肿瘤细胞的杀伤作用[8]。Nakamoto等[9]研究发现NIS基因和TPO基因的共转染不仅能提供细胞摄碘率,还能延长碘在细胞内的滞留时间。所以,笔者计划利用hTERT启动子具有肿瘤靶向性表达特点,以及NIS及TPO基因共转染可以保证在放射性碘元素聚集在肿瘤组织内并延长碘的潴留时间的特点,构建相应的重组腺病毒。
1 材料和方法
1.1 材料 人胶质瘤细胞系U251由天津医科大学总医院神经外科实验室提供,人胶质瘤细胞系U87为本实验室自己保存,DMEM高糖型及低糖型培养基和lipofectamine TM 2000及TRIzol购自美国Invitrogen公司,实验所用酶类购自日本TaKaRa公司,荧光分析系统购自美国Promage公司;Western blot分析所用EPS 2A200 electrophoresis系统购自美国Amersham Biosciences公司。
1.2 方法
1.2.1 实时定量PCR分析hTERT基因的表达 总RNA使用TRIzol从细胞中提取,然后使用Prime-Script RT-PCR Kit试剂盒反转录成cDNA。RT-PCR在96孔板中进行,使用SYBR Premix Ex Taq试剂盒按照说明书进行。所有的PCR在Stepone plus RT PCR system(美国,ABI公司)中进行,采用的是ΔCT方法统计并以β-actin RNA为对照组。hTERT基因的引物:上游为 5′-CCACCTTGACAAAGTACAG-3′,下游为 5′-CGTCCAGACTCCGCTTCAT-3′。β-actin基因的引物:上游为5′-TCATGAAGTGTGACGTGGAC-3′,下游为 5′-ACCGACTGCTGTCACCTTCA-3′。
1.2.2 hTERT启动子的克隆 hTERT启动子区域采用PCR的方法使用LA-Taq从人类全基因组中提取。hTERT启动子在5′和3′分别添加BglⅡ和HindⅢ限制性内切酶位点。hTERT启动子204是截取-204~+56(GenBank AF015950)的区域,包含核心启动子和两个E-boxes。hTERT启动子378是截取-378~+78的区域。hTERT启动子1375是截取-1375~+78区域,包含全长启动子序列。PCR条件为:1cycle:94℃2min;30cycles:94℃30s,55℃30s,70℃1 min;1 cycle:72℃10 min and hold 4℃。PCR产物克隆入pMD-18T载体(日本,Takara),再被BglⅡ和HindⅢ内切酶消化。然后与同样被BglⅡ和HindⅢ内切酶消化的pGL3-Basic vector载体相连接,被命名为pGL3-hTERT 204,pGL3-hTERT 378和pGL3-hTERT 1375。
1.2.3 荧光分析 不同长度的hTERT启动子在肿瘤细胞中表达的荧光表达实验由Dual-Glo Luciferase assay system(美国,Promage公司)检测。将细胞移植在24孔板中,使用lipefection 2000将pGL3-hTERT 204,pGL3-hTERT 378,pGL3-hTERT 1375和pRL-TK,对照组质粒pGl3-control(携带SV40启动子)转染,37℃孵育6 h。转染后细胞继续孵育24 h,测定荧光量。
1.2.4 重组腺病毒的构建 NIS基因(上游:5′-CCATGGATGGAGGCCGTGGAG-3′,下游:5′-TCTAGACTCCTGCTGGTCTCG-3′) 是从全长 NIS cDNA文库中被克隆出来,并在上下游添加NcoⅠ和XbaⅠ酶切位点,然后与NcoⅠ和XbaⅠ消化后的pGL3-hTERT质粒相连接,并命名为pGL3-hTERT-NIS质粒,这个质粒包含从-204到+56的hTERT启动子片段和NIS基因。携带在hTERT启动子引导下NIS基因的片段被从pGL3-hTERT-NIS质粒中克隆出来,并在上下游添加Xho 1和sal 1酶切位点,然后插入pShuttle中间质粒。NIS基因添加Xho 1和sal 1酶切位点并插入pShuttle-CMV中间质粒。AdhTERT-NIS,Ad-CMV-NIS ,Ad-CMV-TPO 及 Ad-CMV-EFGP重组质粒使用 AdEasyTMAdenoviral Vector System构建成功并在-80℃保存。
1.2.5 重组腺病毒转染U251及U87细胞系及MRC-5细胞 实际分为Ad-hTERT-NIS转染组、阳性对照Ad-CMV-NIS转染组、阴性对照Ad-CMV-EFGR转染组。U251及U87细胞在6空板中培养到5×105~1×106个细胞每孔时准备转染。AdhTERT-NIS、Ad-CMV-NIS、Ad-CMV-EFGR 重组病毒转染是按50 MOI进行转染并孵育6 h,然后更换新的含10%FBS的DMEM培养基。进行转染后,细胞继续在新培养基中培养24 h并准备实验。重组腺病毒Ad-CMV-TPO的转染同上。
1.2.6 Western blot分析 使用 EPS 2A200 electrophoresis系统进行western blot分析。提取细胞总蛋白,然后SDS-PAGE10%凝胶电泳,使用80 V进胶,140 V电泳至溴酚蓝距下缘1 cm处终止。转PVDF膜,5%脱脂牛奶4℃封闭过夜。NIS基因一抗选用1∶200的羊NIS多克隆抗体 (美国,sc-48055,Santacruz),室温下孵育2h。NIS基因二抗选用1∶2000的羊抗兔抗体(美国,sc-2004,Santa cruz),室温下孵育2 h。TBST洗4次,每次5 min。然后加入ECL化学发光反应液(美国,Thermo公司),室温1 min。使用富士相纸暗室曝光1~3 min。
2 结果
2.1 hTERT基因在 U251,U87和MRC-5中的表达 RT-PCR实验中证明hTERT mRNA能在端粒酶阳性的肿瘤U251、U87细胞中表达,在端粒酶阴性的正常细胞MRC-5细胞无表达,见图1。Realtime-PCR分析实验证明,hTERT mRNA在U251和U87细胞中表达程度相似,但是U87细胞的表达水平稍高于U251细胞,见表1。
2.2 荧光表达分析 瞬时转染实验证明,在端粒酶阳性的U251和U87细胞中hTERT启动子可以引导荧光基因的表达,而在端粒酶阴性的MRC-5细胞中不能表达。但是,hTERT启动子204,378,1375拥有不同的启动效率,hTERT启动子204启动效果最好,其相对表达活性在U87和U251中能达到公认强启动子SV40启动子的50%。见图2。

图1 hTERT mRNA在U251、U87及MRC-5细胞中RT-PCR电泳图Fig 1 RT-PCR electrophoresis of hTERT mRNA in cells of U251,U87 and MRC-5

表1 U251和U87细胞系hTERT基因及β-acting基因的相对mRNA表达水平Tab 1 Relative mRNA expression levels of hTERT gene and βacting gene in U251 and U87 cell lines
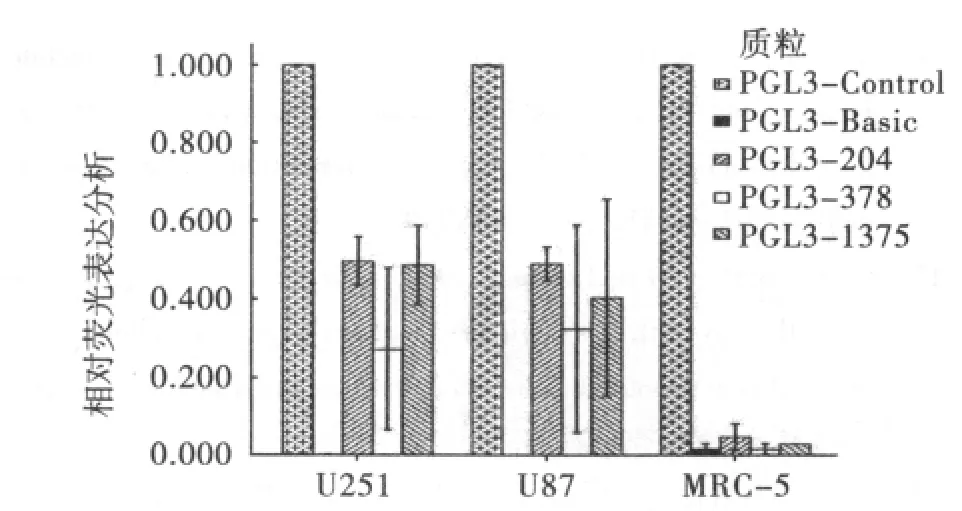
图2 U251和U87细胞中hTERT启动子荧光表达分析Fig 2 Luciferase activity of hTERT promoter in human malignant gloma cell line U251 and U87
2.3 重组腺病毒Ad-hTERT-NIS及Ad-CMV-TPO转染后western blot分析 在U87和U251细胞系中,NIS蛋白在70kDa有表达带,TPO基因在110kDa有表达带,但是NIS蛋白表达量相对对照组蛋白表达量较低。见图3。

图3 NIS表达水平的western blot分析Fig 3 Western blot analysis for human sodium/iodide symporter(hNIS)levels
3 讨论
特异性启动子介导目的基因表达的这种基因治疗方式可以实现肿瘤的靶向性治疗,该治疗能在保证最大的组织特异性毒性的同时最大程度地减少对正常组织的损伤。用hTERT启动子作为基因转录调控元件的肿瘤靶向性基因治疗是近年来肿瘤研究的热点之一,大量研究显示hTERT启动子在多种恶性肿瘤细胞中有转录活性,并被成功应用于凋亡相关基因Caspase-6、自杀基因HSV-TK等不同抗癌基因的肿瘤特异性表达载体的构建,用于肺癌、肝癌、卵巢癌等多种恶性肿瘤靶向性基因治疗的研究[10-11]。应用像hTERT启动子类似的肿瘤特异性启动子,为实现肿瘤选择性基因治疗表达提供了有效的途径。hTERT启动子介导的NIS基因转染肿瘤细胞然后进行放射性碘治疗,已经进行了很多研究,比如:Anne等[12]用逆转录病毒介导NIS对宫颈癌细胞放射性碘治疗的研究,显示了Ad-CMV-NIS转染入肿瘤细胞后能有效地促其摄碘,这使得一种崭新的癌基因靶向性治疗成为可能。Shi等[13]用腺病毒介导的hTERT-NIS对肺癌杀伤力的研究,显示由腺病毒介导hTERT启动子启动的NIS的表达有希望成为一种有效、广谱而又非常特殊的抗癌策略,Kim等[14]用hTERT-NIS转染入肝癌细胞后行放射性核素显像和治疗,表明肿瘤细胞转染hTERT-NIS后摄碘能力是未转染的22倍。hTERT启动子序列能有效地引导其转染基因在肿瘤的靶向性表达,然后NIS基因介导放射性碘治疗杀伤肿瘤细胞。
为了研究hTERT启动子引导NIS基因介导放射性碘治疗胶质瘤的可能性,笔者构建了一个在hTERT启动子引导NIS基因表达的重组腺病毒Ad-hTERT-NIS,研究其在胶质瘤细胞系U251和U87细胞中是否有有效的碘摄取。NIS是一个转运体基因,在甲状腺细胞中能主动摄取碘。在甲状腺中NIS介导的碘浓集是其显像的基础,同时也是分化甲状腺癌及其转移灶放射性碘治疗的基础。NIS③已经在1996年从人类甲状腺基因文库中克隆出来。在肿瘤细胞中目标性表达功能性NIS基因能使这些细胞浓集碘并提供了放射性碘治疗的可能性。很多研究者已经发现转染NIS基因到肿瘤细胞后比较非转染细胞能增加放射碘的摄取。但是研究者同时也发现转染NIS基因后的肿瘤细胞中当介质中的放射性碘被移走后,细胞存在快速的碘流失现象。后来,研究者们发现共转染NIS和hTPO基因能增加放射性的碘摄取和潴留并增加肿瘤细胞的杀伤率。因此本实验还构建了Ad-CMV TPO重组病毒,为在后续实验中验证NIS和TPO的共转染是否能增加碘的摄取和潴留打下基础。
在本研究中,笔者经过PCR技术扩增hTERT目的片段,通过细胞瞬时转染荧光表达实验,发现hTERT启动子204较其他片段的启动效率要高,然后,建立重组腺病毒Ad-hTERT-NIS转染组、阳性对照Ad-CMV-NIS转染组、阴性对照Ad-CMV-EFGR转染组及Ad-CMV-TPO分别转染U251及U87细胞系及MRC-5细胞,通过NIS基因的蛋白质western blot分析发现,U87和U251细胞中有NIS蛋白的表达,即hTERT启动子可以引导NIS基因的表达,在端粒酶阳性的胶质瘤细胞中可以引导NIS基因的表达,而在端粒酶阴性的MRC-5细胞中则不能表达NIS基因;说明重组腺病毒Ad-hTERTNIS构建成功。
综上所述,hTERT启动子引导NIS基因确实能实现在端粒酶阳性细胞中特异性表达的目的,能实现有效的肿瘤组织特异性。NIS不仅在甲状腺对碘的主动转运过程中发挥关键作用,而且在多种甲状腺疾病的发生发展中扮演十分重要的角色,对NIS进行深入研究,无疑具有诱人的临床应用前景。hTERT启动子引导NIS基因对神经胶质瘤的治疗还期待进一步提高,有学者研究131I-IPA结合外部射线放射性治疗能提高胶质瘤的治疗效果[15],笔者期待更好的治疗胶质瘤方法出现。
[1]李瑞,张军霞,石磊,等.新型超微载体FA-PAMAM介导hTERT siRNA对人脑胶质瘤细胞U251抑制作用的体外研究[J].中国现代神经疾病杂志,2008,8(4):339
[2]Komata T,Kanzawa T,Kondo Y,et al.Telomerase as a therapeutic target for malignant gliomas[J].Oncogene,2002,21(4):656
[3]Gu J,Fang B.Telomerase promoter-driven cancer gene therapy[J].Cancer Biol Ther,2003,2(4):64
[4]Chen L,Altmann A,Mier W,et al.Radioiodine therapy of hepatoma using targeted transfer of the human sodium/iodide symporter gene[J].J Nucl Med,2006,47(5):854
[5]Scholz I,Cengic N,Baker C,et al.Radioiodine therapy of colon cancer following tissue-specific sodium iodide symporter gene transfer[J].Gene Ther,2005,12(3):272
[6]Ma XJ,Huang R,Kuang AR.AFP promoter enhancer increased specific expression of the human sodium iodide symporter(NIS)for targeted radioiodine therapy of hepatocellular carcinoma[J].Cancer Invest,2009,27(6):673
[7]张俊,王爱东,申咏梅,等.hTERT核心启动子调控的hNIS重组腺病毒的构建与鉴定[J].中国免疫学杂志,2008,24(6):549
[8]王志峰.甲状腺钠/碘转运蛋白研究进展[J].甘肃医药,2010,29(13):270
[9]Nakamoto Y,Saga T,Misaki T,et al.Establishment and characterization of a breast cancer cell line exp ressing Na+/I-symporters for radioiodide concentrator gene therapy[J].Nucl Med,2000,41(11):1898
[10]Udono M,Fujiki T,Yamashita M,et al.Construction of a regulabatable cancer-specific adenviral expression system using human telomerase reverse transcriptase gene promoter[J].Biosci Biotechnol Biochem,2008,72(6):1638
[11]唐小军,王艳萍,周清华,等.端粒酶催化亚单位基因启动子调控Hsv-tk/GV系统对肺癌细胞A549选择性杀伤作用的研究[J].中华医学遗传学杂志,2007,24(2):148
[12]Anne B,Marcel R,Paule O,et al.Adenovirus-mediated transfer of the thyroid sodium/iodide symporter gene into tumors for a targeted radiotherapy[J].Cancer Res,2000,60(1):3484
[13]Shi YZ,Zhang J,Liu ZL,et al.Adenovirus-mediated and tumorspecific transgene expression of the sodium-iodide symporter from the human telomerase reverse transcriptase promoter enhances killing of lung cancer cell line in vitro[J].Chin Med J,2010,123(15):2070
[14]Kim SH,Chung HK,Kang JH,et al.Tumor-targeted radionuclide imaging and therapy based on human sodium iodide symporter gene driven by a modified telomerase reverse transcriptase promoter[J].Hum Gene Ther,2008,19(9):951
[15]Samuel S,Bernd FR,Thomas L,et al.Efficacy of systemic radionuclide therapy with p-131I-iodo-L-phenylalanine combined with external beam photon irradiation in treating malignant gliomas[J].J Nucl Med,2009,50(12):2025

