癌基因H-ras启动子区重新甲基化抑制胃癌细胞生长的实验研究
袁 梦 ,罗 瑾 ,李燕妮 ,耿 鑫 ,张维铭
(1.天津医科大学生物化学教研室,教育部免疫微环境与疾病重点实验室,天津300070;2.天津市口腔医院中心实验室,天津300041)
表观遗传学是研究不涉及DNA序列改变并且可以通过细胞有丝分裂或减数分裂传代的基因功能(表达)改变的学科,包括DNA甲基化、组蛋白乙酰化,染色质重塑和RNA干扰等。其中DNA甲基化作为表观遗传学重要的分子机制之一越来越受到人们的关注[1-2]。肿瘤的发生与基因组和表观遗传的改变有着很大的联系。DNA甲基化是真核生物基因表达调控中一种常见而又重要的机制,基因组正常甲基化模式的改变与各类肿瘤的演变发展有着密切的联系[3-4]。高甲基化可以抑制肿瘤抑癌基因启动子区域的转录,从而使抑癌基因沉默;而低甲基化会增加基因组的不稳定性,诱导癌基因和肿瘤相关基因的激活,是引起肿瘤发生的原因之一。本研究通过使用甲基供体S-腺苷甲硫氨酸(S-Adenosylmethionine,SAM)处理人胃癌细胞系MGC-803和人正常胃黏膜上皮细胞系GES-1,以观察SAM对肿瘤和正常细胞生长的生物学影响,并研究癌基因H-ras启动子区甲基化的改变及相应蛋白的表达情况,以期在肿瘤的临床诊断和药物治疗中探讨出新的方法和思路。
1 材料与方法
1.1 材料
1.1.1 细胞系 人胃癌细胞系MGC-803由天津市环湖医院神经外科研究所馈赠,人正常胃黏膜细胞系GES-1购自北京肿瘤医院遗传室。
1.1.2 试剂 SAM和Wizard DNA Clean-up System(美国Promega公司);细胞培养基(Gibco公司);胎牛血清(杭州四季青公司);胰蛋白酶(HyClone公司);基因组DNA提取试剂盒(QIAGEN公司);DNA聚合酶(TaKaRa公司);细胞免疫荧光染色试剂(北京中山金桥生物有限公司)。
1.2 方法
1.2.1 细胞培养及药物处理 MGC-803细胞贴壁生长于含10%胎牛血清及青、链霉素各100 U/mL的RPMI1640培养基中,GES-1细胞贴壁生长于含10%胎牛血清及青、链霉素各100 U/mL的DMEM低糖培养基中,传代24 h后,随机选取两个细胞系中的部分细胞,向细胞中加入SAM,使其终浓度为10 μmol/L,作为实验组,记为 T1(MGC-803药物处理组)和T2(GES-1药物处理组);未经药物处理的细胞作为对照组,分别记为C1(MGC-803对照组)和C2(GES-1对照组),继续培养,用于后续实验。
1.2.2 MTT法 取各组对数生长期细胞按5×103个/孔接种于96孔板中,接种7板。每日取1板,加入MTT(5 mg/mL)20 μL,37 ℃孵育 4 h 后弃上清,再加入DMSO 150 μL,于微型振荡器上振荡10 min后,在570 nm酶标仪上检测各孔吸光度A值,绘制细胞生长曲线图并计算细胞生长抑制率,按照公式:细胞生长抑制率(%)=(1-实验组A值/对照组A值)×100%。实验重复3次。
1.2.3 甲基特异性PCR 应用DNA提取试剂盒抽提各组细胞的基因组DNA。用新鲜配制的氢醌(10 mmol/L)30 μL 和亚硫酸氢钠(3 mol/L)520 μL水浴脱氨18 h,Wizard DNA Clean-up system过滤柱纯化,无水乙醇沉淀,溶解于30 μL去离子水中。以此为模板,分别用甲基化和非甲基化引物扩增H-ras启动子序列(引物序列见表1)。扩增条件为:预变性95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30 个循环;72℃再延伸10 min。

表1 MSP引物序列Tab 1 The primer sequence of MSP
1.2.4 细胞免疫荧光染色 将各组细胞用0.25%胰蛋白酶消化后,传代于24孔板,每组2孔,记为H-ras。继续培养待细胞贴壁稳定后,经过固定、阻断各种内源性过氧化物酶活性、打孔、封闭等步骤后在H-ras孔中加入兔抗人H-ras单克隆抗体(1∶100稀释),每孔 300 μL,4℃过夜后,PBS冲洗 3次,在各组的H-ras孔内加入TRITC标记(红色荧光)的羊抗兔二抗,每孔1 mL,室温避光反应2 h,弃去二抗,PBS冲洗3次,再加入1 mL PBS,在200倍普通光镜下计数每视野细胞总数,荧光下计数阳性细胞数,3视野/孔,求平均值,计算着色细胞阳性率。
1.3 统计学方法 采用SPSS13.0统计软件包,对所得的数据采用方差分析和χ2检验进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 SAM对细胞生长的影响 人胃癌细胞中,加入SAM的处理组T1与未经药物处理的对照组C1相比,细胞的生长增殖活性受到明显抑制;而人正常胃黏膜上皮细胞,处理组T2与对照组C2的细胞生长情况无明显差异(图1、2)。胃癌细胞MGC-803的生长抑制率为22.0%,而正常细胞的生长抑制率为6.8%,两者差异具有统计学意义(P<0.05)。
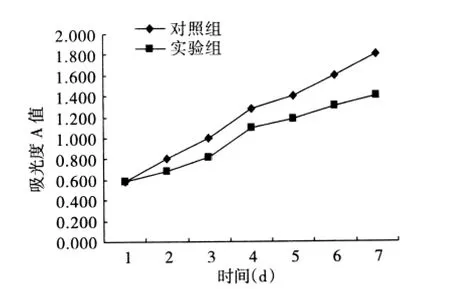
图1 胃癌细胞MGC-803生长曲线图Fig 1 The growth curve of gastric cancer cells MGC-803 by MTT assay
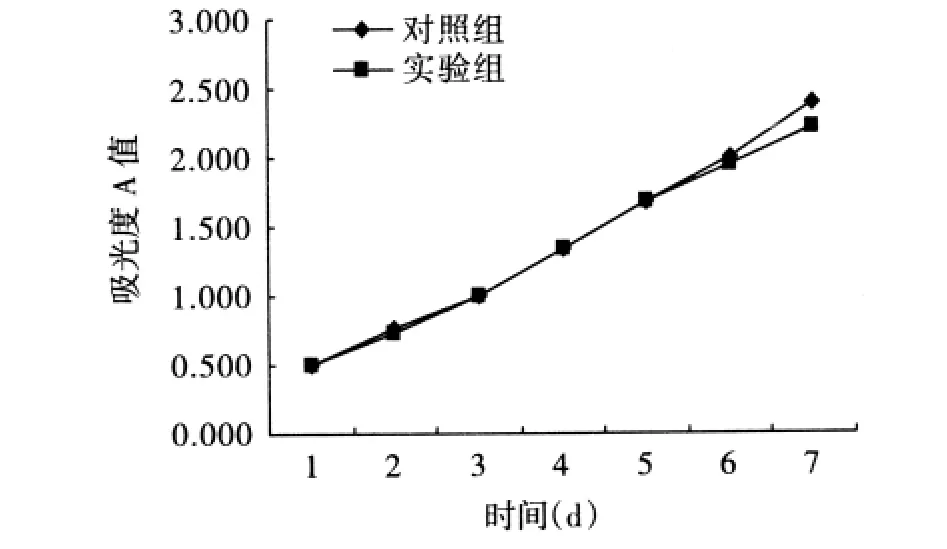
图2 正常胃黏膜上皮细胞GES-1生长曲线图Fig 2 The growth curve of human normal gastric mucosa epithelial cells by MTT assay
2.2 MSP检测癌基因启动子区域的甲基化状态 人胃癌细胞中,癌基因H-ras启动子区处于非甲基化状态,经过SAM处理后实验组中癌基因的启动子区呈现出高甲基化状态;正常细胞中,实验组和对照组的H-ras启动子区均表现为高甲基化(图3)。
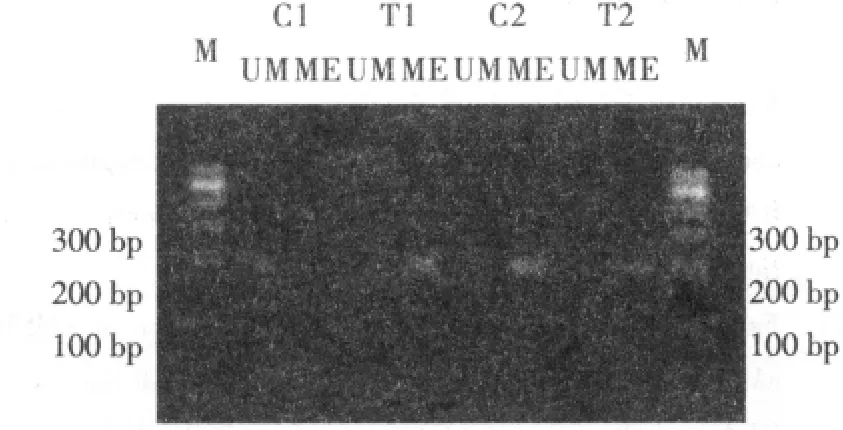
图3 MSP扩增H-ras启动子的电泳图Fig 3 The electropherogram of H-ras promoter by MSP
2.3 细胞免疫荧光染色检测癌基因蛋白的表达 HRAS蛋白主要表达于未经SAM处理的胃癌细胞中,阳性信号多集中在胞浆中,H-RAS蛋白表现为红色荧光,而正常细胞系和经过药物处理的胃癌细胞系几乎不着色(图4),着色细胞阳性率见表2。未经SAM处理的实验组中,H-RAS在正常细胞组C2的着色细胞阳性率明显低于胃癌MGC-803细胞组C1,差异均有统计学意义(P<0.05);经 SAM 处理的胃癌细胞MGC-803中H-RAS的阳性率与对照组相比显著降低,差异有统计学意义(P<0.05),对于正常细胞(T2,C2),药物处理所引起的H-RAS细胞阳性率变化均不明显,差异无统计学意义(P>0.05)。

图4 H-RAS蛋白免疫荧光染色图Fig 4 Expression of H-RAS protein by cell immunofluorescence assay

表2 H-RAS蛋白免疫荧光染色法所得着色细胞阳性率Tab 2 The cell positive of H-RAS from cell immunofluorescence
3 讨论
胃癌是全球范围内最常见的恶性肿瘤,其发病率居全球肿瘤发病和癌症死亡率的第二位。原癌基因H-ras突变与胃癌发生密切相关,在胃癌发生发展中起着重要作用。Ras癌基因由K-ras、H-ras和N-ras家族组成,是膜结合型的GTP/GDP结合蛋白,其作用是在细胞生长以及代谢过程中将表皮生长因子和胰岛素的刺激信号传入相应的靶细胞并与细胞内的磷脂酶C结合,从而启动肿瘤发生。目前已在包括胃癌、大肠癌在内的多种肿瘤中证实了Ras基因的异常改变[5]。
DNA甲基化是真核生物转录调控的一个重要的表观遗传学机制,许多研究已经证明癌基因启动子区的低甲基化和抑癌基因的高甲基化是诱发细胞癌变的重要方式[6-8]。Tao等[9]研究发现化学致癌物诱发大鼠肝癌结节中 raf、c-myc、c-fos、c-H-ras、c-K-ras基因启动子区域低甲基化,且与其蛋白表达升高相关。另外,在上皮性肿瘤乳腺癌、肾细胞癌和卵巢癌中,癌基因RHOA启动子区低甲基化且转录活化,表达增高[10]。本课题组前期研究发现,胃癌细胞中癌基因c-myc启动子区呈现低甲基化而高表达,而抑癌基因p16启动子区呈异常高甲基化状态[11]。本次实验笔者观察了胃癌细胞MGC-803中H-ras基因的表达情况,正常细胞系中癌基因H-ras表现出高甲基化,而胃癌细胞系癌基因H-ras则表现出非甲基化状态,经过SAM药物处理后胃癌细胞系则呈现出高甲基化状态。此外,免疫荧光染色实验显示胃癌细胞MGC-803在SAM处理后H-RAS蛋白的表达也显著降低,表明SAM逆转了基因的低甲基化状态,同时下调了癌基因及其蛋白的表达。这与Zhao等[12]的结果相似,他们发现在给予不同浓度SAM(0、2、4 mmol/L)处理胃癌细胞后,癌基因cmyc启动子区域低水平甲基化发生逆转,重新处于甲基化状态,同时相应蛋白表达量也明显下降。进一步证明了H-ras的致癌作用是可逆的,处于低甲基化状态的癌基因可以重新获得甲基而失去其原有的恶性增殖的特性,从而逆转肿瘤的发展。
SAM是生物体内除甲硫氨酸(蛋氨酸)本身甲基化外所有甲基化反应的甲基供体,许多研究利用SAM来抑制癌基因低甲基化,增加DNA甲基化转移酶的活性[13]。Pouya等[14]以SAM诱导乳腺癌尿激酶(uPA)重新甲基化,发现可以逆转低甲基化状态,抑制乳腺癌的转移。同时,资料表明SAM对胃癌细胞的抑制呈时间和剂量依赖性[12]。本实验用SAM处理胃癌细胞和正常胃黏膜上皮细胞,在MTT实验中通过绘制生长曲线图可以观察到,给予SAM处理后胃癌细胞MGC-803生长增殖情况较对照组受到明显的抑制,而正常胃黏膜上皮细胞GES-1的生长情况却没有明显差异。这表明SAM可以有效地抑制肿瘤细胞的生长而不影响正常细胞的生长状态,有望应用于临床治疗,从而降低药物对患者正常组织的损伤。然而,值得注意的是在癌症发生的早期阶段,抑癌基因还没有完全沉默,给予SAM使癌基因重新甲基化的同时可能导致肿瘤抑癌基因的高甲基化[14]。这引发了进一步的思考,如何调整SAM的浓度和剂量来实现癌基因的重新甲基化同时又不抑制抑癌基因的活性,为后续实验提供了新的方向。
综上所述,通过检测H-ras重新甲基化后细胞生长状况以及基因和蛋白的表达,可以得出癌基因启动子区域重新甲基化能够逆转癌基因的低甲基化状态,从而抑制肿瘤细胞生长的结论,同时也为降低胃癌的侵袭性和转移性的临床治疗研究提供新的思路。
[1]Laird PW.Principles and challenges of genome-wide DNA methylation analysis[J].Nat Rev Genet,2010,11(3):191
[2]Bhutani N,Brady JJ,Damian M,et al.Reprogramming towards pluripotencyrequiresAID-dependentDNAdemethylation[J].Nature,2010,463(7284):1042
[3]YoshikawaH.DNAmethylationandcancer[J].GanToKagakuRyoho,2007,34(2):145
[4]Tomita H,Hirata A,Yamada Y,et al.Suppressive effect of global DNA hypomethylation on gastric carcinogenesis[J].Carcinogenesis,2010,31(9):1627
[5]Choudhary S,Wang HC.Pro-apoptotic activity of oncogenic HRas for histone deacetylase inhibitor to induce apoptosis of human cancer HT29 cells[J].J Cancer Res Clin Oncol,2007,133(10):725
[6]Esteller M.CpG island hypermethylation and tumor suppressor genes:a booming present,a brighter future[J].Oncogene,2002,21(35):5427
[7]Wong ML,Tao Q,Fu L,et al.Aberrant promoter hypermethylation and silencing of the critical 3p21 tumour suppressor gene,RASSF1A,in Chinese oesophageal squamous cell carcinoma[J].Int J Oncol,2006,28(3):767
[8]Fang JY,Lu R,Mikovits JA,et al.Regulation of hMSH2 and hMLH1 expression in the human colon cancer cell line SW1116 by DNA methyltransferase 1[J].Cancer Lett,2006,233(1):124
[9]Tao L,Yang S,Xie M,et al.Hypomethylation and overexpression of c-jun and c-myc protooncogenes and increased DNA methyltransferase activity in dichloroacetic and trichloroacetic acid-promoted mouselivertumors[J].CancerLett,2000,158(2):185
[10]Braga EA,Loginov VI,Klimov EA,et al.Activation of RHOA gene transcription in epithelial tumors may be caused by gene amplificationand/ordemethylationofitspromoterregion[J].MolBiol(Mosk),2006,40(5):865
[11]李燕妮,王玉川,张维铭.肿瘤细胞中的c-myc与p16启动子重新甲基化[J].肿瘤防治研究,2009,36(9):730
[12]Zhao Y,Li JS,Guo MZ,et al.Inhibitory effect of S-adenos ylmethionine on the growth of human gastric cancer cells in vivo and in vitro[J].Chin J Cancer,2010,29(8):752
[13]Guruswamy S,Swamy MV,Choi CI,et al.S-adenosyl L-methionine inhibits azoxymethane-induced colonic abrrant crypt foci in F344 rats and suppresses human colon cancer Caco-2 cell growth in 3D culture[J].Int J Cancer,2008,122(1):25
[14]Pakneshan P,Szyf M,Farias-Eisner R,et al.Reversal of the hyp omethylation status of urokinase (uPA)promoter blocks breast cancer growth and metastasis[J].J Biol Chem,2004,279(30):31735

