芥蓝菜薹不同节间芥子油苷组分及含量分析
腊贵晓,刘国顺,杨俞娟
(1.河南农业大学烟草学院,河南 郑州 450002;2.浙江大学环境与资源学院,浙江 杭州 310029)
芥子油苷(Glucosinolates,GSs),也称硫代葡萄糖苷,是十字花科植物重要的次生代谢物质.近年来,由于在抗癌、防癌方面的特殊功效,芥子油苷研究成为流行病学、食品科学、农业等多个领域的研究热点[1].国际癌症基金会指出,每天食用10 g左右富含芥子油苷的蔬菜即可有效的预防癌症的发生[2,3].然而由于人们生活节奏的加快和膳食中蔬菜比例的下降[4],芥子油苷摄入量严重不足.选取富含芥子油苷的蔬菜种类或者蔬菜组织成为从饮食角度增加芥子油苷摄入量最有效的途径.芥蓝是中国特有的芸薹属蔬菜,以菜薹为食用部位,其菜薹中芥子油苷种类和含量与国际公认的抗癌蔬菜—青花菜相当[5],被认为是最有潜力的抗癌蔬菜之一[6].研究表明,芥子油苷种类和含量在同一植株中,也因组织部位的不同而各异[7].通常芥蓝菜薹的定位是从底部膨大部位到顶端[8],包含多个节间,但是很少就芥蓝菜薹不同节间的芥子油苷种类及含量进行研究.了解芥蓝菜薹不同节间芥子油苷的种类和含量对于指导人们日常饮食中选取更有益于人类健康的蔬菜组织具有十分重要的意义.为此,本研究选取‘中花’、澄海粗条’和‘全年油青’3个芥蓝品种为材料,对芥蓝菜薹不同节间芥子油苷的种类和含量进行研究,以期为人们日常饮食中选择富含芥子油苷的组织器官,充分发挥芥子油苷的抗癌特性提供事实依据.
1 材料与方法
1.1 仪器与试剂
1.1.1 主要仪器 高效液相色谱仪(Waters1525 Waters公司,USA);液相色谱-质谱联用仪(Agilent 1100 LC/MSD,Agilent公司,USA);低温冷冻干燥机(ALPHA 1-4,Christ公司,德国);高速冷冻离心机(Biofuge Stratos,Heraeus公司,德国)
1.1.2 主要试剂 DEAE-Sephadex A-25、2-丙烯基芥子油苷(Sinigrin)和硫酸酯酶(Sulphatase)购于 Sigma公司;乙腈为色谱纯(Honeywell公司,USA);水为超纯水(Millipore公司,USA)
1.2 芥蓝栽培与样品处理
试验在浙江大学试验农场温室进行,共选取具有代表性的3个芥蓝品种,即‘中花’(ZH)、‘澄海粗条’(CHCT)和‘全年油青’(QNYQ).选取子粒饱满的芥蓝种子,经催芽后在蛭石中育苗.待3叶1心时移栽到装满蛭石的盆子中培养.每3 d浇灌1次霍格兰营养液.待菜薹充分生长、未开花时,从膨大处取生长健壮、无病虫害的芥蓝菜薹,用剪子从底部菜薹膨大处到顶端将菜薹平均分为4节(标记为Ⅰ,Ⅱ,Ⅲ和Ⅳ),迅速放入冰盒中带回实验室.菜薹经-80℃冷冻后,真空冷冻干燥,磨粉后置于干燥器中,贮存于-20℃冰箱待用.
1.3 芥子油苷的提纯及脱硫
称取0.10 g冻干样品,加入1.5 mL体积分数70%甲醇,在70℃的水浴锅中提取10 min,然后4 000 r·min-1离心10 min.沉淀再按照上述方法提取2次,合并上述提取液,定容到5 mL.同时做2个平行.取3 mL提取液流经DEAE Sephadex A-25萃取柱,待提取液全部流出小柱后,加入100 μL硫酸酯酶溶液(28.4个单位).室温反应18 h后用4×0.5 mL 超纯水洗脱.洗脱液过 0.45 μm 微膜后-20 ℃ 冰箱保存,待 HPLC 分析[9,10].利用 2- 丙烯基芥子油苷(Sinigrin)作为外标进行定量.
1.4 液相色谱/质谱条件
1.4.1 HPLC 分离条件[11]色谱柱为 Prontosil ODS2 C18 柱(250 mm ×4.6 mm,粒径5 μm);流动相:超纯水和乙腈体系,梯度条件:0~20 min,乙腈梯度变化:0~20%;20~30 min,乙腈体积分数保持20%.柱温35℃,进样量50 μL,检测波长227 nm,流速 1.0 mL·min-1.
1.4.2 MS鉴定条件 采用 LC-ESI/MS鉴定,鉴定过程根据 MATTHÄUS和 LUFTMANN 报道[3]的特征离子方法进行,数据由Agilent 1100 LC/MSD化学工作站采集.质谱条件如下:离子源:电喷雾电离源(ESI);离子极性:正离子(positive);喷雾器压力(nebulizer pressure):60 psi;干燥气(N2)流速(drying gas flow):13 L·min-1;干燥气温度(drying gas temperature):350℃;毛细管电压(capillary voltage):4 000 V;碎片电压(fragmentor):100 V;扫描离子范围:m/z 100.00 ~600.00.
1.5 数据分析
数据处理及图表绘制利用Word和Excel进行,统计分析应用 DPS 7.05 软件进行[12].
2 结果与分析
2.1 芥蓝菜薹不同节间芥子油苷组分及总含量
芥蓝菜薹中典型的芥子油苷色谱图如图1所示.图1表明,在芥蓝菜薹典型样品中,共测到11种芥子油苷,其中3-甲基亚硫酰丙基芥子油苷、2-羟基-3-丁烯基芥子油苷、2-丙烯基芥子油苷、4-甲基亚硫酰丁基芥子油苷、5-甲基亚硫酰戊基芥子油苷、3-丁烯基芥子油苷和4-甲硫基丁基芥子油苷7种芥子油苷来源于甲硫氨酸,属于脂肪族芥子油苷.而4-羟基-3-甲基吲哚芥子油苷、3-吲哚甲基芥子油苷、4-甲氧基-3-吲哚甲基芥子油苷和1-甲氧基-3-吲哚甲基芥子油苷来源于色氨酸,属于吲哚族芥子油苷.


3个芥蓝品种菜薹不同节间芥子油苷含量见图2.由图2可以看出,在3个芥蓝品种菜薹中,以澄海粗条第4节总芥子油苷含量最高,含量(DW)达到8.15 μmol·g-1,全年油青第 1 节含量最低,含量(DW)仅为 0.75 μmol·g-1.从图 2 还可以看出,在3个芥蓝品种菜薹中,总芥子油苷均以菜薹第4节中含量最高,显著高于其它3个节间,菜薹其它3个节间总芥子油苷含量差异均不显著.
2.2 芥蓝菜薹不同节间脂肪族芥子油苷组分及含量分析
2.2.1 芥蓝菜薹不同节间脂肪族芥子油苷各组分及含量 各脂肪族芥子油苷组分含量见表1.从表1可以看出,除在全年油青第1节中没有检测到4-甲硫基丁基芥子油苷外,在3个芥蓝品种的其它节间均检测到7种脂肪族芥子油苷.在3个芥蓝品种菜薹的脂肪族芥子油苷中,均以3-丁烯基芥子油苷含量最高,而含量最低的脂肪族芥子油苷在不同品种和菜薹不同节间不同,除在中花菜薹第1节中为4-甲硫基丁基芥子油苷和第2节与第4节中为2-羟基-3-丁烯基芥子油苷外,其它各品种菜薹各节间中含量最低的均为5-甲基亚硫酰戊基芥子油苷.
从表1还可以看出,不同种类的脂肪族芥子油苷在芥蓝菜薹不同节间的变化趋势不一致.3-甲基亚硫酰丙基芥子油苷、4-甲基亚硫酰丁基芥子油苷和3-丁烯基芥子油苷含量均在3个芥蓝品种菜薹的第4节含量达到最大值,在第1节中含量最低.2-羟基-3-丁烯基芥子油苷和2-丙烯基芥子油苷在中花菜薹4个节间均无显著差异,而在澄海粗条和全年油青菜薹的第4节中含量最高,显著高于前3节.5-甲基亚硫酰戊基芥子油苷含量在中花和全年油青菜薹的4个节间含量差异不显著,而在澄海粗条菜薹中,在第1节和第4节中含量最高,显著高于第2节和第3节的含量,但是第1节和第4节之间、第2节和第3节之间差异不显著.4-甲硫基芥子油苷除在全年油青的第1节中没有检测到外,在3个芥蓝品种菜薹中均以第3节含量最高.
2.2.2 芥蓝菜薹不同节间总脂肪族芥子油苷含量的差异 从图3可以看出,在3个芥蓝品种中,总脂肪族芥子油苷含量均以菜薹第4节中含量最高,显著高于其它3个节间;在菜薹其它的3个节间,除在中花的第3节中脂肪族芥子油苷含量显著高于第1节外,在其它2个芥蓝品种中,菜薹3个节间脂肪族芥子油苷含量差异并不显著.

表1 芥蓝菜薹不同节间各脂肪族芥子油苷组分及含量Table 1 Individual aliphatic GS in different sections of bolting stems in Chinese kale
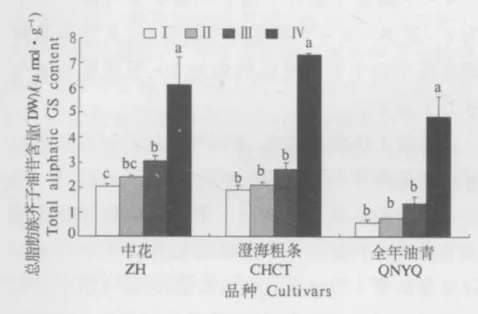
图3 芥蓝菜薹不同节间总脂肪族芥子油苷含量Fig.3 Total aliphatic GS content in different sections of bolting stems in Chinese kale
2.3 芥蓝菜薹不同节间吲哚族芥子油苷组分及含量
2.3.1 芥蓝菜薹不同节间吲哚族芥子油苷各组分及含量 除在全年油青菜薹的第1节和第2节中没有检测到4-羟基-3-吲哚甲基芥子油苷外,在其它芥蓝品种菜薹的节间均检测到4种吲哚族芥子油苷(见表2).在中花中,除在菜薹的第3节中以4-甲氧基-3-吲哚甲基芥子油苷含量最高外,其它菜薹各部位中均以1-甲氧基-3-吲哚甲基芥子油苷含量最高,在各个节间均以4-羟基-3-吲哚甲基芥子油苷含量最低;在澄海粗条中,1-甲氧基-3-吲哚甲基芥子油苷在菜薹第1节、第2节和第4节中含量最高,4-甲氧基-3-吲哚甲基芥子油苷在菜薹第3节中含量最高,在各个节间均以4-羟基-3-吲哚甲基芥子油苷含量最低;在全年油青中,菜薹各个节间中均以1-甲氧基-3-吲哚甲基芥子油苷含量最高,4-羟基-3-吲哚甲基芥子油苷含量最低.
不同种类吲哚芥子油苷组分在菜薹不同节间的变化趋势不同(见表2).在中花和澄海粗条中,在菜薹最顶端4-羟基-3-吲哚甲基芥子油苷含量最高,显著高于其它3节,在菜薹低端含量最低,而在全年油青中,4-羟基-3-吲哚甲基芥子油苷在检测到的两节中含量并无显著差异.3-吲哚甲基芥子油苷在3个芥蓝品种菜薹中均以第4节含量最高,显著高于其它3节中的含量.4-甲氧基-3-吲哚甲基芥子油苷除在中花菜薹的第3节中含量显著低于菜薹其它节外,澄海粗条和全年油青菜薹各节间含量差异均不显著.1-甲氧基-3-吲哚甲基芥子油苷在3个芥蓝品种中均以第4节含量最高.

图4 芥蓝菜薹不同节间总吲哚族芥子油苷含量Fig.4 Total indolyl GS content in different sections of bolting stems in Chinese kale
2.3.2 芥蓝菜薹不同节间总吲哚族芥子油苷含量

表2 芥蓝菜薹不同节间吲哚族芥子油苷组分及含量Table 2 Individual indolyl GS in different sections of bolting stems in Chinese kale
从图4可以看出,3个芥蓝品种中,中花菜薹的第4节总吲哚族芥子油苷含量(DW)最高,为1.34 μmol·g-1,全年油青菜薹第 1 节含量(DW)最低,仅为 0.15 μmol·g-1.在 3 个芥蓝品种中,均以菜薹的第4节中总吲哚族芥子油苷含量最高,含量显著高于菜薹其它节间,其它3个节间总吲哚族芥子油苷含量差异均不显著.
3 讨论
芥蓝被认为是一种健康蔬菜,这主要源于其富含维生素C、矿物质等,而对其丰富的芥子油苷种类和含量最近才得到重视.何洪巨等[5]在芥蓝菜薹中检测到7种芥子油苷,陈新娟等[7]、LA 等[13]分别在芥蓝菜薹中检测到10种和11种芥子油苷.在本试验中除在菜薹部分节间只检测到10种芥子油苷外,在菜薹其它节间均中检测到11种芥子油苷,且只检测到脂肪族和吲哚族两大类芥子油苷,没有检测到芳香族芥子油苷,和前面的报道一致[3,7,10,13].但本试验中芥蓝菜薹中芥子油苷的平均含量低于何洪巨、李建文等[5,6]所报道,和陈新娟等[7]、LA 等[13]报道一致,这可能与品种、检测方法有关.在检测到的芥子油苷中,含量最高的均为3-丁烯基芥子油苷,而含量最低的芥子油苷在不同的芥蓝品种和菜薹不同节间各不相同,这与何洪巨等[5]、李建文等[6]研究结论一致.尤其值得注意的是芥蓝菜薹所含有的芥子油苷中,4-甲基亚硫酰丁基芥子油苷的降解产物萝卜硫素(sulforaphane)是迄今为止发现的最强的Ⅱ相酶抑制剂,能够通过抑制癌症细胞的分裂,诱导细胞程序化死亡等来延缓或逆转癌症的发生[14];2-丙烯基芥子油苷和4-甲硫基丁基芥子油苷的分解物也具有防癌和抗癌的作用[15,16].因此,芥蓝是很有潜力的抗癌蔬菜.
研究表明[17],芥子油苷种类变异一般科间>属间>种间,而含量则变异较大,除受植株本身差异影响外,在同一植株中,也因部位的不同而不同.大多学者认为,除3-吲哚甲基芥子油苷,1-甲氧基-3-吲哚甲基芥子油苷外,一般芥子油苷在种子中含量最高,在一些植物种子中含量达到10%[18],其次是茎,然后是叶,在根部含量最低[19].在西兰花中,菜薹和花蕾中的4-甲基亚硫酰丁基芥子油苷含量比其它的组织中都高[20],而嫩芽中的4-甲基亚硫酰丁基芥子油苷的含量是成熟植株或花的 10 ~100 倍[21].陈新娟等[7]对芥蓝叶片和菜薹中芥子油苷的组分和含量进行了鉴定和分析,发现虽然人们习惯食用的菜薹中各芥子油苷组分的含量显著高于叶片,但是叶片中也含有丰富的芥子油苷,尤其是叶片中吲哚族芥子油苷相对含量高于菜薹,因此建议消费者叶和薹一并食用,在提高芥蓝利用率的同时也增加了人体对抗癌物质的吸收.但是就一个组织器官进行详细的研究还未见报道.本试验对芥蓝菜薹不同节间芥子油苷种类和含量进行分析,结果表明,在3个芥蓝品种中,总芥子油苷、总脂肪族芥子油苷和总因吲哚族芥子油苷均在菜薹的最顶端含量最高.因此,在日常饮食中,为单独提高膳食中芥子油苷的摄入量,可选取芥蓝顶端的菜薹作为食用器官.有人推测,芥子油苷含量变化与该组织中芥子油苷的生物合成有关,然而研究发现在芥子油苷含量高的部位芥子油苷的生物合成活动却不一定强烈.例如,在拟南芥各组织中,种子中芥子油苷含量最高,而在种子中与芥子油苷相关的生物合成活动却很低,这表明芥子油苷在不同组织间可能存在着传输[22].在用放射性同位素14C对旱金莲(Tropaeolum majus)发育过程中苄基芥子油苷在各器官的生物合成的研究及对 B.napus cv.Cobra和 B.napus杂交 F1代的种子和叶子中脂肪族芥子油苷的组合模式与母体植株叶子中脂肪族芥子油苷的组合模式的研究中均表明,芥子油苷在植物不同部位间存在着传输,这种传输主要通过韧皮部的长距离传输来实现的[23~25].一般情况下,在成熟叶片中合成的芥子油苷通过韧皮部的传输系统逐渐向花和果实转移[26],而自身组织中芥子油苷含量因芥子油苷的传输和分解而降低[27,28].在本试验中,在菜薹的最顶端芥子油苷含量最高,这符合芥子油苷的传输规律,即芥子油苷通过韧皮部向生殖器官中转移,而在菜薹的前3节中芥子油苷含量差异不大,一方面这可能与其芥子油苷被传输到顶端有关,另一方面与其连接的叶子为衰老叶子,芥子油苷的生物合成活动较弱有关.然而不同种类的芥子油苷在菜薹各个节间的变化趋势不一致,这可能与不同种类芥子油苷的传输机制及生物合成过程不同有关,具体机理仍需进一步研究.
[1]WALDRON K W,JOHNSON I T,FENWICK G R.Food and cancer prevention:chemical and biological aspects[M].London:Royal Society of Chemistry,1993:12-23.
[2]PRICE K R,CASUSCELLI F,COLQUHOUN I J,et al.Composition and content of flavonol glycosides in broccoli florets(Brassica olearacea)and their fate during cooking[J].Journal of the Science of Food and Agriculture,1998,77(4):468-472.
[3]MATTHÄUS B,LUFTMANN H.Glucosinolates in members of the family Brassicaceae:separation and identification by LC/ESI-MS-MS[J].Journal of Agricultural and Food Chemistry,2000,48(6):2234-2239.
[4]张 敏,杨 乐,赵惠忠,等.球形果蔬在冷藏过程中内部温度场的试验研究[J].河南农业大学学报,2010,44(5):576-579.
[5]何洪巨,陈 杭,SCHNITZLER W H.芸薹属蔬菜中硫代葡萄糖苷鉴定与含量分析[J].中国农业科学,2002,35(2):192-197.
[6]李建文.蔬菜中次生代谢物质硫代葡萄糖苷及类黄酮化合物的研究[D].保定:河北农业大学,2003.
[7]陈新娟,朱祝军,杨 静,等.芥蓝叶和薹的硫代葡萄糖苷组分及含量[J].园艺学报,2006,33(4):741-744.
[8]陈日远,刘厚诚,宋传珍,等.氮素营养对芥蓝生长和品质的影响[J].农业工程学报,2005,21(增刊):143-146.
[9]KIM S J,JIN S,ISHIITE G.Isolation and structure elucidation of 4-(β-D-glucopyranosyldisulfanyl)butyl glucosinolate from leaves of rocket salad(Eruca sativa L.)and its antioxidative activity[J].Bioscience Biotechnology,and Biochemistry,2004,68(12):2444-2450.
[10]腊贵晓,方 萍,李亚娟,等.液相色谱质谱联用分离、鉴定芥蓝中脱硫硫代葡萄糖苷[J].浙江大学学报:农业与生命科学版,2008,34(5):557-563.
[11]MACFARLAME-SMITH W H,GRIFFITHS D W A.Time-course study of glucosinolates in the ontogeny of forage rape(Brassica napus L.)[J].Journal of the Science of Food and Agriculture,1988,43(2):121-134.
[12]唐启义,冯明光.实用统计分析及DPS数据处理系统[M].北京:科学出版社,2002:93-98.
[13]LA G X,FANG P,TENG Y B,et al.Effect of CO2enrichment on the glucosinolate contents under different nitrogen levels in bolting stem of Chinese kale(Brassica alboglabra L.)[J].Zhejiang Univiversity Science B,2009,10(6):454-464.
[14]BONES A M,ROSSITER J T.The myrosinase glucosinolates system,its organization and biochemistry[J].Physiologia Plantarum,1996,97(1):194-208.
[15]SHIBAMOTO T,TERAO J,OSAWA T.Functional foods for disease prevention I.Fruit,vegetables and teas[M].Washington:American Chemical Society,1998:16-22.
[16]FARNHAM M W,WILSON P E,STEPHENSON K K,et al.Genetic and environmental effects on glucosinolate content and chemoprotective potency of broccoli[J].Plant Breeding,2004,123(1):60-65.
[17]SANG J P,BLUETT C A,ELLIOTT B R,et al.Effect of time of sowing on oil content,erucic acid and glucosinolate contents in rapeseed(Brassica napus L.cv.Marnoo)[J].Australian Journal of Experimental Agriculture,1986,26(5):607-611.
[18]季宇彬,武晓丹,邹 翔.硫代葡萄糖苷的研究[J].哈尔滨商业大学学报:自然科学版,2005,21(5):550-562.
[19]LIENER I E.Toxic constituents of food crops[M].New York:Academic press,1980:103-142.
[20]RANGKADILOKA N,NICOLASA M E,BENNETTC R N,et al.Developmental changes of sinigrin and glucoraphanin in three Brassica species(Brassica nigra,Brassica juncea and Brassica oleracea var.italica)[J].Scientia Horticulturae,2002,96(1/4):11-26.
[21]BARTEL B,FINK G R.Differential regulation of an auxin-producing nitrilase gene family in Arabidopsis thaliana[J].PNAS,1994,91(14):6649-6653.
[22]DU L,HALKIER B A.Biosynthesis of glucosinolates in the developing silique walls and seeds of Sinapis alba[J].Phytochemistry,1998,48(7):1145-1150.
[23]MAGRATH R,MITHEN R.Maternal effects on the expression of individual aliphatic glucosinolates in seeds and seedlings of Brassica napus[J].Plant Breeding,1993,111(3):249-252.
[24]LYKKESFELDT J,MOLLER B L.Synthesis of benzylglucosinolate in Tropaeolum majus L.(Isothiocyanates as potent enzyme inhibitors)[J].Plant Physiology,1993,102(2):609-613.
[25]CHEN S,PETERSEN B L,OLSEN C E,et al.Longdistance phloem transport of glucosinolates in Arabidopsis[J].Plant Physiology,2001,127(1):194-201.
[26]BRUDENELL A.The phloem mobility of glucosinolates[J].Journal of Experimental Botany,1999,50(335):745-756.
[27]MIKKELSEN M D,HANSEN C H,WITTSTOCK U,et al.Cytochrome P450 CYP79B2 from Arabidopsis catalyzes the conversion of tryptophan to indole-3-acetaldoxime,a precursor of indole glucosinolates and indole-3-acetic acid[J].Journal of Biological Chemistry,2000,275(43):33712-33717.
[28]REINTANZ B,LEHNEN M,REICHELT M,et al.Bus,a bushy Arabidopsis CYP79F1 knockout mutant with abolished synthesis of short-chain aliphatic glucosinolates[J].Plant Cell,2001,13(2):351-367.

