伴消化道出血的急性心肌梗死患者的临床特点研究
张慧平,赵 迎,艾 虎,孙福成,李 康,郑耐心
心肌梗死 (MI)和消化道出血是危害人们健康的严重疾病,二者先后发病表现为MI后消化道出血和消化道出血后MI。MI患者发生消化道出血后,常需中断双重抗血小板和抗凝治疗,并且使冠脉再通治疗困难[1]。而消化道出血后MI患者也常无法应用抗血小板、抗凝治疗。研究显示,MI伴消化道出血患者作为一特殊群体,其心血管事件风险明显增加,加上这类患者处于出血和失血的不利状态,其临床预后不良[1-4]。本研究收集了2007—2008年我院心脏监护室连续收治的、同时有急性心肌梗死 (AMI)和消化道出血的23例患者,并随访1年,通过与同期住院的404例AMI患者进行对比,分析AMI同时合并消化道出血患者的临床特点。
1 对象与方法
1.1 研究对象 所选病例为2007年1月—2008年12月连续在我院心脏监护室住院并确诊为AMI的427例患者。AMI的诊断至少具备以下3条标准中的2条[5]:(1)缺血性胸痛的临床病史;(2)心电图的动态演变 (明确的心电图演变包括:ST-T改变符合MI的动态演变;对应导联出现病理性Q波;新出现或推测新出现的左束支传导阻滞);(3)心肌坏死的血清标志物浓度的动态改变:肌酸激酶同工酶 (CK-MB)≥2倍于正常值,肌钙蛋白T(TNT)≥1 ng/ml。根据ST段是否抬高,MI分为ST段抬高的心肌梗死 (ST-elevation MI,STEMI)和非ST段抬高的心肌梗死 (non-ST-elevation MI,NSTEMI)。消化道出血的诊断须具备以下3条标准中的1条:(1)新出现的大便潜血强阳性,伴或不伴血红蛋白下降20 g/L以上;(2)AMI后的治疗过程中出现黑便、柏油样便或血样便;(3)AMI后的治疗过程中出现胃液潜血强阳性或有呕血。消化道出血包括上消化道出血和下消化道出血。按照MI与消化道出血在时间上发生的先后,将同时有MI和消化道出血的23例患者分为MI后消化道出血和消化道出血后MI两组。无消化道出血的患者为MI对照组。
1.2 方法
1.2.1 基线资料的收集 记录患者的性别、年龄、身高、体质量、入院后首次静脉血肌酐 (Scr)、总胆固醇 (TC)、三酰甘油 (TG)、低密度脂蛋白胆固醇 (LDL-C)、高密度脂蛋白胆固醇 (HDL-C)。MI合并消化道出血的患者还记录入院时的收缩压 (SBP)、舒张压 (DBP)和血红蛋白。记录患者有无合并高血压、糖尿病、慢性肾功能不全等慢性疾病史,有无消化性溃疡等消化道疾病史。记录患者发生MI或消化道出血以后的治疗情况,包括抗血小板治疗 (阿司匹林和/或氯吡格雷)、抗凝治疗:普通肝素或低分子肝素 (UFH/LWMH),硝酸酯类、血管紧张素转换酶抑制剂 (ACEI)、血管紧张素受体Ⅱ抑制剂 (ARB)、β-受体阻滞剂 (β-B)、他汀类药物的使用,再血管化治疗 (溶栓及介入治疗)等;记录患者住院后质子泵抑制剂 (PPI)的使用情况、有无输血。
1.2.2 体质指数 (BMI)的计算 BMI=体质量/身高2(kg/m2)。
1.2.3 估测肾小球滤过率 (eGFR)的计算 根据MDRD公式计算 eGFR[6]。eGFR(ml·min-1·1.73-2)=186 × [Scr(mg/dl)]-1.154×[年龄 (岁)]-0.203,女性患者再乘以系数0.742。
1.2.4 随访 所有病例随访1年,随访终点为患者因再发心绞痛、非致死性MI、心衰和中风而住院和因再次MI、心脏破裂、心源性休克、心衰恶化和猝死而导致的心血管死亡。
1.3 统计学方法 采用SPSS 16.0统计软件进行统计学分析。主要统计学指标均进行正态性检验,正态分布的数据以 (±s)表示,非正态分布的数据以中位数表示。正态分布的计量资料组间比较采用One-way ANOVA检验,两两比较采用Newman Keuls Test检验 (q检验);非正态分布的计量资料组间比较采用秩和检验。计数资料以百分数 (%)表示,组间比较采用χ2检验。当理论值 (T)<1或总样本 (N)<40时,采用确切概率法 (Fisher exact probability test)。以双侧P<0.05为差异有统计学意义。采用Logistic回归模块判断影响MI后消化道出血的相关因素作用的大小,以OR值的95%可信区间 (CI)不包含1为差异有统计学意义。
2 结果
2.1 患者的临床基本特征 427例AMI患者的平均年龄为(67.9±11.4)岁,其中男288例 (占67.4%),女139例(占32.6%)。MI对照组404例 (占94.6%),MI后消化道出血组15例 (占 3.5%),消化道出血后 MI组 8例 (占1.9%),3组的基本特征见表1。MI后消化道出血组的女性所占比例高于其他两组,但差异无统计学意义 (P>0.05)。消化道出血后MI组的年龄高于MI对照组,差异有统计学意义(P<0.05)。3组患者患高血压病和糖尿病的比例以及BMI,差异均无统计学意义 (P>0.05)。消化道出血后MI组NSTEMI所占比例高于其他两组,MI后消化道出血组和消化道出血后MI组的消化道疾病史所占比例高于MI对照组,但差异均无统计学意义 (P>0.05)。有1例MI后消化道出血患者接受了消化内镜检查,证实为胃溃疡。消化道出血后MI组的收缩压、舒张压和血红蛋白均低于MI后消化道出血组,其中血红蛋白间的差异有统计学意义 (P<0.001);而TC、LDL-C水平也显著低于MI后消化道出血组和MI对照组,差异有统计学意义 (P<0.05)。3组的肾功能相比,MI后消化道出血组的eGFR显著低于MI对照组,差异有统计学意义 (P<0.05),消化道出血后MI组的eGFR也低于MI对照组,但差异无统计学意义 (P>0.05,见表1)。

表1 MI合并消化道出血患者的临床基本特征Table 1 Baseline characteristics of patients with myocardial infarction and gastrointestinal bleeding
2.2 MI患者消化道出血的相关因素 将表1中经单变量分析筛选出的、与MI后消化道出血相关的危险因素——eGFR作为候选变量,引入Logostic回归模块,进行Logostic回归分析显示,eGFR降低对MI后消化道出血的相关危险为0.975[95%CI(0.957,0.995),P<0.05],具体见表2。说明eGFR降低是MI后消化道出血的重要预测因素。

表2 MI后消化道出血的相关因素Logistic回归分析Table 2 Logostic regression analysis with eGFR for patients with gastrointestinal bleeding after MI
2.3 MI合并消化道出血的治疗情况 MI对照组阿司匹林、氯吡格雷、普通肝素或低分子肝素的使用比例高于MI后消化道出血组和消化道出血后MI组,其中氯吡格雷、普通肝素或低分子肝素的使用在MI对照组和MI后消化道出血组间差异无统计学意义 (P>0.05),其余差异均有统计学意义 (P<0.01)。除氯吡格雷外,消化道出血后MI组抗血小板、抗凝治疗的比例均低于MI后消化道出血组,差异均有统计学意义(P<0.05)。3组患者在他汀类药物、β-B、ACEI/ARB的使用方面差异均无统计学意义 (P>0.05)。MI后消化道出血组和消化道出血后MI组的PPI使用比例相似,差异无统计学意义 (P>0.05);但后者需要输血的比例显著高于前者,差异有统计学意义 (P<0.05)。使用的PPI主要为奥美拉唑,少部分为埃索美拉唑和泮托拉唑。MI后消化道出血组介入或溶栓治疗的比例低于MI对照组,高于消化道出血后MI组,但差异均无统计学意义 (P>0.05),而MI对照组介入或溶栓治疗的比例要显著高于消化道出血后MI组,差异有统计学意义(P<0.01,见表3)。
2.4 MI合并消化道出血的随访终点情况 MI对照组、MI后消化道出血组和消化道出血后MI组患者的1年随访终点——因再发心绞痛、非致死性MI、心衰和中风而住院和因再次MI、心脏破裂、心源性休克、心衰恶化和猝死而导致的心血管死亡,分别为15.3%(62/404)、40.0%(6/15)、37.5%(3/8),具体见图1。MI后消化道出血组的终点事件发生率显著高于MI对照组,差异有统计学意义 (P<0.05)。

图1 MI合并消化道出血患者的累积终点-时间曲线Figure 1 Cumulative incidence of end points during one year follow-up among patients with myocardial infarction and gastrointestinal bleeding
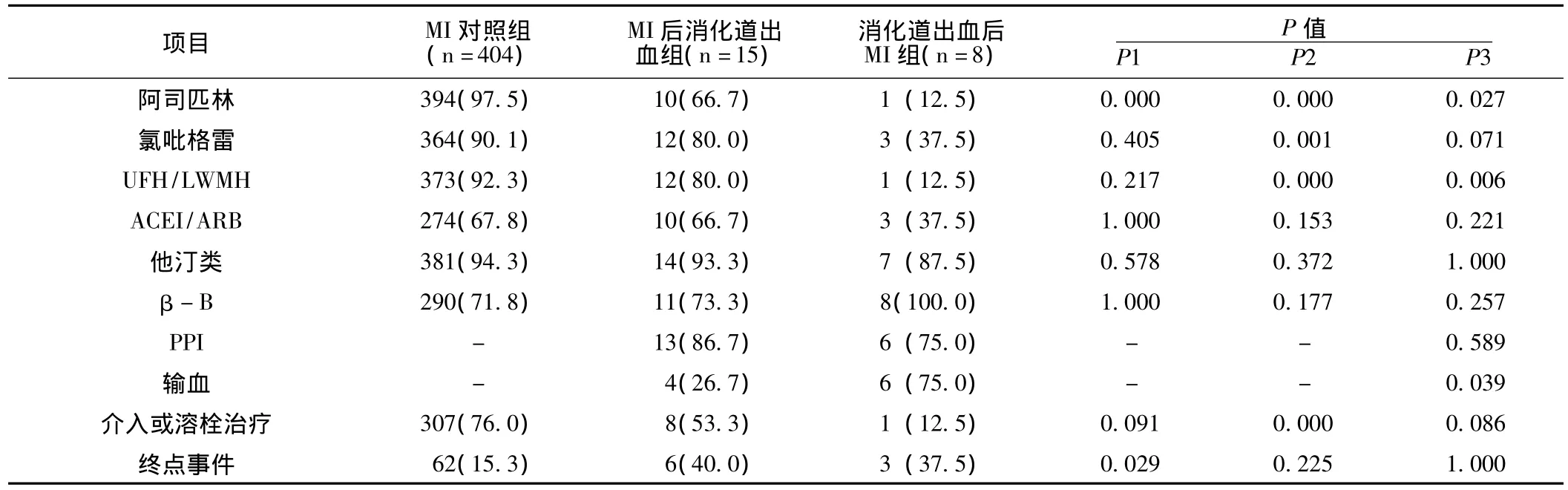
表3 MI合并消化道出血患者的治疗和终点事件[n(%)]Table 3 Therapies and end points of patients with myocardial infarction and gastrointestinal bleeding
3 讨论
MI后的抗血小板、抗凝及溶栓治疗以及MI后心功能下降、血流动力学不稳定造成的消化道黏膜应激和血液灌注减少,加上原本可能存在的肠系膜动脉粥样硬化,使MI发病后易出现消化道出血;而消化道出血后由于血液丢失所造成的血容量下降、血红蛋白数量减少和携氧能力下降,将导致心肌灌注和氧供减少,反射性引起代偿性心动过速,继而加重心脏负担,心脏对氧的需求也进一步增加,易导致心肌损伤,严重时即出现消化道出血后MI[3,7]。出血还能导致血小板激活,增加缺血性事件的发生。文献报道,MI患者消化道出血的发生率约为2.3%~5%,而严重消化道出血患者MI的发生率约为12%[1,2,4,8-9]。在本研究中,MI后消化道出血和消化道出血后MI分别占了同期MI患者的3.5%和1.9%。研究表明,随着年龄的增加,MI后消化道出血的发生率明显升高[1,2,10]。本研究中MI后消化道出血组的年龄未显著高于MI对照组,但消化道出血后MI组的年龄明显高于MI对照组,这使得MI本身的治疗变得更加困难。
糖尿病患者易出现消化道黏膜微循环缺血、消化道黏膜的药物易损性增加,并且有损伤愈合延迟,因此糖尿病是MI后消化道出血重要的预测因素[1,10]。但在本研究中,3组患者糖尿病所占的比例差异并不明显,这可能与所观察的MI合并消化道出血的病例数偏少有关。本研究中,MI后消化道出血患者和消化道出血后MI患者有消化道疾病史的比例相似,均高于MI对照组,但差异均不显著,仅有1例MI后消化道出血患者接受了消化内镜检查,证实为胃溃疡。内镜检查的比例很低,与国外现有实践差别巨大,这可能出于对围MI期内镜检查并发症的担心。Lin等[11]的研究中,MI后消化道出血患者和消化道出血后MI患者接受内镜检查的比例分别达80%和78%,两组仅各有1例患者出现了严重并发症,分别为无脉性电活动导致的死亡和经复苏成功的室颤。文献报道内镜检查并发症的发生率约为1‰,其中心肺方面的副作用超过50%,大多为血压、血氧饱和度下降以及心电图出现的一过性改变,而近期有过MI的患者进行胃肠镜检查的死亡率约为1%[11-14]。内镜检查能减少住院时间,对于消化道出血后MI或有呕血、伴有血流动力学不稳定的MI消化道出血患者尤其获益显著[11]。
在本研究中,消化道出血后MI组NSTEMI所占的比例高于其他两组,但差异无统计学意义。消化道出血后MI患者由于对出血的关注,可能会忽视一些MI的征象,即使有症状也不典型,心电图多表现为非ST段抬高[15]。其MI的机制与前述这类患者心肌对氧的供需失衡有关,有别于STEMI时的斑块破裂或血栓形成[3]。由于消化道出血后MI患者入院时处于血液丢失、血容量减低的状态,其血红蛋白、收缩压和舒张压均低于MI后消化道出血组,但血压的差异不显著。大量研究表明,肾功能不全明显增加MI后消化道出血性并发症的发生率,eGFR降低是MI后消化道出血的独立预测因素[1,10]。本研究同样证实,MI后消化道出血组的肾功能较MI对照组明显下降,Logostic回归分析显示,eGFR降低对MI后消化道出血的相关危险为0.975[95%CI(0.957,0.995),P<0.05],即eGFR每下降1 ml·min-1·1.73-2,MI患者发生消化道出血的风险增加2.5%,提示eGFR降低是MI后消化道出血重要的预测因素。
治疗方面,MI后消化道出血组阿司匹林、氯吡格雷、肝素或低分子肝素的使用均少于MI对照组,其中,阿司匹林的使用间差异有统计学意义 (P<0.001)。如前所述,MI后的抗血小板、抗凝等治疗本身即可增加消化道出血的发生率[16]。研究表明,阿司匹林对胃肠道的损伤是药物对黏膜的局部直接刺激和抑制前列腺素合成的系统效应共同作用的结果,仅阿司匹林本身即可使出血性风险增加近3倍,且这种风险呈剂量依赖性[17-19]。氯吡格雷尽管不是溃疡产生的直接原因,但它通过抑制血小板聚集而诱发无症状性溃疡出血,阻碍溃疡的愈合,氯吡格雷联合阿司匹林治疗进一步增加消化道出血风险约1~2倍[19-22]。再加上肝素等治疗,这一风险更加提高[23]。在VALIANT研究中,双重抗血小板治疗使消化道出血的风险增加了3.18倍,双重抗血小板治疗是MI后消化道出血最强的预测因子[10]。MI后一旦出现消化道出血,反过来又限制了抗血小板、抗凝治疗的继续应用。在本研究中,消化道出血后MI患者其双重抗血小板和抗凝治疗的比例更低。无论是在MI后消化道出血组,还是在消化道出血后MI组,氯吡格雷使用的比例均高于阿司匹林,分别为80.0%vs.66.7%、37.5%vs.12.5%。2007年ACC/AHA的NSTEMI指南推荐,MI后出现少量消化道出血,应权衡利弊,尽可能继续双重抗血小板治疗,尤其是对于植入药物支架的患者,尽量避免停用;发生严重出血时,应停用抗血小板和抗凝治疗[24]。也有人建议,可先停用阿司匹林,继续使用氯吡格雷,同时静脉使用PPI[25]。2008年ACCF/ACG/AHA关于联合使用抗血小板药物的专家共识指出,PPI是防治抗血小板药物不良反应的首选药物[19]。在本研究中,有消化道出血的MI患者大多使用了PPI,其中MI后消化道出血患者使用的比例略多。部分使用PPI的患者同时继续使用了氯吡格雷。氯吡格雷代替阿司匹林进行抗血小板治疗,并不能降低高危患者消化道溃疡出血的风险,其效果低于阿司匹林和PPI联合使用[17]。PPI可通过竞争性抑制CYP2C19而影响氯吡格雷的转化,进而影响其抗血小板的效果[26]。这方面无论是实验室研究还是临床研究,奥美拉唑不利的证据最多,泮托拉唑的影响似乎最小[27-28]。出于对抗凝、双重抗血小板治疗可能会使出血加重的担心,尤其是考虑到有可能要植入药物支架,MI后消化道出血组和消化道出血后MI组接受介入检查或溶栓治疗的比例均低于MI对照组,其中消化道出血后MI组的比例更低,差异有统计学意义 (P<0.01)。围介入治疗期的强化抗血小板、抗凝治疗使介入治疗本身即可增加出血的发生率。文献报道,AMI急诊介入治疗后胃肠道出血的发生率约为2%,并且这种出血与死亡率增加明显相关[2,29]。在本研究中,三组患者他汀类药物、β-B、ACEI/ARB使用的差异均无统计学意义。有研究表明,他汀类药物能够降低急性冠脉综合征患者消化道出血的风险,具体机制不清[30]。
在本研究中,消化道出血后MI组接受输血治疗的比例明显高于MI后消化道出血组,与其血红蛋白水平显著低于后者一致。因本研究中输血的患者较少,未能以输血作为影响因素对预后进行分析。理论上,缺血性心脏病患者出现贫血,输血治疗能增加氧的供给,改善预后。但在Rao等[31]的研究中,急性冠脉综合征患者出现出血后贫血,给予输血治疗,其30 d死亡或发生 MI的几率增加了 2.92倍 [95%CI(2.55,3.35)]。这一不利结果的原因可能有:储存血红细胞内的一氧化氮 (NO)半衰期缩短,NO一旦耗竭后容易导致血管收缩、血小板聚集和氧传送效能下降[32];储存血红细胞内的2、3二磷酸甘油减少,使得红细胞对氧的亲和力增加,影响氧的释放[33];输血的同时还输入大量的炎性介质或因子,能使心肌缺血进一步恶化[34]。因此,给MI患者输血有可能加重心肌缺血,使临床预后恶化。本研究以1年因心脑血管事件住院和心血管死亡为终点,可见MI后消化道出血组和消化道出血后MI组的终点事件均高于MI对照组,其中前者与MI对照组的差异有统计学意义 (P<0.05)。有研究表明,消化道出血后MI不影响患者的死亡率,但能使住院时间延长[4,9]。而MI后消化道出血却能使死亡率明显增加,同时延长住院时间,这可能与出血后的抗血小板、抗凝治疗中断等原因有关[1-2]。
本研究对MI伴有消化道出血患者的临床特点进行了探讨,MI伴消化道出血使得MI的常规治疗变得困难。肾功能不全明显增加MI患者消化道出血的发生率,并且MI后消化道出血的患者多预后不良。本研究随访时间不长,未能进一步分析这类患者预后的影响因素,关于消化道出血对于MI患者发病、治疗及预后的影响尚待进一步研究。
1 Eikelboom JW,Mehta SR,Anand SS,et al.Adverse impact of bleeding on prognosis in patients with acute coronary syndromes [J].Circulation,2006,114:774-782.
2 Abbas AE,Brodie B,Dixon S,et al.Incidence and prognostic impact of gastrointestinal bleeding after percutaneous coronary intervention for acute myocardial infarction [J].Am J Cardiol,2005,96:173-176.
3 Cappell MS.Gastrointestinal bleeding associated with myocardial infarction[J].Gastroenterol Clin North Am,2000,29:423-444.
4 Emenike E,Srivastava S,Amoateng-Adjepong Y,et al.Myocadial infarction complicating gastrointestinal hemorrhage [J].Mayo Clin Proc,1999,74:235-241.
5 中华医学会心血管病学分会,中华心血管病杂志编辑委员会,中国循环杂志编辑委员会.急性心肌梗死诊断和治疗指南[S].2006.
6 Ma YC,Li Z,Chen JH,et al.Modified glomerular filtration rate estimating equation for chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17:2937-2944.
7 Sabatine MS,Morrow DA,Giugliano RP,et al.Association of hemoglobin levels with clinical outcomes in acute coronary syndromes[J].Circulation,2005,111:2042-2049.
8 Avezum A,Makdisse M,Spencer F,et al.for the GRACE Investigators.Impact of age on management and outcome of acute Coronary Events(GRACE)[J].Am Heart J,2005,149:67-73.
9 Bhatti N,Amoaleng-Adjepong Y,Qamar A,et al.Myocardial infarction in critically ill patients presenting with gastrointestinal hemorrhage:Retrospective analysis of risks and outcomes [J].Chest,1998,114:1137-1142.
10 Moukarbel GV,Signorovitch JE,Pfeffer MA,et al.Gastrointestinal bleeding in high risk survivors of myocardial infarction:the VALIANT Trial[J].Eur H J,2009,30:2226-2232.
11 Lin S,Konstance R,Jollis J,et al.The utility of upper endoscopy in patients with concomitant upper gastrointestinal bleeding and acute myocardial infarction [J].Dig Dis Sci,2006,51:2377-2383.
12 Mergener K,Baillie J.Complications of endoscopy[J].Endoscopy,1998,30:230-243.
13 Barkin JS,Krieger B,Blinder M,et al.Oxygen desaturation and changes in breathing pattern in patients undergoing colonoscopy and gastroscopy [J].Gastrointest Endosc,1989,35:526-530.
14 Lee JG,Krucoff MW,Brazer SR.Periprocedural myocardial ischemia in patients with severe symptomatic coronary artery disease undergoing endoscopy:prevalence and risk factors[J].Am J Med,1995,99:270-275.
15 Lee CT,Huang SP,Cheng TY,et al.Factors associated with myocardial infarction after emergency endoscopy for upper gastrointestinal bleeding in high-risk patients:a prospective observational study[J].Am J Em Med,2007,25:49-52.
16 Cryer B.Reducing the risks of gastrointestinal bleeding with antiplatelet therapies[J].N Engl J Med,2005,352:287-289.
17 Bhatt DL,Scheiman J,Abraham NS,et al.ACCF/ACG/AHA 2008 Expert Consensus Document on Reducing the Gastrointestinal Risks of Antiplatelet Therapy and NSAID Use:A Report of the American Col-lege of Cardiology Foundation Task Force on Clinical Expert Consensus Documents[J].Circulation,2008,118:1894-1909.
18 Kelly JP,Kaufman DW,Jurgelon JM,et al.Risk of aspirin-associated major uppergastrointestinal bleeding with enteric-coated or buffered product[J].Lancet,1996,348:1413-1416.
19 Lanas A,Garcia-Rodriguez LA,Arroyo MT,et al.Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors,traditional non-aspirin non-steroidal anti-inflammatory drugs,aspirin and combinations [J].Gut,2006,55:1731-1738.
20 Yusuf S,Zhao F,Mehta SR,et al.Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation [J].N Engl J Med,2001,345:494-502.
21 Ng FH,Wong SY,Chang CM,et al.High incidence of clopidogrel-associated gastrointestinal bleeding in patients with previous peptic ulcer disease [J].Aliment Pharmacol Ther,2003,18:443-449.
22 Diener HC,Bogousslavsky J,Brass LM,et al.Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients(MATCH):randomised,double-blind,placebo-controlled trial[J].Lancet,2004,364:331-337.
23 Oler A.Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina:a meta-analysis[J].JAMA,1996,276:811-815.
24 Anderson JL,Adams CD,Antman EM,et al.ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-Elevation myocardial infarction:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines [J].J Am Coll Cardiol,2008,50:e1-e157.
25 Foley P,Foley S,Kinnaird T,et al.Clinical review:gastrointestinal bleeding after percutaneous coronary intervention:a deadly combination [J].Q J Med,2008,101:425-433.
26 Norgard NB,Mathews KD,Wall GC,et al.Drug-drug interaction between clopidogrel and the proton pump inhibitors [J].Ann Pharmacother,2009,43:1266-1274.
27 Sibbing D,Morath T,Stegherr J,et al.Impact of proton pump inhibitors on the antiplatelet effects of clopidogrel[J].Thormb Haemost,2009,101:714-719.
28 Juurlink DN,Gomes T,Ko DT,et al.A population-based study of the drug interaction between proton pump inhibitors and clopidogrel[J].CMAJ,2009,180:713-718.
29 Kinnaird TB,Stabile E,Mintz GS,et al.Incidence,predictors,and prognostic implications of bleeding and blood transfusion following percutaneous coronary interventions [J].Am J Cardiol,2003,92:930-935.
30 Atar S,Cannon CP,Murphy SA,et al.Statins are associated with lower risk of gastrointestinal bleeding in patients with unstable coronary syndromes:analysis of the Orbofiban in Patients with Unstable coronary Syndromes-Thrombolysis In Myocardial Infarction 16(OPUS-TIMI 16)trial[J].Am Heart J,2006,151:976.
31 Rao SV,Jollis JG,Harrington RA,et al.Relationship of blood transfusion and clinical outcomes in patients with acute coronary syndromes[J].JAMA,2004,292:1555-1562.
32 McMahon TJ,Moon RE,Luschinger BP,et al.Nitric oxide in the human respiratory cycle[J].Nat Med,2002,8:711-717.
33 Welch HG,Meehan KR,Goodnough LT.Prudent strategies for elective red blood cell transfusion [J].Ann Intern Med,1992,116:393-402.
34 Fransen E,Maessen J,Dentener M,et al.Impact of blood transfusions on inflammatory mediator release in patients undergoing cardiac surgery [J].Chest,1999,116:1233-1239.

