新疆地区烟粉虱类群mtDNA COI基因序列分析
段晓东,马丽娟,姚正培,曹 骞,冷春丽,马德英,新疆农业大学农学院,新疆乌鲁木齐8005;乌鲁木齐市农业技术推广中心,新疆乌鲁木齐800;教育部棉花工程研究中心,新疆乌鲁木齐8005
烟粉虱Bemisia tabaci(Gennadius)是一种严重危害农业生产的世界性害虫,广泛分布于除南极洲外的90多个国家和地区(Brown et al.,1995)。由于寄主范围、寄主植物适应性和传毒能力等方面的不同,烟粉虱被认为是一个由11个定义明确的高级群组成的复合体,至少包含24个形态学上难以分辨的种(De Barro et al.,2011),主要有B 型、Q 型和非 B/Q 型(包括 A、K、D、E、G、H、L、M、N 等多种生物型)。其中,B型烟粉虱几乎在全世界均有分布,其他生物型多为区域性分布。Q型烟粉虱最初记载于西班牙,现在已经分布于许多国家和地区,如意大利、以色列、摩洛哥、日本、美国、墨西哥、中国等(Palumbo et al.,2001;Horowitz et al.,2003;Muniz,2000;Ueda & Brown,2006;褚栋等,2005)。由于Q型烟粉虱比B型表现出更强的抗药性,更大的产卵量、化蛹率和成虫羽化率以及更强的耐极限温度等生存能力,在部分地区逐渐取代了B型种群,成为当地的优势种群(Hu et al.,2011;Chu et al.,2010)。目前,Q型烟粉虱已经受到越来越多的关注。
我国于2003年首次在云南昆明发现了Q型烟粉虱(褚栋等,2005),其后又在北京、河南、山东、辽宁、湖北等地发现(饶琼等,2009)。有关新疆烟粉虱的发生状况也有一些报道,但均为B型(罗晨等,2002;Ma et al.,2007;Teng et al.,2010)。鉴于近年来Q型烟粉虱在我国的快速扩散,本研究采用mtDNA COI基因作为分子标记,再对新疆地区烟粉虱的生物型进行鉴定,以期为有关部门对其开展监测和防治工作提供依据。
1 材料与方法
1.1 试验材料
从新疆烟粉虱发生的地理区域采集样品。挑选烟粉虱雌虫,-20℃下保存,作为分析虫样。烟粉虱的采集时间、地点和寄主见表1。

表1 被测试烟粉虱种群的信息Table 1 Information on the origin of the tested B.tabaci populations from Xinjiang,NW China,2008 ~2010
1.2 基因组DNA的提取方法及检测
基因组DNA的提取采用氯仿/异戊醇抽提法(周志湘等,2007)。将单头雌性烟粉虱样本置于1.5 mL离心管中,用液氮破碎研磨,滴加150 μL提取缓冲液(pH 8.0,50 mmol·L-1Tris-HCl、20 mmol·L-1NaCl、1 mmol·L-1EDTA、1%SDS)匀浆;滴加 5 μL 蛋白酶K(20 mg·mL-1),混匀;60 ℃水浴1 h(中途混匀1~2次);100℃沸水浴5 min。DNA匀浆液中加入200 μL氯仿/异戊醇(24∶1)抽提2次,每次轻柔混匀数十次,冰上放置 10 min,10000 r·min-1离心 10 min,取上清液;加入2倍体积预冷无水乙醇,轻轻混匀,于 -20 ℃放置30 min,然后12000 r·min-1离心15 min,弃上清液;加入2倍体积预冷的75%乙醇,12000 r·min-1离心15 min,弃上清液。将EP管倒扣于干净滤纸上,自然干燥30 min,每管加入30 μL超纯水,充分溶解后于-20℃保存备用。
1.3 PCR扩增及电泳
反应程序参考Simon et al.(1994),引物分别为C1-J-2195(5'-ttg att ttt tgg tca tcc aga agt-3')和L2-N-3014(5'-tcc aat gca cta atc tgc cat att a-3')。在1.6%琼脂糖凝胶上电泳,EB染色后,在凝胶成像系统上观察,记录结果。
1.4 序列的测定与比较
使用EZNA Gel Extraction Spinportocal D2500-01(OMEGA)胶回收试剂盒进行PCR产物回收纯化,纯化后的样品送至北京六合华大基因科技股份有限公司测序。每个地理种群至少测3个烟粉虱个体。登录NCBI网站,查阅并下载相关的烟粉虱mtDNA COI基因片段序列(表2),通过DNAstar分析软件,对测序结果及相关引用序列进行比对分析。利用软件中的MegAlign-ClustalV模型计算出烟粉虱不同地理种群的进化分歧矩阵,并构建系统进化树,以此分析烟粉虱种群间的遗传关系,对新疆烟粉虱种群生物型进行鉴定,并推断其可能来源地。
2 结果与分析
2.1 新疆烟粉虱生物型及不同生物型mtDNA COI的序列差异
所有样品均得到约840 bp的序列,经测序并提交到GenBank,获取基因序列编码。从每个种群所测序列中截取与China Beijing-B相应的720 bp片段序列进行分析。结果表明,同一地区不同寄主植物上采集到的烟粉虱个体的COI基因序列存在明显差异;同一地区同一寄主植物上采集到的烟粉虱种群的COI基因序列也存在明显差异(表3、图1)。

表2 引用mtDNA COI基因片段在GenBank中的登录号Table 2 The code for reference mtDNA COI sequences and the respective GenBank accession numbers

表3 被测试烟粉虱种群的生物型Table 3 Biotype of tested B.tabaci populations
由乌鲁木齐市花卉市场采集到的HH-1与吐鲁番市温室不同寄主上采集到的LJ、XHS、QZ烟粉虱个体的COI基因序列完全一样。序列中各个碱基的含量分别为 178A、142G、308T、92C,A+T 的含量为67.5%。它们与 Morocco Casablanca-Q、France Gironde-Q、USA California-Q、China Jiangsu-Q、China Wuhan-Q等5个已知Q型烟粉虱个体COI基因序列相应的720 bp片段完全一样;与China Yangzhou-Q、China Jingzhou-Q等2个已知Q型烟粉虱个体COI基因序列相比,具有1个碱基的区别,为第57位点上的G→C;与Morocco Nador-Q相比,有2个碱基的区别,为第266位点上的T→C和第294位点上的A→G;与Sudan-Q相比,有12个碱基的区别,分别为第15位点上的T→A、第74位点上的T→G、第75位点上的G→A、第76位点上的A→C、第87位点上的C→T等;与China Beijing-B、China Guangdong-B、China Hubei-B、USA Florida-B等4个已知B型烟粉虱个体COI基因序列相比,有37个碱基的区别。
由吐鲁番市烟草上采集的YC与China Yangzhou-Q、China Jingzhou-Q等2个已知Q型烟粉虱个体COI基因序列相比,具有2个碱基的区别,为第3位点上的T→G和第7位点上的C→T;与Morocco Casablanca-Q、France Gironde-Q、USA California-Q、China Jiangsu-Q、China Wuhan-Q等5个已知Q型烟粉虱个体COI基因序列相比,具有3个碱基的区别,分别为第3位点上的T→G、第7位点上的C→T、第57位点上的G→C;与Morocco Nador-Q相比,有5个碱基的区别,分别为第3位点上的T→G、第7位点上的C→T、第57位点上的G→C、第266位点上的T→C、第294位点上的 A→G;与Sudan-Q相比,有15个碱基的区别,分别为第3位点上的T→G、第7位点上的C→T、第15位点上的T→A、第57位点上的G→C、第74位点上的T→G等。
由乌鲁木齐市不同寄主上采集到的JK-S、HH-2、ZH-O与吐鲁番市不同寄主上采集到的TC1、TC2、TC3烟粉虱个体COI基因序列完全一样。序列中各个碱基的含量分别为182A、139G、310T、89C,A+T 的含量为 68.3%。它们与 China Beijing-B、China Guangdong-B、China Hubei-B、USA Florida-B 等 B 型烟粉虱序列相应的720 bp片段完全一样。
2.2 烟粉虱不同生物型mtDNA COI的遗传距离和系统发育树分析
采用DNAstar软件中的MegAlign-ClustalV模型计算出烟粉虱不同地理种群的进化分歧矩阵,并构建系统进化树(图2~3)。结果发现,烟粉虱和白粉虱Trialeurodes vaporariorum首先分开,同源性接近于70.0%;其后B型烟粉虱和Q型烟粉虱分开,形成2个分支,同源性为93.8% ~94.9%。在Q型分支中,被测样本 HH-1、LJ、XHS、QZ 与 Morocco Casablanca-Q、France Gironde-Q、USA California-Q、China Jiangsu-Q、China Wuhan-Q、Morocco Nador-Q等6个已知Q型烟粉虱种群聚为一类,同源性为99.7% ~100%;被测样本YC与China Yangzhou-Q、China Jingzhou-Q等2个已知Q型烟粉虱种群聚为一类,同源性为99.7%;非洲Sudan-Q烟粉虱种群独自为一类,与其他Q型烟粉虱种群的同源性为97.8% ~98.2%。在B型分支中,被测样本 JK-S、HH-2、ZH-O、TC1、TC2、TC3 与China Beijing-B、China Guangdong-B、China Hubei-B、USA Florida-B等4个已知B型烟粉虱种群聚为一类,同源性为100%,属于同一个进化分支。
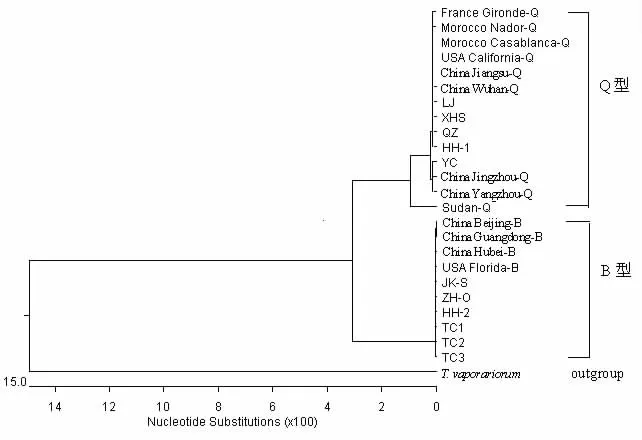
图2 烟粉虱种群的系统聚类树Fig.2 The relatinoship of the B.tabaci groups from Xinjiang,NW China and references,based on the mt COI gene sequences

图3 烟粉虱种群mtDNA COI基因720 bp片段序列的同源性比较Fig.3 Percent identity of 720 the characters examined for COI sequences of B.tabaci collections and reference sequences
3 讨论
本研究结果表明,在吐鲁番市的温室蔬菜、乌鲁木齐市花卉市场内发现了Q型烟粉虱,并且在寄主一品红不同样本群检测出了B和Q等2种生物型,表明Q型烟粉虱已经传入新疆。同时,根据被测烟粉虱样品与已知Q型烟粉虱mtDNA COI基因在NCBI上进行BLAST比对分析发现,自2003年首次在我国发现Q型烟粉虱至2010年在新疆首次发现,其都在不断发生着遗传变化。由乌鲁木齐市花卉市场采集到的HH-1和吐鲁番市温室不同寄主上采集到的 LJ、XHS、QZ 与 Morocco Casablanca-Q、France Gironde-Q、USA California-Q、China Jiangsu-Q、China Wuhan-Q等5个已知Q型烟粉虱的同源性为100%。然而,由吐鲁番市烟草上采集的YC与以上5个已知Q型烟粉虱的同源性为99.6%;与China Yangzhou-Q、China Jingzhou-Q等2个已知Q型烟粉虱的同源性为99.7%;与Morocco Nador-Q的同源性为99.3%;与Sudan-Q的同源性为97.8%。这表明入侵新疆的Q型烟粉虱可能有不同来源。
另外,来自野生植物、花卉市场、温室、棉田的被测样本 JK-S、HH-2、ZH-O、TC1、TC2、TC3 与 China Beijing-B、China Guangdong-B、China Hubei-B、USA Florida-B等4个已知B型烟粉虱的同源性为100%。由此可以看出,吐鲁番、乌鲁木齐主要农业生产区域的烟粉虱生物型仍然为B型。B型烟粉虱在新疆依然是主要的防治对象。同时,B型烟粉虱未出现Q型烟粉虱所表现的基因分化现象,这可能与Q型烟粉虱种群间遗传多样性高于B型种群有关(Moya et al.,2001)。
Q型烟粉虱的发现对新疆的棉花种植业及设施农业生产提出了警示和更加严峻的挑战,同时印证了Ma et al.(2007)的预测。因此,有关部门在关注B型烟粉虱的同时,也应对新疆Q型烟粉虱的传播及危害引起足够的重视,并及时采取措施防止其进一步扩散。此外,已经成功建立的针对B型烟粉虱的防治策略与技术体系都将面临挑战,因为Q型烟粉虱较B型拥有更强、更广泛的抗性程度(Hu et al.,2011;Chu et al.,2010)。今后我们还需检测 Q型烟粉虱的抗药性状况,以便针对B型和Q型烟粉虱的发生状况和分布区域提出不同的防治策略。
褚栋,张友军,丛斌,徐宝云,吴青君.2005.云南Q型烟粉虱种群的鉴定.昆虫知识,42(1):54-56.
罗晨,姚远,王戎疆,阎凤鸣,胡敦孝,张芝利.2002.利用mtDNA COI基因序列鉴定我国烟粉虱的生物型.昆虫学报,45(6):759-763.
饶琼,罗汉钢,汪细桥,周国珍,张宏宇,罗晨.2009.武汉地区烟粉虱的危害及其生物型鉴定.华中农业大学学报,28(5):205-210.
周志湘,万方浩,张桂芬,陈斌.2007.烟粉虱基因组DNA快速提取方法.植物保护,33(5):131-133.
Brown J K,Frohlich D R and Rosell R C.1995.The sweetpotato or silverleaf whiteflies:biotypes of Bemisia tabaci or a speciescomplex? AnnualReview ofEntomology,40:511-534.
Chu D,Wan F H,Zhang Y J and Brown J K.2010.Change in the biotype composition of Bemisia tabaci in Shandong Province of China from 2005 to 2008.Environmental Entomology,39:1028-1036.
De Barro P J,Liu S S,Boykin L M and Dinsdale A B.2011.Bemisia tabaci:a statement of species status.Annual Review of Entomology,56:1 -19.
Horowitz A R,Denholm I,Gorman K,Cenis J L,Kontsedalov S and Ishaaya I.2003.Biotype Q of Bemisia tabaci identified in Israel.Phytoparasitica,31:94 -98.
Hu J,De Barro P J,Zhao H,Wang J,Nardi F and Liu S S.2011.An extensive field survey combined with a phylogenetic analysis reveals rapid and widespread invasion of two alien whiteflies in China.PLoS ONE,6(1):e16061.doi:10.1371/journal.pone.0016061
Ma D Y,Gorman K,Devine G,Luo W C and Denholm I.2007.The biotype and insecticide-resistance status of whiteflies,Bemisia tabaci(Hemiptera:Aleyrodidae),invading cropping systems in Xinjiang Uygur Autonomous Region.Northwestern China Crop Protection,26:612 -617.
Moya A,Guirao P,Cifuentes D,Beitia F and Cenis J L.2001.Genetic diversity of Iberian populations of Bemisia tabaci(Hemiptera:Aleyrodidae)based on random amplified polymorphic DNA-polymerase chain reaction.Molecular Ecology,10:891-897.
Muniz M.2000.Host suitability of two biotypes of Bemisia tabaci on some common weeds.Entomologia Experimentalis et Applicata,95:63 -70.
Palumbo J C,Horow I and Prabhaker N.2001.Insecticidal control and resistance management for Bemisia tabaci.Crop Protection,20:739 -765.
Simon C,Frati F,Beckenbach A,Crespi B,Liu H and Flook P.1994.Evolution,weighting,and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved Polymerase Chain Reaction primers.Annals of the Entomological Society of America,87:651 -701.
Teng X,Wan F H and Chu D.2010.Bemisia tabaci biotype Q dominates other biotypes across China.Florida Entomologist,93:363-368.
Ueda S and Brown J K.2006.First report of the Q biotype of Bemisia tabaci in Japan by mitochondrial cytochrome oxidase I sequence analysis.Phytoparasitica,34:405 -411.

