2型糖尿病患者血糖波动与血清丙二醛、超氧化物歧化酶的关系
彭朝胜,曹悦鞍,丁海燕,张文路,夏 菁,谢文秀,杨 璐
2010年3月刊登在《新英格兰医学杂志》的最新中国糖尿病流行病学调查结果表明,在年龄≥20岁的中国人群中,糖尿病患病率为9.7%,并呈日益上升趋势,糖尿病是独立于其他动脉硬化危险因素外引起心脏和周围动脉疾病的主要原因。业已证实,氧化应激在糖尿病及其并发症的发生、发展过程中起着关键作用,是重要的病理生理机制之一。近期在体外细胞培养实验[1]中发现波动性高血糖能通过促进氧化应激和氧自由基形成,引起继发的细胞功能紊乱及损伤,而临床上对于糖尿病患者血糖波动与氧化应激的相关性也逐渐被人们所重视。本研究采用动态血糖监测系统(continuous glucose monitoring system,CGMS)观察血糖控制良好的2型糖尿病(type 2 diabetes mellitus,T2DM)患者日内血糖波动与反映体内氧化应激的主要指标血清丙二醛(malonyldialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)的关系,并初步探讨血糖波动在T2DM氧化应激中的作用机制。
1 资料与方法
1.1 临床资料 选取2型糖尿病患者76例(男性48例、女性28例),均符合2007年中国2型糖尿病防治指南诊断标准,年龄44~72(52.86±11.22)岁,排除心脑血管疾病、感染、肝肾疾病、恶性肿瘤及自身免疫性疾病等。所有受试者2周内均未服用抗氧化剂或硝酸酯类药物。根据CGMS监测的日内平均血糖波动幅度(mean amplitude glycemic excursions,MAGE)结果分为:异常波动组(AFG)38例:MAGE≥3.9 mmol/L,其中男性23例、女性 15例;正常波动组(NFG)38例:MAGE<3.9 mmol/L,其中男性25例、女性13例。所选患者均接受口服降糖药物(排除胰岛素治疗者)治疗并血糖控制良好,即空腹血糖(FPG)<7.0 mmol/L,糖化血红蛋白(HbA1c)<7.0%。
1.2 方法
1.2.1 检测指标 所有受试者测量身高、体质量、血压,计算体质指数(BMI)、平均血压(MBP)。动态血糖监测前日晚餐后空腹12 h,于次晨8:00左右取静脉血,所有血样收集后立即离心10 min(3 500 r/min)取分离血清。统一采用Beckman Cx5全自动生化分析仪测定FPG、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等指标。采用低压液相色谱法(美国Bio-Rad公司DiaSTAT仪)测定HbA1c。用化学发光法测定空腹胰岛素水平(FINS),试剂盒购自美国Bayer公司,采用稳态模型评估法(homeostasis model assessment,HOMA)计算胰岛素抵抗程度(Homa InRI=空腹血糖×空腹胰岛素/22.5)。所有剩余血清立即置于-20℃冰箱冷冻保存 ,标本收集完全之后统一测定血清脂质过氧化产物MDA、SOD含量。采用硫代巴比妥酸方法检测MDA浓度;黄嘌呤氧化酶/黄嘌呤系统检测 SOD水平(试剂盒均购自南京建成生物工程研究所,检测按说明书进行)。
1.2.2 动态血糖监测 采用圣美迪诺公司的CGMS对受试者进行连续72 h的监测。CGMS的总体平均相对偏差为13.2%。本组患者监测期间三餐进食时间相对固定统一。监测期间应用强生公司生产的血糖仪,测量4次指血血糖作为参比血糖,即置入当天睡前1次血糖及以后连续3 d每天晨起1次FPG。读取受试者测试第2天全日血糖平均值(daily averageplasmaglucose,DAPG),并计算如下指标:①日平均血糖波动幅度(mean amplitude glycemic excursions,MAGE),统计第2天24 h波动幅度大于1个标准差的血糖波动,以波动峰值到谷值的方向计算其波动幅度,MAGE为所有血糖波动幅度的平均值;②血糖波动系数(blood glucose fluctuant coefficient,BGFC),统计3 d总体血糖浓度的标准偏差;③日血糖波动最大幅度(daily maximum margin of glucose,DMMG):统计第2天全日血糖最大值与最小值的差值。
1.3 统计学处理 采用SPSS 10.0统计软件对数据进行分析,计量资料以均数±标准差(±s)表示。多组比较的均数经方差分析,组间比较采用t检验,并以相关分析评价指标间的相关性,以P<0.05为有统计学意义。
2 结果
2.1 一般资料分析 两组年龄、病程、FPG、BMI、TG、TC、HbA1c及平均血压无统计学差异。异常波动组 FINS、Homa InIR明显高于正常波动组(P<0.05,表1)。
表1 两组一般资料(s)
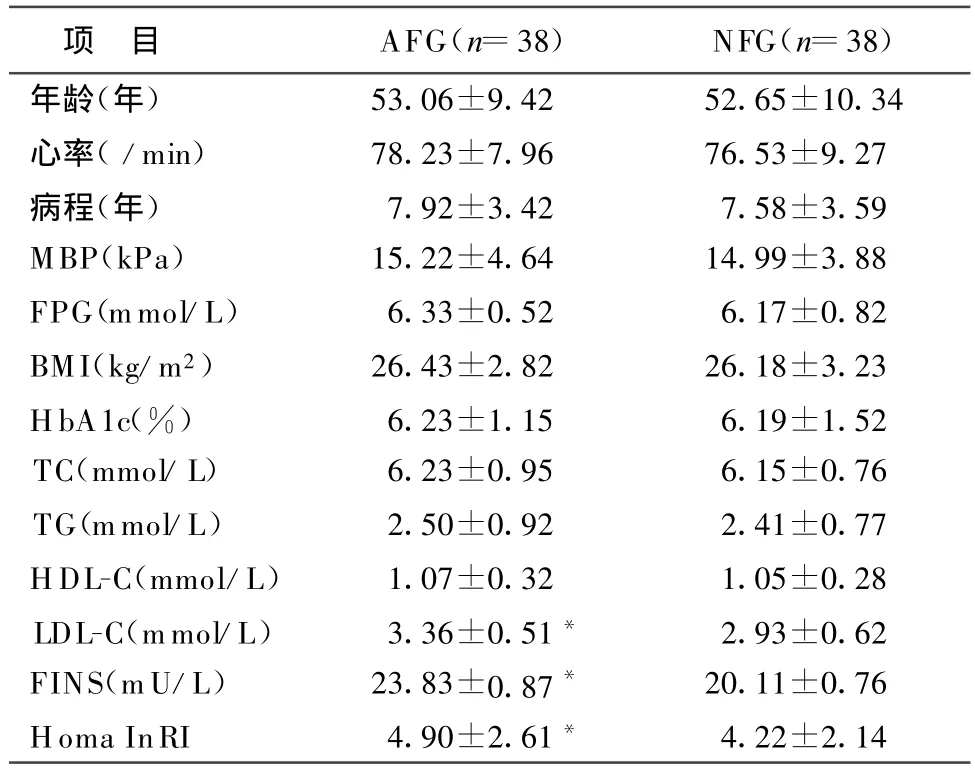
表1 两组一般资料(s)
注:与正常波动组比较,*P<0.05
项 目 AFG(n=38) NFG(n=38)年龄(年) 53.06±9.42 52.65±10.34心率(/min) 78.23±7.96 76.53±9.27病程(年) 7.92±3.42 7.58±3.59 MBP(kPa) 15.22±4.64 14.99±3.88 FPG(mmol/L) 6.33±0.52 6.17±0.82 BMI(kg/m2) 26.43±2.82 26.18±3.23 HbA1c(%) 6.23±1.15 6.19±1.52 TC(mmol/L) 6.23±0.95 6.15±0.76 TG(mmol/L) 2.50±0.92 2.41±0.77 HDL-C(mmol/L) 1.07±0.32 1.05±0.28 LDL-C(mmol/L) 3.36±0.51* 2.93±0.62 FINS(m U/L) 23.83±0.87* 20.11±0.76 Homa In RI 4.90±2.61* 4.22±2.14
2.2 氧化应激指标与动态血糖监测结果分析 两组间日平均血糖值无显著差异;异常波动组DMMG、BGFC及MDA与正常波动组比较升高(P均<0.05),而SOD明显降低(P<0.01,表 2)。
表2 两组氧化应激指标与动态血糖监测结果比较±s)

表2 两组氧化应激指标与动态血糖监测结果比较±s)
注:与正常波动组比较,*P<0.05,**P<0.01
组别 n DAPG(mmol/L) DMMG(mmol/L) BGFC(mmol/L) MDA(μmol/L) SOD(kU/L)AFG 38 7.92±2.40 5.86±2.23* 2.63±0.92* 6.68±1.44* 129.33±16.43 NFG 38 7.77±2.61 5.02±1.91 2.10±0.61 5.21±1.25 148.46±12.82**
2.3 相关性分析 MAGE与InRI、MDA呈正相关(r分别0.312,0.293,P均<0.05),与SOD呈负相关(r为-0.358,P<0.01)。
3 讨论
随着对糖尿病研究的不断深入,氧化应激在糖尿病及其并发症发病机制中的地位已达共识,认为氧化应激是该类疾病的重要病理生理机制之一,并贯穿于发病的整个过程[2-3]。氧化应激是指机体在遭受各种有害刺激时,体内氧自由基产生过多,与抗氧化防御之间严重失衡,使活性氧在机体或细胞内蓄积而引起细胞毒性,进而导致组织损伤的过程。氧化应激产生的活性产物如自由基、丙二醛等不但可以直接攻击大分子物质如脂肪、蛋白、核酸等,使之发生过氧化,导致细胞坏死,还可以通过间接介导线粒体途径、DNA修复酶及转录因子等导致细胞功能缺损。同时,机体亦存在包括SOD、谷胱甘肽过氧化物酶(glutathione peroxidace,GSH-Px)、过氧化氢酶(catalase,CAT)等在内的抗氧化防御酶系。生理情况下,自由基的产生和清除处于动态平衡,任何原因破坏了这一平衡系统,就会启动氧化应激的损伤机制,从而关联诸多疾病的病理生理过程。
既往糖代谢异常对体内氧化应激影响的研究多集中在血糖的升高上。认为糖尿病患者体内的高血糖状态可通过糖有氧氧化增加、多元醇代谢途径和己糖胺生物合成通路的激活、蛋白的非酶糖基化作用的加强等导致体内活性氧簇产生过多,从而引发氧化应激反应,活化一系列应激信号途径而导致组织器官损伤[4-6]。近年,随着血糖波动在糖尿病发病机制中的作用被不断证实[7-9],血糖波动与氧化应激关系的研究也已引起普遍关注。Monnier等[1]体外细胞培养实验发现波动性高血糖增加脐静脉内皮细胞蛋白激酶C的活性,促进氧化应激和氧自由基形成,使细胞间黏附分子的表达增加。在对糖尿病鼠的研究中也显示血糖的异常波动易造成氧化应激状态的现象[10]。这些建立在细胞水平及动物实验的结果均提示异常的血糖波动与氧化应激的激活密切相关,由此激发的氧化应激可能导致了相关疾病的发生和发展。
随着动态血糖监测系统的不断完善,较准确地测定人体内血糖波动情况已成为可能。MAGE是动态血糖监测中反映体内血糖波动的参数之一,被认为是目前评估血糖波动的“金指标”。本研究以周健等[11]提出的中国人MAGE的正常参考值为标准,将血糖控制良好的2型糖尿病患者分为两组,通过检测反映体内氧化应激平衡状态的代表性指标血清SOD和MDA的水平,来评估不同血糖波动状况下患者体内氧化应激情况。结果发现,在控制了年龄 、BMI、血压 、FPG 、HbA1c等因素的情况下 ,两组患者空腹胰岛素、胰岛素抵抗指数差异仍有统计学意义,提示血糖波动大的糖尿病患者胰岛素抵抗更为明显。研究结果还显示:与正常波动组比较异常波动组MDA明显升高,而SOD明显降低;MAGE与InRI和MDA均呈正相关,但与SOD呈负相关,进一步提示了血糖波动对患者体内氧化应激系统的影响是独立于血糖平均水平与糖化血红蛋白之外的。
异常的血糖波动参与体内氧化应激系统失衡的具体机制目前尚不清楚,结合本试验参考相关文献考虑可能为:①异常的血糖波动增加了胰岛素抵抗,胰岛素抵抗可导致机体处于一种氧化应激状态,诱发机体持续、轻微的慢性炎症;②波动性血糖易通过多聚二磷酸腺苷核糖聚合酶途径促进硝基酪氨酸的形成及提高黏附分子的表达[12],通过依赖蛋白激酶C活化的还原型辅酶Ⅰ/Ⅱ氧化酶等刺激活性氧的过度生成[13];③波动性高血糖可作用于细胞内信号传导通路,活化蛋白激酶C,激活钙调节通道等促进氧化应激和氧自由基形成[14];④波动性血糖减弱了高葡萄糖浓度状态下,细胞通过改变某些代谢状态或进行调节性反馈来部分拮抗葡萄糖毒性作用,加重了体内氧化应激系统的失衡等。
总之,异常的血糖波动可能通过激活或加重体内氧化应激反应参与了糖尿病及其并发症的发生及发展。但有关血糖波动及其介导的信号通路在氧化应激反应中的意义,仍需进一步的研究和观察。
[1]Monnier L,Mas E,Ginet C,et al.Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemiain patients with type2 diabetes[J].JAMA,2006,295(14):1681-1687.
[2]Roberts CK,Sindhu KK.Oxidative stress and metabolic syndrome[J].Life Sci,2009,84(21/22):705-712.
[3]Rahangdale S,Yeh SY,Malhotra A,et al.Therapeutic interventions and oxidative stress in diabetes[J].Front Biosci,2009,14:192-209.
[4]Forbes JM,Coughlan MT,Cooper ME.Oxidative stress as a major culprit in kidney disease in diabetes[J].Diabetes,2008,57(6):1446-1454.
[5]Maiese K,Chong ZZ,Shang YC.Mechanistic insights into diabetes mellitus and oxidative stress[J].Curr Med Chem,2007,14(16):1729-1738.
[6]Shen GX.Oxidative stress and diabetic cardiovascular disorders:roles of mitochondria and NADPH oxidase[J].Can J Physiol Pharmacol,2010,88(3):241-248.
[7]Muggeo M,Zoppini G,Bonora E,et al.Fasting plasma glucose variability predicts 10-year survival of type 2 diabetic patients:the Verona Diabetes Study[J].Diabetes Care,2000,23(1):45-50.
[8]Al Dorzi HM,Tamim HM,Arabi YM.Glycaemic fluctuation predicts mortality in critically ill patients[J].Anaesth Intensive Care,2010,38(4):695-702.
[9]谭艳华,申月.动态血糖监测对糖尿病肾病患者的意义[J].吉林医学院学报,2011,32(1):24-26.
[10]Minamiyama Y,Bito Y,Takemura S,et al.Calorie restriction improves cardiovascular risk factors via reduction of mitochondrial reactive oxygen species in typeⅡdiabetic rats[J].JPharmacol Exp Ther,2007,320(2):535-543.
[11]Zhou J,Li H,Ran X,et al.Referencevaluefor continuous glucose monitoring in Chinese subjects[J].Diabetes Care,2009,32(7):1188-1193.
[12]Piconi L,Quagliaro L,Da Ros R,et al.Intermittent high glucose enhances ICAM-1,VCAM-1,E-selectin and interleukin-6 expression in human umbilical endothelial cells in culture:the role of poly(ADP-ribose)polymerase[J].J Thromb Haemost,2004,2(8):1453-1459.
[13]Quagliaro L,Piconi L,Assaloni R,et al.Intermitent high glucose enhances apoptosis related to oxidative stress in human umbilical vein endothelial cells:the role of protein kinase C and NAD(P)H-oxidase activation[J].Diabetes,2003,52(11):2795-804.
[14]Anonymous.Glucose tolerance and mortality:comparison of WHO and American Diaketes Association diagnostic criteria.The DECODE study group,European Diabetes Epidemiology Group.Diabetes Epidemiology:Collaborative analysis of Diagnostic criteria in Europe[J].Lancet,1999,354(9179):617-621.

