抗IgA Fc受体抗体的作用机制
刘春蓓综述 秦卫松审校
·基础医学·
抗IgA Fc受体抗体的作用机制
刘春蓓1,2综述 秦卫松2审校
体外实验和动物实验证实,抗IgA Fc受体I(FcαRI)单抗具有抑制炎症信号通路,治疗感染性疾病、改善免疫及非免疫相关肾脏疾病肾组织病变等作用。虽然早有研究证实抗FcαRI单抗的疗效与FcαRI中抑制性免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motifs,ITAM)介导的抑制性信号(ITAMi)有关,但直到近期ITAMi的分子机制才被阐明,即低亲和性配体或单克隆抗体与FcαRI结合后可促使FcαRI移位及含Src同源结构域2(Src homology 2,SH2)的酪氨酸磷酸酶1(SHP-1)在细胞膜脂质结构中募集,激活性受体与FcαRI等受体及SHP-1在细胞脂筏上的共区域化促进了大分子抑制体的形成,在SHP-1的作用下激活信号被抑制。这一机制的明确为IgA FcαRI单抗治疗肾脏疾病提供了新的理论依据。
免疫受体 Fc受体I IgA 酪氨酸基序
免疫受体介导的信号转导包括活化性受体和抑制性受体两条通路,两者相互作用、相互制约,是维持机体免疫稳态的重要机制之一。多数激活性受体胞质区都含有免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motifs,ITAMs),而抑制性受体胞质区含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibition motifs,ITIMs),分别参与作用相反的两条信号通路。含有ITAM的受体兼有激活和抑制免疫细胞两种自相矛盾的作用;受体介导的抑制性信号(ITAMi)也是调控炎症反应、维持免疫稳态的“功臣”。然而,其潜在作用机制一直未能澄清。
IgA Fc受体I(FcαRI)是众多含ITAM结构的激活性受体中的一种,近年来不断有报道抗人FcαRI单抗对肾脏、风湿免疫及炎症性疾病有治疗作用。体外和动物实验均证实,抗FcαRI单抗具有抑制炎症反应的作用,可延缓抗基膜肾病、单侧输尿管梗阻(UUO)等肾脏疾病进展[1-3]。尽管有证据表明抗FcαRI单抗的疗效与FcαRI所含ITAM介导的抑制性信号有关[3],但ITAMi及募集至ITAMs的含Src同源结构域2(Src homology 2,SH2)的酪氨酸磷酸酶1(SHP-1)的作用机制尚不明确。本文就FcαRI,抗FcαRI单抗在疾病治疗中的作用及ITAMi信号通路的作用机制做一综述。
IgA及其受体
IgA是一种独特的抗体,其分子式、亚型及糖基化非常多元化。人体内 IgA产量高达66 mg/(kg·d),高于其他所有免疫球蛋白总和[4],并通过黏膜表面分泌。不同于其他免疫球蛋白的Y型结构,IgA呈T型,其亚型IgA1和IgA2的区别在于后者铰链区较前者少13个氨基酸序列,因此IgA2可以抵抗细菌蛋白酶,黏膜分泌性IgA也以该亚型为主。小鼠血清IgA只有一种类型,且为多聚体,主要通过肝胆系统清除。人血清IgA大多数为骨髓浆细胞来源的单体,而分泌性IgA在通过内皮细胞转运至黏膜表面时成为二聚体。人血清IgA具有免疫抑制作用,却很少参与全身免疫反应,某些异型IgA又有致病作用。血清IgA单体(m IgA)抗炎作用强,在无抗原情况下,血清IgA可下调IgG介导的吞噬、化学趋化和杀菌作用,抑制细胞因子释放[5]。IgA还具免疫保护作用[6],选择性IgA缺陷患者IgA1和IgA显著减少或缺乏,IgG和IgM正常或减少,不仅易患呼吸道和消化道感染,还好发自身免疫及过敏性疾病,如自身免疫性内分泌病、慢性活动性肝炎、溃疡性结肠炎、克隆病和自身免疫性血液病等。
目前已知IgA受体有5种,其中FcαRI只表达于骨髓来源的细胞,如中性粒细胞、多数单核/巨噬细胞、树突状细胞、Kuppfer细胞和嗜酸性细胞等。FcαRI是一种跨膜糖蛋白,由氨基酸的胞膜外区、跨膜结构域和胞质区组成,具有6个潜在糖基化位点,糖基化FcαRI分子量为55~75kD。FcαRI表达水平不依赖IgA水平,IgA缺陷患者细胞表面FcαRI水平与正常人无差异[7]。编码FcαRI的基因位于人19号染色体,包括5个外显子S1、S2、EC1、EC2和TM/C。EC1和EC2分别编码胞膜外区的两个免疫球蛋白样结构域。
FcαRI的信号转导经由与受体结合的FcRγ完成。FcαRI在跨膜区以静电吸引与γ链形成FcαRI/γγ三聚体,之后γ链的ITAM结构被Src家族蛋白激酶磷酸化,进一步引发下游信号传导,导致Ca2+的释放、脱颗粒和IgA降解。中性粒细胞和单核细胞FcαRI有两种表达形式,一种与γ链形成复合物,另一种不与γ链结合,后者不能介导免疫复合物的降解、处理和抗原呈递,但能循环使用内化的IgA免疫复合物,防止其降解。具有信号转导活性的γ链ITAM可转运IgA至晚期内吞小体,这些小体的变构、激活是IgA免疫复合物有效降解的必要成分[8]。
FcαRI在细胞的表达水平受多种细胞因子调节,如肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、脂多糖(LPS)及IL-8促进其表达,而转化生长因子β(TGF-β)、苏拉明(生长因子抑制剂)和p IgA等则抑制其表达[9]。目前合成的抗FcαRI鼠及人单克隆抗体有10种[10,11]。IgA结合于EC1结构域,抗FcαRI则分别与EC1区或EC2区结合。结合于EC1的单克隆抗体(如My43,2E6,2D11,7G4,2H8)可阻止IgA与其受体结合,而结合于EC2的抗体(A59,A62,A77,7D7,MIP-8a)无此作用。有研究报道,IgA水平增高与FcαRI表达异常下降有关[9]。检测IgA肾病、HIV感染、肝硬化等IgA相关疾病患者外周血单核细胞后发现,其细胞表面FcαRI表达水平均降低,补充IgA可使FcαRI表达下调[9],这一现象与IgA结合了FcαRI的细胞外区域有关[12]。
将多聚IgA加入转染人FcαRI的细胞后,可在细胞培养上清中检出可溶性FcαRI,IgA患者外周血也可检出该分子,而健康人血清中不能检出。可溶性FcαRI水平与FcαRI和FcRγ的偶联程度有关,不与FcRγ偶联的FcαRI在细胞表面聚集,易出现其细胞外区域裂解和游离FcαRI释放。近期又发现了一种可溶性FcαRI,它可与健康人血清中的多聚IgA结合,糖基化程度较低[13]。不同于患者体内发现的可溶性FcαRI,这种FcαRI通过FcRγ依赖的通路以蛋白裂解形式产生[14]。
FcαRI的功能
FcαRI结合IgA形成免疫复合物,能引起很多生物学过程,如吞噬、抗体依赖细胞介导的细胞毒作用(ADCC),促进细胞因子和炎症介质释放等,也可调节细胞激活状态,从而参与免疫反应[15]。如刺激单核细胞分泌TNF-α、前列腺素和白细胞三烯,释放超氧化物。同样,也可刺激中性粒细胞引发呼吸爆发和超氧化物释放。与IgG免疫复合物相比,IgA免疫复合物能更有效地激活中性粒细胞。
IgA在黏膜免疫防御中的作用已被广泛认可。FcαRI在黏膜细胞上的表达很不均一,如在肠巨噬细胞不表达,而表达于人肺泡巨噬细胞和未成熟树突状细胞等。不同细胞受体表达的不均一性可能与生理需要有关,如人Kupffer细胞表达FcαRI有利于通过黏膜屏障清除细菌,血清IgA可使表达FcαRI的Kupffer细胞有效地消化大肠杆菌。在炎症介质导致黏膜屏障破坏的病理情况下,树突细胞及Kupffer细胞可起二次防御作用。临床观察发现革兰阴性菌脓毒症患者外周血单核细胞表面与Fcα偶联的FcαRI上调,可能与二次防御作用有关[16]。
FcαRI转基因诱导的IgA肾病动物模型
2000年法国研究者Launay等[17]报道了一种转染人FcαRI的小鼠模型,其单核/巨噬细胞表面高表达FcαRI,并自发产生IgA肾病。小鼠IgA二聚体与FcαRI结合后释放可溶性FcαRI/IgA复合物,进而沉积于肾脏造成IgA肾病。两者结合力低,用等离子共振技术也难以测出。免疫缺陷的野生型小鼠输入上述转基因鼠血清可复制IgA肾病,事先注射抗FcαRI抗体后则小鼠不发病,进一步证实了可溶性FcαRI/IgA复合物的致病作用[18]。此外,SCID-FcαRI转基因鼠在注射IgA肾病患者的IgA后可出现IgA肾病,而注射正常人外周血IgA则无此现象,表明只有IgA肾病外周血IgA可占据FcαRI表位导致IgA肾病。值得注意的是,由于可溶性FcαRI半衰期较短,C57BL/6小鼠单次注射重组FcαRI不会致病[19]。而转基因鼠可高表达FcαRI,鼠IgA与人FcαRI持续作用产生高水平的可溶性FcαRI/IgA复合物,因而FcαRI转基因鼠外周血可出现大量FcαRI/IgA,并进一步沉积于肾脏[17]。由于IgA肾病是一种慢性疾病,单次注射可溶性FcαRI不足以维持循环FcαRI/IgA复合物水平。
2007年Kanamaru等[2]发现,FcαRI的聚集可促进细胞因子/化学因子释放,引起炎症反应,是介导IgA肾病进展的重要因素。部分FcαRI的α链与含ITAM的Fc受体γ(FcRγ)链相连,在偶联FcαRI条件下,ITAM具有介导细胞激活/抑制双重作用;在生理情况下,血清IgA和FcαRI主要起抗炎作用[15];病理情况下则起促炎症作用。
ITAM与抑制性信号通路
通常受体激活后转导的抑制性信号由该受体胞质区所含的ITIM结构介导。含ITIM的受体激活后,由Src家族激酶介导ITIM酪氨酸残基磷酸化,募集抑制性信号分子,如肌醇磷脂磷酸酶(SHIP),含SH2的SHP-1和SHP-2。这些磷酸酶可进一步使活化的信号分子(如Syk,VAV-1,PLC-γ)脱磷酸,还可使衔接蛋白及细胞骨架蛋白中的酪氨酸脱磷酸,激活抑制性信号通路。含ITIM的受体可识别多种配体,如自然杀伤细胞可识别主要组织相容性复合体I(MHC I),Fcγ受体Ⅱb(FcγRⅡb)识别IgG Fc段并与免疫复合物结合。这些ITIM的受体广泛分布于细胞表面,以防止细胞过度激活。含ITIM的受体通常识别共分布于细胞表面的远隔配体,这种相互识别和交联可导致含ITIM激活受体的聚集,使ITIM相关的磷酸酶易于接近其靶点而发挥抑制作用,同时也加速了ITIM酪氨酸激活性受体相关的激酶磷酸化,在激活与抑制性受体间构建相互作用的桥梁[20,21]。
ITAM也可介导ITAMi,近期Pfirsch-Maisonnas等[22]的研究详细阐述了ITAMi信号介导抗FcαRI单抗治疗作用的机制。ITAMi信号的传导涉及抑制和激活性受体及系列信号分子在胞质内形成抑制体结构。SHP-1的募集及肌动蛋白去极化是参与该抑制体形成的重要因素。
ITAMi介导的抑制信号起始于激活及抑制性受体在细胞内部分的聚集。将FcαRI转染兔嗜碱性白血病细胞(RBL,属肥大细胞样细胞系),培养基中加入抗FcαRI单抗可抑制RBL细胞脱颗粒。共聚焦显微镜动态观察发现,该抑制作用与单抗介导的激活及抑制性受体在胞内的聚集有关。延长抗体孵育时间发现还有其他成分参与受体胞内部分的聚集,如单核细胞的细胞因子受体CCR2。由于只在ITAMi中可检出此结构,故命名为抑制体。抑制体由系列信号分子组成,包括蛋白质酪氨酸激酶(Lyn),SHP-1,F肌动蛋白,FcαRI及蛋白质络氨酸激酶(Syk),Syk位于抑制体结构表面。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族的胞外信号调节激酶(extracellular signalregulated kinase,ERK)不参与抑制体,但对ITAMi起调控作用。
FcRγ链的ITAM对介导抑制体的形成起重要作用。FcRγ中ITAM结构的酪氨酸残基磷酸化才具有抑制功能,分别用含正常ITAM、无法产生完整磷酸化信号的ITAM或不含ITAM的三种FcαRI进行试验,则后两种FcαRI不能形成胞质内抑制体。因此ITAMi需要FcRγ的ITAM产生的信号参与。
SHP-1是抑制小体和抑制性信号形成的必要信号传导分子。它是一种免疫信号抑制剂,m IgA结合FcαRI后可诱导SHP-1向受体聚集,敲除SHP-1后可逆转FcαRI的抑制作用,并可使FcαRI从抑制体中消失。脂筏是SHP-1依赖的抑制小体聚集的重要结构。共聚焦显微镜观察发现,加入抗FcαRI单抗前FcαRI随机分布于脂筏中[23];加入单抗后FcαRI募集至脂膜,并参与抑制体形成。如用MβCD破坏脂筏结构,可影响细胞内蛋白簇结构的极化和聚集[24]。蔗糖密度梯度分析发现,SHP-1也存在于脂筏结构中,但在抗FcαRI单抗孵育2h后其成分明显减少,与其随时间推移进入细胞质参与抑制体形成有关[25]。此外,单体IgA结合FcαRI后,脂筏局部的抑制性磷酸化活性明显增高,也证实SHP-1参与了在脂筏中的聚集。
抑制小体的形成依赖肌动蛋白解聚。细胞被激活募集的过程受肌动蛋白骨架调节,SHP-1使F肌动蛋白去磷酸化促进后者解聚。刺激F肌动蛋白解聚的药物可以逆转抑制信号通路。
概括地讲,经典的ITIM介导的抑制信号,含有抑制性ITIM的FcγRⅡ与FcγRⅢ通过免疫复合物的Fc片段连接在一起,FcγRⅡb的ITIM酪氨酸磷酸化后募集SHIP(某些含ITIM的受体募集SHP-1或SHP-2),进一步通过脱磷酸活性受体及下游的信号介质产生抑制作用(图1A);在ITAM介导的抑制信号中,单体IgA或Fab片段与两个FcαRI共价结合形成二聚体,介导SHP-1向位于脂筏中的FcαR胞质内ITAM结构聚集,各种产生激活信号的受体被相应配体结合后在脂筏中聚集,同FcαRI及SHP-1形成共聚体,SHP-1介导的抑制性信号开始于脂筏内,止于细胞内抑制体结构的形成(图1B)。
由此可见,ITAMi与ITIM信号通路存在很多差异。ITIMi通路中靶受体不直接接触细胞脂筏,而ITAM通路中脂筏功能被改变,受体聚集并进入细胞与其它分子形成专门传递抑制信号的细胞内成分。ITIM中受体通过选择性连接某些特异性的靶受体表面的配体而聚集在一起,在细胞外形成大分子或可溶性复合物而传递信号;而含ITAM的抑制性受体被可溶性配体激活后,广泛抑制进入细胞脂筏的多种受体。可见两种抑制性信号在体内所起的作用不同,ITIM相关受体选择性结合细胞表面配体,特异性调节免疫效应,是细胞对多种环境刺激产生的主要反应;ITAMi则通过可溶性细胞外低亲和性配体介导广泛的抑制作用,防止细胞过度激活和炎症介质过度释放[26]。
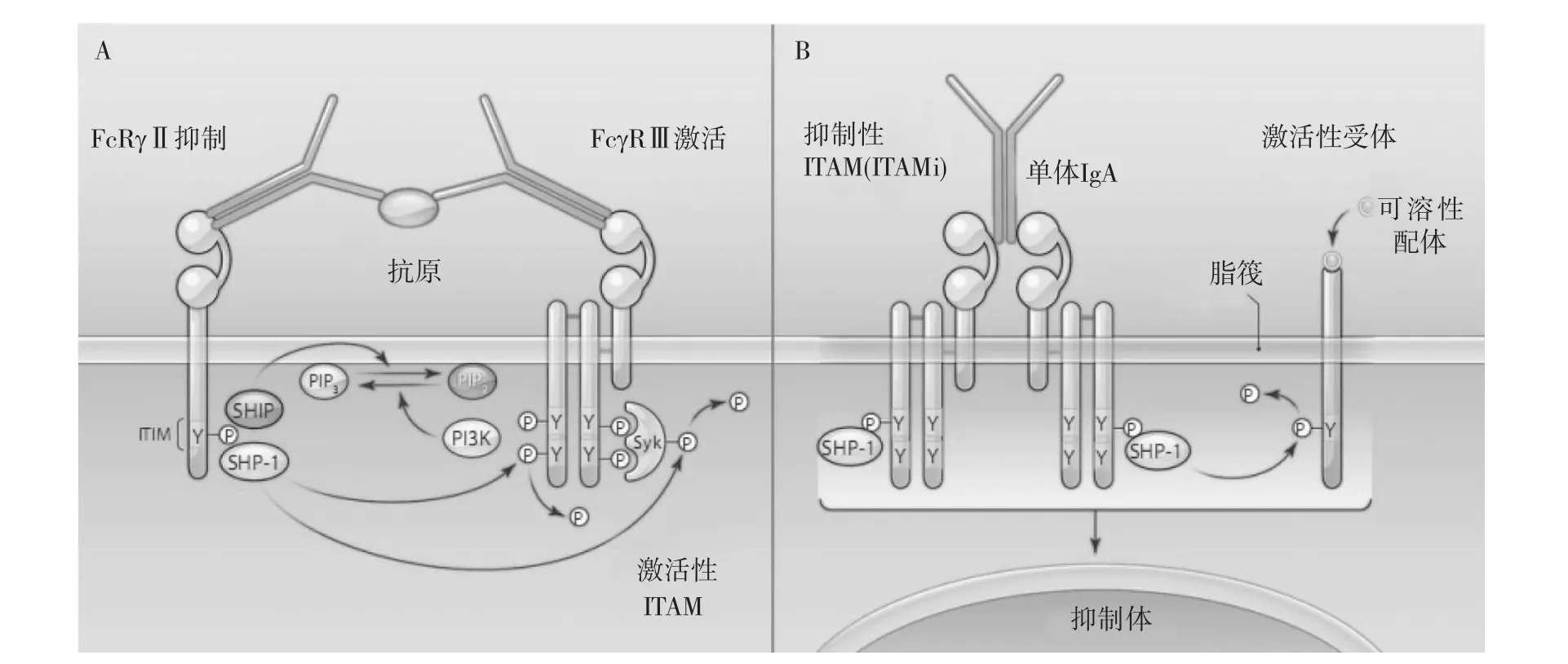
图1 ITIM和ITAM i抑制性信号的机制
ITAMi与免疫治疗的新方法——静脉m IgA及抗FcαRI单抗
静脉用免疫球蛋白(IVIg)可用于治疗免疫介导的原发性血小板减少性紫癜(ITP),Kawasaki病及格林巴利综合征等多种疾病,但其治疗机制不明[27,28],可能与 ITAMi介导的抗炎反应相关。Pasquier等[29]通过不同炎症性动物模型来观察FcαRI介导的ITAMi是否有预防疾病的作用,如FcαRI转基因小鼠的哮喘模型,发现预先注射抗FcαRI单抗(激活ITAMi信号)的小鼠症状明显缓解,肺组织病理检查发现支气管周围及血管周围炎症浸润明显减少。另有研究发现,抗FcαRI单抗对免疫介导的肾小球肾炎及非免疫介导的梗阻性肾病均有治疗作用,可减少肾组织炎细胞浸润及纤维化进展[1-3]。有趣的是,FcαRI单抗还可抑制LPS、TNF-α和MCP-1刺激后的单核细胞激活。上述现象说明ITAMi信号可控制多种异源性及自源性炎症反应,抗FcαRI单抗可成为治疗肾炎的新手段。m IgA是否与IVIg一样可用于炎症疾病的治疗有待进一步研究。
总之,IgA及其受体通过ITAMi和IgA系统在维持全身及黏膜免疫稳态中起重要作用。IgA及FcαRI单抗的实验研究和ITAMi抑制信号机制的研究表明,单体IgA及FcαRI单抗有可能成为疾病的治疗手段。
1 Kanamaru Y,Pfirsch S,Aloulou M,etal.Inhibitory ITAM signaling by Fc alpha RI-FcR gamma chain controlsmultiple activating responses and prevents renal inflammation.J Immunol,2008,15;180(4):2669 -2678.
2 Kanamaru Y,Arcos-Fajardo M,Moura IC,et al.Fc alpha receptor I activation induces leukocyte recruitment and promotes aggravation of glomerulonephritis through the FcR gamma adaptor.Eur J Immunol,2007,37(4):1116-1128.
3 Blank U,Launay P,Benhamou M,et al.Inhibitory ITAMs as novel regulators of immunity.Immunol Rev,2009,232(1):59-71.
4 Solomon A.Monoclonal immunoglobulins as biomarkers of cancer.In:Sell S,ed.Cancer Markers:Developmental and Diagnostic Significance.Clifton,NJ:Humana Press,1980:57-87.
5 Kerr MA.The structure and function of human IgA.Biochem J,1990,15,271(2):285-296.
6 Schaffer FM,Monteiro RC,Volanakis JE,et al.IgA deficiency. Immunodefic Rev,1991,3(1):15-44.
7 Chevailler A,Monteiro RC,Kubagawa H,et al.Immunofluorescence analysis of IgA binding by human mononuclear cells in blood and lymphoid tissue.J Immunol,1989,142(7):2244-2249.
8 Launay P,Patry C,Lehuen A,et al.Alternative endocytic pathway for immunoglobulin A Fcreceptors(CD89)depends on the lack of FcR association and protects against degradation of bound ligand.J Biol Chem,1999,274(11):7216-7125.
9 Grossetête B,Launay P,Lehuen A,et al.Down-regulation of Fc. Receptors on blood cells of IgA nephropathy patients:evidence for a negative regulatory role of serum IgA.Kidney Int,1998,53(5):1321 -1335.
10 Monteiro RC,Cooper MD,Kubagawa H.Molecular heterogeneity of Fc alpha receptors detected by receptor-specificmonoclonal antibodies.J Immunol,1992,148(6):1764-1770.
11 Shen L,Lasser R,Fanger MW.My43,a monoclonal antibody that reactswith human myeloid cells inhibitsmonocyte IgA binding and triggers function.J Immunol,1989,143(12):4117-4122.
12 Montenegro V,Chiamolera M,Launay P,et al.Impaired expression of IgA Fc receptors(CD89)by blood phagocytic cells in ankylosing spondylitis.JRheumatol,2000,27(2):411-417.
13 van der Boog PJ,van Zandbergen G,de Fijter JW,etal.Fc alpha RI/ CD89 circulates in human serum covalently linked to IgA in a polymeric state.J Immunol,2002,1,168(3):1252-1258.
14 van Zandbergen G,Westerhuis R,Mohamad NK,et al.Crosslinking of the human Fc receptor for IgA(Fcalpha RI/CD89)triggers FcR gamma-chain-dependent shedding of soluble CD89.JImmunol,1999,163(11):5806-5812.
15 Almogren A,Kerr MA.Irreversible aggregation of the Fc fragment derived from polymeric but notmonomeric serum IgA1—implications in IgA-mediated disease.Mol Immunol,2008,45(1):87-94.
16 Wines BD,Willoughby N,Fraser JD,et al.A competitive mechanism for staphylococcal toxin SSL7 inhibiting the leukocyte IgA receptor,Fc alphaRI,is revealed by SSL7 binding at the C alpha2/C alpha3 interface of IgA.JBiol Chem,2006,281(3):1389-1393.
17 Launay P,Grossetete B,Arcos-Fajardo M,et al.Fcalpha receptor(CD89)Fcalpha receptor(CD89)mediates the development of immunoglobulin A(IgA)nephropathy(Berger's disease).Evidence for pathogenic soluble receptor-Iga complexes in patients and CD89 transgenic mice.JExp Med,2000,5;191(11):1999-2009.
18 Otten MA,Rduolph E,Dechant M,et al.Immature neutrophils mediate tumor cell killing via IgA but not IgG Fc receptors.J Immunol,2005,1;174(9):5472-5480.
19 Novak J,Julian BA,Tomana M,et al.Progress in molecular and genetic studies of IgA nephropathy.J Clin Immunol,2001,21:310 -327.
20 Blank U,Launay P,Benhamou M,et al.Inhibitory ITAMs as novel regulators of immunity.Immunol Rev,2009,232(1):59-71.
21 Karra L,Levi-Schaffer F.Down-regulation of mast cell responses through ITIM containing inhibitory receptors.Adv Exp Med Biol,2011,716:143-159.
22 Pfirsch-Maisonnas S,Aloulou M,Xu T,et al.Inhibitory ITAM signaling traps activating receptors with the phosphatase SHP-1 to form polarized“inhibisome”clusters.Sci Signal,2011,4(169):ra24.
23 Janes PW,Ley SC,Magee AI.Aggregation of lipid rafts accompanies signaling via the T cell antigen receptor.JCell Biol,1999,147(2):447-461.
24 Klein U,Gimpl G,Fahrenholz F.Alteration of the myometrial plasma membrane Cholesterol content with b-cyclodextrin modulates the binding affinity of the oxytocin receptor.Biochemistry,1995,34(42):13784-13793.
25 Pombo I,Rivera J,Blank U.Munc18-2/syntaxin3 complexesMunc18-2/syntaxin 3 complexes are spatially separated from syntaxin3-containing SNARE complexes.FEBS Lett,2003,550(1-3):144 -148.
26 Ivashkiv LB.How ITAMs inhibit signaling.Sci Signal,2011,4(169):pe20.
27 Clynes R.Protectivemechanisms of IVIG.Curr Opin Immunol,2007,19(6):646-651.
28 Nimmerjahn F,Ravetch JV.Anti-inflammatory actions of intravenous immunoglobulin.Annu Rev Immunol,2008,26:513-533.
29 Pasquier B,Launay P,Kanamaru Y,et al.Identification of FcalphaRI as an inhibitory receptor that controls inflammation:dual role of FcRgamma ITAM.Immunity,2005 Jan;22(1):31-42.
M echanism of anti-FcαRImonoantibody treatm ent
LIU Chun-bei1,2,QINWei-song21Medical College of Nanjing University,Nanjing 210093,China
2Research Institute of Nephrology,Jinling Hospital,Nanjing University School of Medicine,Nanjing 210002,China
Anti-FcαRI antibody treatment has been reported in recent years to be effective in controlling inflammatory and kidney diseases,such as immune related and nonimmune related renal disease.Inhibitory immunoreceptor tyrosine-based activation motifs(ITAMi)have been found to be involved in the mechanism of treatment other than activating effects,butmechanisms of inhibitory signaling are poorly understood.New evidence of low avidity ligation of the ITAM-associated FcαRI explained how ITAM broadly inhibits heterologous receptors,which involves translocation of receptor and the associated inhibitory Src homology 2(SH2)domain-containing phosphatase-1(SHP-1)tomembrane lipid rafts,colocalization of activating receptors with FcαRIand SHP-1 and trafficking to an inhibitory intracellular compartment termed the inhibisome.Thus,ITAM suppressive signals subvert the activating function of rafts to promote incorporation of receptors into supramolecular domains where signaling molecules are deactivated by SHP-1.These results provided new evidence for anti-FcαRIantibody therapy in the treatment of renal disease.
immunoreceptors FcαRI immunoglobulin A tyrosine-based motifs
2011-08-05
(本文编辑 春 江)
1南京大学医学院(南京,210093);2南京军区南京总医院全军肾脏病研究所

