不同油脂对瘤胃微生物体外产气及其区系动态变化的影响
扬州大学动物科学与技术学院 郝志敏 王 曙 王 龙 王 晗 王洪荣*
在反刍动物生产实践中,植物油脂是高温与高产季节良好的能量饲料,同时还能够调控瘤胃微生物各区系的比例和微生物的发酵,改变瘤胃微生物的发酵模式,从而减少甲烷的发酵产量、提高饲料资源的利用效率。但植物油脂调控瘤胃微生物过程中微生物活力的动态变化规律还不十分明了。为此,本试验拟在体外培养体系中添加花生油、菜油、玉米油和豆油等不同结构的植物油脂进行体外培养,旨在解析不同油脂对瘤胃微生物发酵产气、微生物各区系活力的动态变化等影响的规律,为在实际生产中恰当应用油脂提供参考。
1 材料与方法
1.1 试验动物 试验动物是来自扬州大学农牧场安装有永久性瘤胃瘘管的3只徐淮白山羊,试验羊单舍饲养以玉米+豆粕、羊草为日粮常规饲养,自由清洁饮水,用于采集瘤胃液。
1.2 瘤胃液采集 用装有40目尼龙滤网的真空负压装置于饲喂后3 h在3只瘘管羊瘤胃共采集450 mL瘤胃液,装入内部预温瓶迅速带回实验室,经双层纱布过滤后通CO2气体39℃待用。
1.3 试验底物设计 选用纤维素、酪蛋白、淀粉等为培养底物,分别添加4%的菜籽油、豆油、花生油和玉米油等为A、B、C、D四组,每组2个重复。具体见表1,另外设一空白对照组。
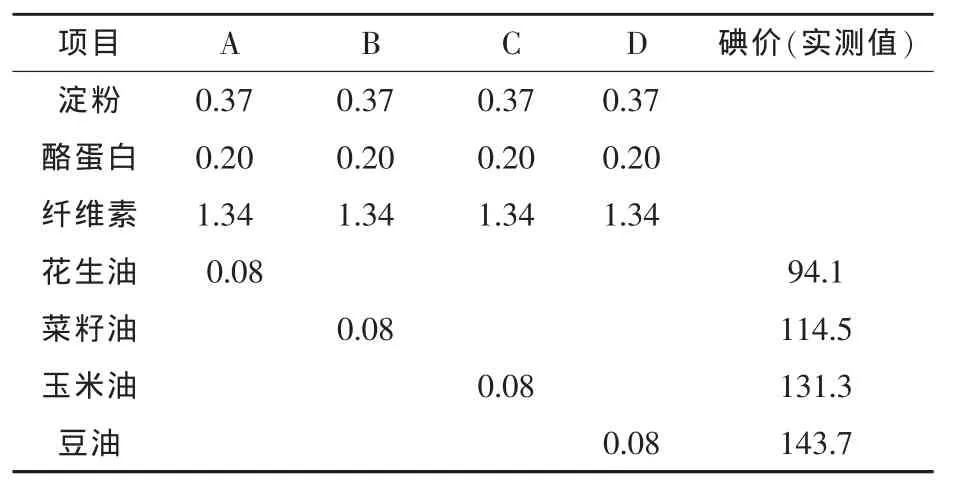
表1 四组培养底物的配方 g
1.4 体外发酵装置 使用250 mL锥形瓶作为培养瓶,瓶塞采用设有三个通路的橡皮塞,一个持续供应CO2,一个进行气体交换,一个取样通路。
1.5 人工唾液盐配制 按照Menke和Steingass(1988)的方法配制。
1.5.1 缓冲试剂和常量元素溶液——A液 称取K2HPO4·3H2O 382.51 mg,KH2PO4292 mg,(NH4)2SO4480 mg,NaCl 200 mg,MgSO4·7H2O 100 mg和Na2CO34000 mg。将上述试剂溶解混合后加入蒸馏水定容至1000 mL。该溶液在使用前一天配制待用。
1.5.2 微量元素溶液——B液 准确称取Na4·EDTA 500 mg,FeSO4·7H2O 200 mg,MnCl4·4H2O 200 mg,ZnSO4·7H2O 10 mg,H3BO330 mg,CoCl2·6H2O 20 mg,CuCl2·2H2O 1 mg,NiCl2·6H2O 2 mg和NaMoO43 mg。将上述试剂溶解混合后加蒸馏水定容至1000 mL。持续通入CO218 h后,盖严瓶口,置于冰箱备用。
1.5.3 还原剂溶液——C液 称取25 g Na2S·9H2O,加80 mL蒸馏水溶解后在100 mL容量瓶中定容至100 mL,持续充入CO220 min后,盖严瓶口,现配现用。
1.5.4 维生素溶液——D液 称取硫胺素20 mg,泛酸钙 20 mg,烟酸胺 20 mg,核黄素 20 mg,吡哆醇20 mg,生物素0.2 mg,对氨基苯甲酸1 mg,叶酸 0.125 mg,四氢叶酸 0.125 mg,将上述试剂溶解混合后加蒸馏水定容至1000 mL。
1.5.5 缓冲液制备 准确量取782.4 mL A液,8 mL B液,经充分混合后持续通入CO218 h,并于培养前1 h加入1.6 mL C液,以及D液8 mL,充分混合,持续通入CO2气体10 min,盖严瓶口,置于恒温水浴中预热至39℃待用。
1.5.6 瘤胃液采集与培养液的配制 饲喂后1~2 h在三只瘘管羊瘤胃分别采集瘤胃液约200 mL,装入内部预温保温瓶迅速带回实验室,通CO2,置于39℃水浴中保温。在培养开始前以2∶1的比例先后加入人工唾液盐和瘤胃液配制成培养液,冲CO2后密封并于39℃水浴待用。
1.6 体外培养与产气试验
1.6.1 体外培养与取样设计 取1.2 g底物,放入锥形瓶,加入120 mL培养液,39℃水浴摇床(50 r/min)培养;分别在培养后 0、4、8、12、16、24 h 取样,每次取约10 mL培养液,分别装入2支5 mL的离心管中,其中1支立即离心取上清测定总脱氢酶酶活、另外1支立即-20℃冷冻保存,待分离微生物与微生物DNA的测定。
1.6.2 产气试验 取200 mg底物,以长柄勺置入注射器底部,再加入30 mL培养液,39℃水浴摇床(50 r/min)培养;在 2、4、6、8、10、12、14、16、18、20、24 h和36 h时读取产气量,并注意注射器气体量满后放掉气体。
1.7 测定指标及方法
1.7.1 总脱氢酶测定 取100目尼龙布过滤的新鲜瘤胃液2 mL于试管中,加入0.2 mL 1.5%的氯化三苯四氮唑(TTC)反应,而对照管先加入5 mL异丙醇抑制酶反应。在厌氧条件下恒温水浴(38~39℃)10 min。处理组加入5 mL异丙醇终止反应后,以4000 r/min离心10 min。上清液稀释 15倍,于分光光度计在485 nm处比色。定义在38.5℃、pH 6.8条件下,每分钟引起测定液吸光度上升0.1的酶量为1个酶活单位。活力单位(U/mL)=(样品A485 nm/min-对照 A485 nm/min)×15。
1.7.2 微生物分离及其DNA的测定 微生物分离原理:由于各区系微生物的大小、密度不同,因此采用差速离心可以分离。
微生物的分离具体步骤:参考Czerkawshi(1976)、Martín-Orúe 等(1998)、欧宇(2003)等的方法。(1)原虫:取瘤胃液加等体积生理盐水置于恒温(39℃)水浴锅中震荡(125 r/min)水浴孵育 60 min,并辅以搅拌;再经4层纱布过滤,滤液离心(150 g,10 min),收集沉淀为原虫,用生理盐水洗涤两次后用生理盐水悬浮,-20℃贮存待测。(2)细菌:收集(1)离心后上清液,再高速离心(22000 g,15 min),收集沉淀为细菌,其余处理同(1)。
微生物DNA测定具体步骤(二苯胺显色法):标准溶液:取小牛胸腺DNA钠盐以0.01 mol/L氢氧化钠溶液配成200 μg/mL的DNA标准溶液。二苯胺试剂:称取1 g重结晶二苯胺,溶于100 mL冰乙酸(AR)中,再加入 10 mL过氯酸(60%以上),混匀待用,临用前加入1 mL 1.6%乙醛溶液。
标准曲线:分别取DNA标准溶液0、0.4、0.8、1.2、1.6 mL和2.0 mL置于试管中(两个平行),加入去离子水补到2 mL,分别加入二苯胺试剂4 mL,混匀,60 ℃水浴 60 min,冷却,混匀,595 nm比色。以各管中的DNA量为横坐标,吸光度值为纵坐标,绘制标准曲线。
样品测定:样品2 mL,加二苯胺试剂4 mL,反应与检测同上。以样品的光密度值从标准曲线上查出相对应DNA含量。
1.8 数据统计分析 采用SPSS 15.0统计软件中的One-way-ANOVA进行方差分析和LSD多重比较。
2 结果与分析
2.1 对产气量、总脱氢酶的影响 由表2可见,培养液总脱氢酶、总产气量与对照组之间有显著差异,添加油脂的试验组间也有显著或极显著差异 (P<0.05或P<0.01)。总脱氢酶以豆油组最高,显著高于对照组(P<0.05),其次为玉米油组、花生油组、菜籽油组。表1所示培养液36 h总产气量在20.60~39.67 mL间变化,以对照组最高,显著高于玉米油、豆油、菜籽油组(P<0.05);花生油组与对照组间差异不显著(P>0.05),但数值上也低于对照组。由图1可知,随时间的延长各组产气量呈现波动变化,各组普遍自10~12 h后产气量急剧加大,但各组在32~36 h产气基本低于1 mL,进入发酵的平台状态。从图1中的变化幅度来看,以对照组与花生油组变化幅度较大、玉米油组次之,而豆油与菜籽油组变化幅度较小。

表2 油脂对培养液微生物DNA、产气量、总脱氢酶酶活的影响

图1 体外产气动态变化趋势图
2.2 对微生物区系及其动态变化的影响 由表2可见,36 h培养液原虫、细菌、微生物DNA以及原虫/细菌区系比例各组间差异不显著,添加油脂的试验组间也没有显著差异(P>0.05);但由表3可见,在不同的时间点上各组的上述各指标都有显著或极显著的变化(P<0.05或P<0.01)。
由表3可知,培养液原虫/细菌区系比例的动态变化趋势较为复杂。各组基本都在培养开始后下降,至8 h后呈现上升趋势,但在16 h后又出现下降的趋势,而且各组的变化幅度不尽一致。其中以对照组原虫/细菌区系比例最高、并持续在比油脂试验组高的水平上波动(P>0.05);其次以玉米油、花生油等组的原虫/细菌区系比例较高,而豆油与菜籽油组的该指标较低。
如表3所示,原虫、细菌或微生物DNA在培养开始后随时间延长呈上升趋势,至16 h后保持平稳或有所下降,原虫在16 h时最高,细菌则在8 h或16 h时最高,显著高于1 h或4 h(P<0.05或P<0.01)。总的微生物DNA为原虫和细菌之和,动态变化趋势与二者相似。另外,从表3可见,各时间点都以豆油与玉米油组的微生物DNA较高,而有利于微生物总量的提高。
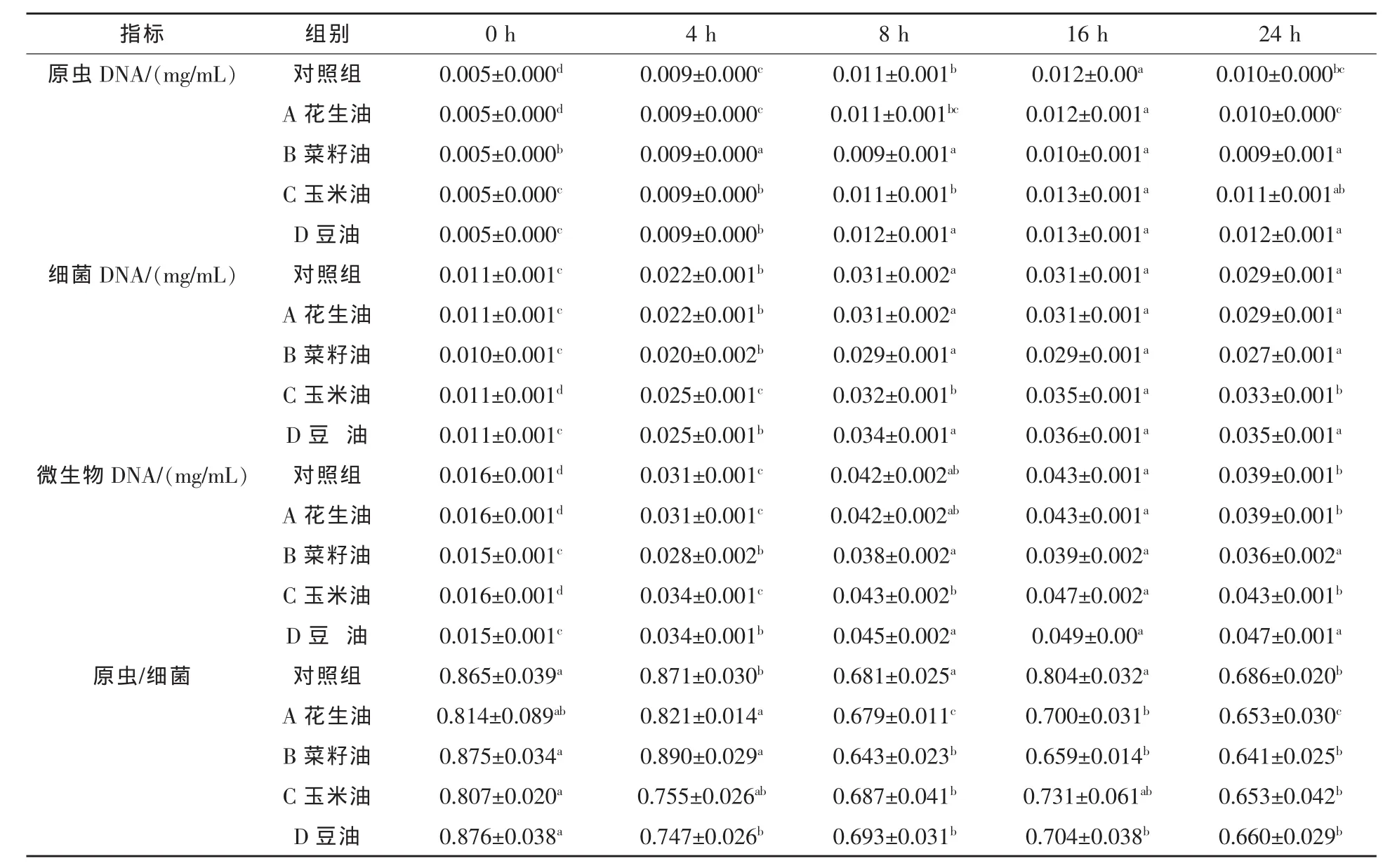
表3 培养液原虫、细菌、微生物DNA浓度以及原虫/细菌区系比
3 讨论
3.1 油脂对产气量、总脱氢酶的影响 由试验可知,对照组总产气量最高,试验组的产气量都低于对照组,这可能是因为油脂对原虫和甲烷菌有一定的毒害作用 (赵玉华等,2005),导致甲烷菌减少;并且油脂在体外发酵过程中还可能在不同程度上限制了瘤胃微生物的活性而影响产气,所以产气量也会相应的减少。试验组中以不饱和程度最高的D组(豆油组)的产气量较低(26.67 mL),极显著低于对照组;而不饱和程度最低的A组(花生油)最高,影响最小。本试验结果表明,油脂的不饱和程度越大,对瘤胃微生物的活性、产气的抑制程度越高。例外的是,B组(菜籽油组)的不饱和程度比D组豆油组低,但其产气量却显著低于豆油组,其原因是否与菜籽油含有的芥酸 (陈蛋等,2007)与培养液中的氨在培养过程中经微生物复杂的作用,形成有毒性的三聚氰酸、芥酸酰胺等物质有关,具体原因有待进一步的研究。另外,反应微生物活力的总脱氢酶活性也以豆油组最高,显著高于对照组,而玉米油组次之、花生油组再次之,菜籽油组最低,与总产气量的高低顺序相吻合,表明油脂对微生物的活力与其发酵产气活动的调控效应随着油脂不饱和程度的增加而增加。
3.2 油脂对微生物区系及其动态变化的影响微生物包括原虫、细菌、真菌和噬菌体等,其中以原虫和细菌为主,占瘤胃生物量的90%以上(冯仰廉,2004)。原虫与细菌区系量的高低水平和区系间的比例,直接关系到瘤胃代谢的类型和发酵的效果,从而影响到宿主的消化吸收和饲料的利用效率。报道认为,油脂尤其是不饱和脂肪酸可在瘤胃微生物脂酶的作用下发生水解,产生的游离脂肪酸的不饱和键会毒害瘤胃中的原虫 (Jalcˇ,2009;Jenkins,1993),使其群体生物量减少,进而减少其对细菌的吞噬,而增加细菌的数量,表现为区系生物量的交替消长,而最终可能改变微生物的生物总量及细菌与原虫区系的比例。
总体来看,本研究各组培养液原虫DNA、细菌DNA、微生物DNA以及原虫/细菌区系比例等指标的均值与对照组差异不显著,而且油脂试验组间也没有显著差异;但在培养的不同时间点上各组的上述各指标都有显著或极显著的变化。也表现了培养过程中微生物体系及其动态变化复杂性。如:原虫/细菌区系比例基本都在培养开始后下降,这可能是由于培养开始之初,油脂的酯解致使体壁较薄的原虫受到游离不饱和脂肪酸的影响大于细菌所致;培养至8 h后呈现上升趋势,可能是由于原虫的适应性增强或者是细菌(食物)的增加使得原虫繁殖相对迅速而导致群体的增加;但在16 h后由于原虫的自溶现象较细菌严重而又出现了区系比例下降的趋势。而且,不同处理比较可见各组的变化幅度不同,以对照组原虫/细菌区系比例最高并持续在比油脂试验组高的水平上波动;其次以玉米油、花生油等组的原虫/细菌区系比例较高,而豆油与菜籽油组的该指标较低。这表明油脂在一定程度上调节了微生物的区系,降低了原虫/细菌的比例,进而调节了微生物的发酵类型,以不饱和程度高的豆油效果较好。
从微生物各区系的量与微生物的总量来看,原虫、细菌或微生物DNA在培养开始后随时间延长呈上升趋势,至16 h后保持平稳或有所下降,不同处理比较,各时间点都以豆油与玉米油组的微生物DNA较高,其原因可能是原虫的减少与活性的降低,减少了对细菌的吞噬量,而有利于微生物总量的提高。结合上述豆油组微生物DNA和总脱氢酶都最高,而产气量、原虫/细菌区系比例显著低于对照组,表明油脂可能通过对原虫及其吞噬细菌活动的抑制而增加了微生物总的活力和群体量,但对原虫和产甲烷菌的负作用又可能使得其发酵转向产气量减少的代谢途径,而可能减少饲料以甲烷能形式的损失,并以不饱和程度高的豆油效果显著。
4 结论
在本试验所选油脂及其结果的基础上认为,植物油脂可在一定程度上影响微生物的活力及其发酵产气,其效应随着油脂不饱和程度的加大而加大,并以豆油的效果较为明显。
[1]陈蛋,陈斌,陆道礼,等.近红外光谱分析法测定菜籽油中芥酸的含量[J].农业工程学报,2007,23(1):234 ~ 237.
[2]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.2~102,131~143.
[3]欧宇.不同蛋白源对绵羊瘤胃肽释放的影响及抗瘤胃降解小肽的研究:[硕士学位论文][D].北京:中国农业大学,2003.
[4]赵玉华,杨瑞红,王加启.瘤胃微生物甲烷生成的机理与调控[J].微生物学杂志,2005,25(5):68 ~ 73.
[5]Czerkawshi J W.Chemical composition of microbial matter in rumen[J].J Sci Food Agric,1976,27:621.
[6]JalcˇD, Cˇertik M,Kundrikova K,et al.Effect of microbial oil and fish oil on rumen fermentation and metabolism of fatty acids in artificial rumen[J].Czech Journal of Animal Science,2009,5:229 ~ 237
[7]Jenkins T C.Lipid metabolism in the rumen[J].Journal of Dairy Science,1993,76:3851 ~ 3863.
[8]Martin-Orue S M,Balcells J,Zakraoui F,et al.Quantification and chemical composition of mixed bacteria harvested from solid fractions of rumen digesta:effect of detachment procedure[J].Animal Feed Science and Technology,1998,4:269 ~ 282.
[9]Menke K H,Steingass H.Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen flued[J].Animal Research and Development,1988,28:7 ~ 55.

