非肾脏沉积性高尿酸血症大鼠肾脏模型的建立及评价
史为伍,吴红赤,彭 艳,邱慧磊
(1.哈尔滨医科大学附属第一医院肾内科,黑龙江 哈尔滨 150001;2.佳木斯大学附属第一医院肾内科,黑龙江 佳木斯 154003)
随着饮食结构及生活行为的改变,高尿酸血症的发病率呈上升趋势。我国普通人群中高尿酸血症患病率约为10%,痛风患病率约为0.84%[1]。传统观念认为,高尿酸血症肾脏损伤是因为尿酸盐在肾脏的沉积,引发的局部刺激引起的。目前,临床上无症状高尿酸血症十分常见,潜在危险性也很大,近年来研究发现,高尿酸血症的大鼠肾脏内未出现沉积时,已经出现了明显的肾小球肥大、硬化和纤维化等[2]。因此,我们假设非沉积性高尿酸血症,即虽然出现高尿酸血症,但并未在肾脏出现沉积,也会对肾脏造成损伤。目前国内对此方面的研究未见报道。
为研究非沉积性高尿酸血症是否会对肾脏造成损伤,我们建立非沉积性高尿酸血症大鼠肾脏模型。本实验采用单独应用尿酸酶抑制剂(氧嗪酸),参考文献[2]选取不同剂量,观测血尿酸、肾功、尿蛋白变化,并采用 PAS及 De Galantha氏染色[3]肾脏形态学及尿酸盐沉积情况进行研究。其中 De Galantha氏染色为尿酸盐结晶的特异显色法,染色后肾组织呈黄色,而尿酸盐结晶呈黑色团块。探讨使用尿酸酶抑制剂制备非沉积性高尿酸血症大鼠肾脏模型的最佳剂量。
1 材料与方法
1.1 实验动物
健康雄性雄性 Wistar大鼠(由哈尔滨医科大学附属第一医院实验动物中心提供),体重:180~ 220g,动物自由摄取食物与水。
1.2 药品、试剂及仪器
氧嗪酸(齐河城汇精细化工有限公司);腺嘌呤 (上海蓝季科技发展有限公司);全自动生化分析仪。光学显微镜。
1.3 动物分组与处理
将大鼠随机分为7组(每组7只),即正常对照组、5个氧嗪酸组(见表1)及沉积组。其中模型组分别以氧嗪酸钾 550mg/kg、 650mg/kg、 750mg/kg、 850mg/kg及 950mg/kg,溶于 2mL生理盐水中,每日一次灌胃。对照组给予生理盐水2mL每日一次灌胃;沉积组[4]给予腺嘌呤100mg/kg+氧嗪酸 750mg/kg+生理盐水2mL,每日一次灌胃。各组分别于5周采血,离心,取血清,全自动生化分析仪测血尿酸、血肌酐及尿素氮;并于水合氯醛腹腔麻醉下取肾组织,分别固定于卡诺氏固定液及无水酒精中,观察组织学变化。
1.4 统计学处理
2 结果
2.1 一般状态
沉积组大鼠毛色暗,精神萎靡,食欲差,且实验过程中死亡一只,其他各组大鼠一般状态良好,被毛有光泽、整齐,摄食、饮水情况良好,实验过程中各组大鼠均无死亡。
2.2 实验前后尿酸的变化
各组大鼠实验前、后血尿酸浓度 (见表1),氧嗪酸<750mg/kg的两组造模后血尿酸水平与对照组及造模前比较,差异具有显著性 (P <0.05);氧嗪酸≥ 750mg/kg的三个组造模后血尿酸水平与造模前及对照组相比,差异具有显著性 (P<0.01);沉积组与对照组相比,差异具有显著性(P < 0.01)。
表1 实验前后血尿酸变化水平 ± s,μmol/L)
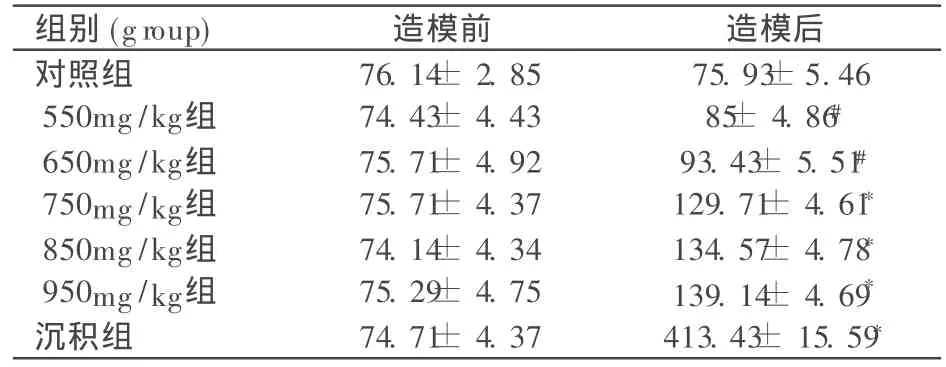
表1 实验前后血尿酸变化水平 ± s,μmol/L)
注:*与造模前及对照组相比 P<0.01,# 与造模前及对照组相比 P <0.05。
对照组 76.14± 2.8575.93± 5.46550mg/kg组 74.43± 4.4385± 4.86#650mg/kg组 75.71± 4.9293.43± 5.51#750mg/kg组 75.71± 4.37129.71± 4.61*850mg/kg组 74.14± 4.34134.57± 4.78*950mg/kg组 75.29± 4.75139.14± 4.69*沉积组 74.71± 4.37413.43± 15.59*
2.3 实验后各组尿蛋白、尿素氮及血肌酐测定
5周后 ,测得的尿蛋白定量、血肌酐及尿素氮水平(见表2)。氧嗪酸 <750mg/kg的两个组与对照组比较,差异无显著性 (P> 0.05);沉积组及氧嗪酸≥750mg/kg组与对照组比较,尿蛋白定量、SCr及 BUN差异具有显著性 (P<0.01)。
表2 实验后尿蛋白、血肌酐及尿素氮值 ±s)

表2 实验后尿蛋白、血肌酐及尿素氮值 ±s)
#与对照组相比 P> 0.05,★与对照组相比 P<0.01。
对照组 13.93± 1.6134.91± 5.146.73± 0.91550mg/kg组 16.04± 1.5337.03± 4.476.91± 0.64#650mg/kg组 17.53± 1.3739.46± 4.237.0± 0.51#750mg/kg组 32.84±4.83★ 77.99± 10.00★ 10.94± 0.86★850mg/kg组 37.8±2.77★ 81.49± 9.77★ 11.13± 1.02★950mg/kg组 41.29±3.30★ 84.31±10.05★ 11.37± 1.04★沉积组 76.6± 4.09★ 121.43± 13.01★ 13.25± 0.88★
2.4 病理学研究结果
正常对照组:肾小球结构正常,无系膜细胞增生,(见图1-A)。氧嗪酸 <750mg/kg的两个组:肾小球基本正常,无结构改变,无系膜细胞及基质的增生 (见图 1-B、C)。氧嗪酸≥750mg/kg组:肾小球体积增大,可见系膜细胞增生等改变,(见图1-D、E、F)。沉积组可见肾小管及间质内尿酸盐沉积,肾小管堵塞,发生纤维化,肾小球硬化等 (见图 1-G)。非沉积组与沉积组相比,肾脏内无黑色的团块样物质沉积(见图 2-A、 B)。


3 讨论
经典的高尿酸血症所致的肾损害认为是尿酸盐结晶沉积于肾脏 ,引起肾损伤。但近年来有文献报道[5],轻度的症状高尿酸血症可导致肾脏的损伤,但肾脏内并未发现尿酸盐的沉积。为了探讨非肾脏沉积性高尿酸血症致肾损伤的情况,我们进行了“非肾脏沉积性高尿酸血症大鼠肾脏模型”的制备,同时进行相应对照组“肾脏沉积性高尿酸血症大鼠肾脏模型”的制备工作[6]。因大多数哺乳动物,如啮齿类动物体内含有尿酸氧化酶,使尿酸分解生成尿囊素排出体外,难以形成高尿酸血症,自从1965年 ,Fridovich I[7]发现尿酸酶抑制剂可以有效地提高血清中尿酸的水平,此后尿酸酶抑制剂被应用于啮齿类高尿酸血症的动物模型中。目前应用尿酸酶抑制剂造模的方法主要有:①大鼠饲以2%的氧嗪酸,持续7周,可出现轻度高尿酸血症[5]。②大鼠饲喂氧嗪酸0.4g/d和尿酸0.6g/d,3~ 4周后,血尿酸持续性升高[8]。③次黄嘌呤与尿酸酶抑制剂氧嗪酸钾(OAPS)单独或配伍,一次性给药,建立急性高尿酸模型[9]。④腺嘌呤与氧嗪酸钾配伍制备尿酸盐沉积模型[10],等等。
基于本实验采用单独应用尿酸氧化酶抑制剂,因无尿酸盐前体及尿酸的补给,大鼠血清尿酸呈现轻度增高趋势。我们选用精确剂量进行灌饲,避免了混入食物中所导致的个体摄入差异。参照国外文献[11]并加以改进。我们选择氧嗪酸550 mg/kg、 650mg/kg、 750mg/kg、850mg/kg及 950mg/kg进行研究。实验结果显示:各实验组大鼠血尿酸水平均较对照组升高,且随着氧嗪酸剂量增加血尿酸水平有随之增加的趋势;尿酸盐沉积组血尿酸升高明显,肾组织内可见黑色尿酸盐结晶团块;氧嗪酸 <750mg/kg的两个组,未见明显肾脏损伤;氧嗪酸≥750mg/kg的三个组,肾脏病理显示肾小球轻度肥大,系膜细胞增殖,但损伤程度各组未见明显差异;单独应用氧嗪酸各组肾组织内均未见到尿酸盐结晶。
结果提示,单独应用氧嗪酸时,均能够导致大鼠血尿酸水平升高,同时未见尿酸盐在肾脏沉积,氧嗪酸750mg/kg,每日一次,连续五周灌饲,可以导致肾脏的损伤,肾脏出现肾小球轻度肥大、肾小动脉壁增厚、小动脉发生玻璃样变性及系膜细胞增生等形态学改变,且血生化及尿蛋白定量均证实了非沉积性高尿酸血症可导致肾脏的损伤,其机制未见明确报道。非沉积性高尿酸血症肾脏模型制备是成功的,为将来肾脏损伤机制的研究奠定了基础。
[1] 何清.高尿酸血症和痛风的病因与流行病学 [J].中国临床医生,2009,37(1),11-13
[2] Nakagawa T,Mazzali M,Kang DH,et al.Hyperuricemia causes glomerular hypertrophy in the rat[J].Am J Nephrol,2003,23(1):2-7
[3] Luna,L.G.Manual of H istologic Staining Methods of the AFIP[J].3rd ed.,New York:McGraw-H ill,1968,187
[4] 于雪峰,李登宇,孙贵才.复方豕希莶草胶囊降血尿酸及对肾损害的保护作用 [J].中医药学报,2007,35:18-20
[5] Mazzali M,Kanellis J,Han,et al.Hyperuricemia induces a primary renal arteriolopathy in rats by a blood pressure- independent mechanism[J].Am J Physiol Renal Physiol,2002,282(6):991-997
[6] 于雪峰,李登宇,孙贵才,等.复方莶草胶囊降血尿酸及对肾损害的保用 [J].ACM P,2007,135(2):18-20
[7] Fridovich I.The competitive inhibition of uricase by oxonate and by related derivatives of striazines[J].J Biol Chem,1965,240:2491-2494
[8] Bluestone R,Waisman J,Klinenberg JR.Chronic experimental hyperuricemic nephropathy[J].Lab Invest,1975,33(3):273-279
[9] 徐立时乐.大鼠急性高尿酸血症模型的复制方法初探[J].中国药理学通报,2007,,23(7):976-978
[10] H all IH,Scoville JP,Reynolds DJ.Substituted cyclicimides as potential anti-gout agents[J].Life Sci,1990,46(26):1923-1927
[11] Roncal CA,Mu W,Croker B,et al.Effect of elevated serum uric acid on cisplatin-induced acute renal failure[J].Am J Physiol Renal Physiol,2007,292(1):116-122

