利奈唑胺治疗重症肺炎的临床疗效及安全性研究
陈东红,张旭华,吴立华,王玲玲,刘 朔,王笑歌
重症肺炎是指除了肺炎常见的呼吸系统症状外,尚有呼吸衰竭和其他系统明显受累的表现。重症肺炎既可发生于社区获得性肺炎,亦可发生于医院获得性肺炎[1]。利奈唑胺(Linezolid)是应用于临床的新型恶烷酮类抗生素,由于该药的作用机制独特,与其他药物无交叉耐药性,在临床对G+球菌感染的治疗已显示出优势[2]。近年来,革兰阳性球菌成为社区、院内获得性感染的重要致病菌。本文旨在评价和观察利奈唑胺治疗重症肺炎的临床疗效及安全性。
1 资料与方法
1.1 临床资料 病例资料来源于我科2009年10月17日至2010年12月31日收治的重症肺炎患者68例,其中男37例,女31例,年龄28~76岁,平均(58.1±14.8)岁。院外获得性肺炎31例(45.6%,31/68),院内获得性肺炎37例(54.4%,37/68)。68例重症肺炎患者中,合并基础病患者30例(44.1%),分别为COPD 7例(10.3%),陈旧脑血管病 10例(14.7%),高血压病 9例(13.2%),冠心病、心衰7例(10.3%),糖尿病3例(4.4%),肾功能不全 3例(4.4%),1例(1.5%)合并肺癌。68例患者随机分为2组,利奈唑胺治疗组35例,万古霉素对照组33例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。患者一般资料见表1。

表1 68例重症肺炎病例一般资料
1.2 病例纳入标准 根据2001年美国胸科学会对重症肺炎修改后的定义,主要标准:(1)需要机械通气。(2)入院48 h内病变范围扩大50%。(3)少尿(每日<400mL)或非慢性肾衰患者血清肌酐>177μmol/L。次要标准:(1)呼吸频率>30次/min。(2)氧合指数(PaO2/FiO2)<250(PaO2单位为mmHg)。(3)病变累及双肺或多肺。(4)收缩压<90mmHg;(5)舒张压<60mmHg。符合1条主要标准或2条次要标准即可诊断为重症肺炎。
1.3 治疗方法 均给予吸氧、化痰、营养支持、补液等对症治疗,必要时予呼吸支持,治疗组机械通气3例(8.6%,3/35),对照组机械通气 2例(6.1%,2/33)。两组用药前均应用过其他抗生素,疗程3~7 d,感染症状、体征无改善。其中头孢哌酮舒巴坦及头孢吡肟37例,治疗组19例(54.3%,19/35),对照组 18例(54.5%,18/33);莫西沙星20例,治疗组10例(28.6%,10/35),对照组10例(30.3%,10/33);亚胺培南11例,治疗组6例(17.1%,6/35),对照组5例(15.2%,5/33)。治疗组予利奈唑胺(商品名:斯沃,美国辉瑞制药有限公司)600 mg静脉滴注,12 h/(次·d),疗程7~14 d。对照组予盐酸万古霉素(商品名:稳可信,美国礼来公司),如肾功无异常予500 mg静脉滴注,8 h/(次·d),肾功异常者则根据药物说明书及内生肌酐清除率(Creatinine clearance,CrCl)调整剂量。CrCl达10~50mL/min时,予以万古霉素500 mg静脉滴注,12 h/(次·d),疗程7~14 d。
1.4 观察项目 ①记录疗程中患者的症状、体征变化及出现的不良反应。每日复查实验室检查,包括血、尿常规、便球;肝功、肾功、痰培养、血气分析、血培养、胸片;分别于治疗前及治疗结束后24 h时内各检查1次肺CT。②细菌清除率。治疗前及疗程结束时,行痰液细菌学培养:采用自然咳痰法及吸痰器留取痰液标本,标本收集后在30min内送检,培养前在低倍镜下进行细胞学筛查,连续3 d每12 h复检一次痰标本,连续2次培养出同一细菌者为细菌培养阳性。采用全自动细菌鉴定仪行细菌鉴定;NCCLS标准(2002年)[3]判定结果,计算细菌清除率。③临床疗效。按卫生部《抗菌药物临床研究指导原则》[4]判定疗效。按痊愈+显效为有效。④不良反应。按与药物有关、可能有关、可能无关、无关和无法评价5级评定临床反应及化验异常与药物之间的关系,前两者划为不良反应,统计不良反应发率。
1.5 分析方法 计数资料应用χ2检验、t检验统计分析,用SPSS13.0统计软件进行处理,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效 两组有效率比较,差异无统计学意义(P >0.05),见表2。

表2 治疗组与对照组临床疗效(例,%)
2.2 显效时间 临床症状改善及理化检查好转时间见表3。治疗组与对照组显效时间比较,差异无统计学意义(P>0.05)。两组外周血白细胞总数、PaO2、PaO2/FiO2各指标治疗前、后的差异均有统计学意义(P<0.01),但组间比较差异无统计学意义(P >0.05);而两组内及组间 ALT、AST、BUN、Cr治疗前、后的比较,差异均无统计学意义(P>0.05)。见表4。

表3 治疗组与对照组症状及理化检验改善时间(d)
表4 两组白细胞、血气、肝功肾功指标比较()

表4 两组白细胞、血气、肝功肾功指标比较()
组别 WBC(×109/L)PaO2(mmHg)PaO2/FiO2(mmHg) ALT(U/L) AST(U/L) BUN(mmol/L)Cr(μmol/L)治疗组 治疗前 19.4±5.7 48.9±15.1 217.8±34.2 38.1±9.3 34.9±10.4 6.1±3.5 133.1±17.5治疗后 8.3±2.4 86.3±10.5 406.3±59.6 40.2±8.5 48.3±13.6 7.2±2.4 126.5±21.3对照组 治疗前 18.5±4.9 52.3±13.5 235.3±31.8 30.5±8.2 32.4±9.5 7.7±4.2 124.9±13.2治疗后 9.6±1.8 82.4±11.6 398.7±52.1 42.7±9.6 44.6±15.7 10.8±5.1 137.1±25.8 P <0.01 <0.01 <0.01 >0.05 >0.05 >0.05 >0.05
2.3 细菌清除率 从两组患者的痰标本中分离到58株致病菌,分别为溶血葡萄球菌24株,肺炎链球菌19株,金黄色葡萄球菌13株,屎肠球菌2株。治疗组为87.5%(28/32),对照组细菌清除率为84.6%(22/26),两组比较差异无统计学意义(P >0.05),见表5。
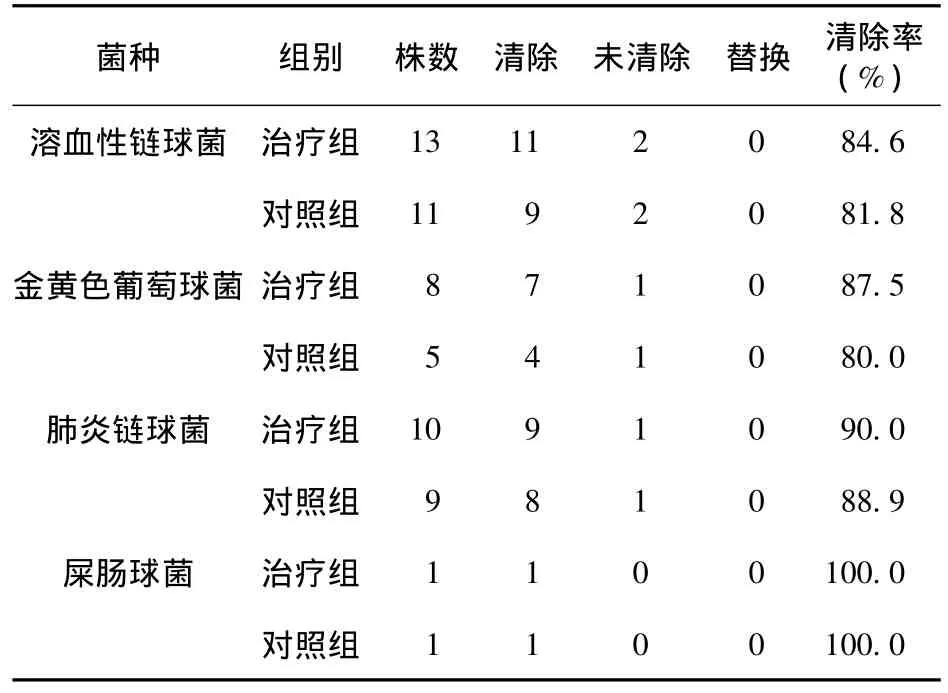
表5 两组对细菌的清除情况
2.4 不良反应 治疗组与对照组不良反应发生率分别为2.8%(1/35)和12.1%(4/33),两组比较,差异有统计学意义(P<0.05),见表6。利奈唑胺组1例用药后血小板下降,用药第9天血常规检查,血小板下降至59×109/L,停药3 d恢复至96×109/L,6 d后血小板恢复至正常,为141×109/L,无出血倾向,其余病例无变化。患者无恶心、呕吐、腹泻等胃肠道不良反应,无皮肤损害,无因最严重副反应而中途停药,未见全血象降低、贫血的患者。
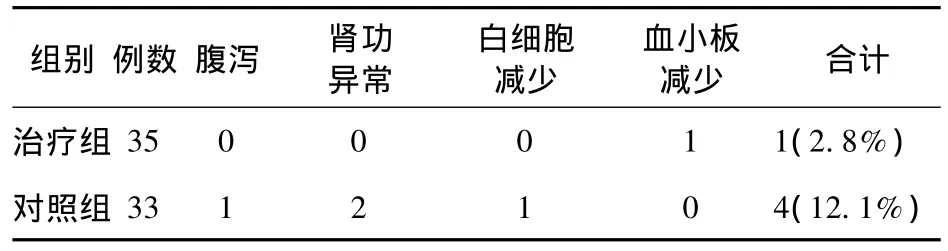
表6 两组不良反应发生情况(例)
3 讨论
重症肺炎是呼吸系统疾病中常见的危重症,患者多机体抵抗力差,伴有其他基础疾病,感染控制不佳,可引发SIRS及MODS,死亡率较高[5]。近年来,重症肺炎中需氧革兰阳性菌呈上升趋势,尤其是在医院血行感染中更为明显[6],重症肺炎中MRSA已占革兰阳性菌的首位,该菌在医院内可呈散发或暴发流行,治疗困难,病死率高。本研究中,25例为高龄患者,有严重的原发病如慢性阻塞性肺病、糖尿病、肾衰竭、心衰、恶性肿瘤等,应用其他常规抗菌药物无效,1例合并肺癌治疗无效。25例有基础病的患者,具有机械通气、留置导尿、免疫功能低下等多种危险因素,结合临床症状、肺部影像及痰涂片证实为G+菌肺炎。
利奈唑胺是人工合成的第一个新型恶唑烷酮类抗生素,能全面覆盖G+菌,阻止细菌70S起始复合物形成,作用于细菌蛋白合成的起始阶段,最终产生抑菌作用[7-10]。由于利奈唑胺结构和作用独特,尚未出现交叉耐药的现象[11]。万古霉素是三环糖肽类抗生素,其抗菌机制在于阻碍细菌细胞壁的合成,具有抗大多数革兰阳性菌的活性。
本组资料显示,重症肺炎中,利奈唑胺与万古霉素治疗的有效率、显效时间及细菌清除率差异无统计学意义。两组临床疗效确切,治疗前后比较,血常规、血气分析及肺部影像明显改善,显示良好的抗菌活性。治疗组与对照组比较,临床疗效及显效时间利奈唑胺优于万古霉素,差异无统计学意义(P>0.05),与文献报道[12-13]一致。但利奈唑胺具有强大的组织穿透性,能快速分布至不同的脏器组织,在肺上皮细胞液中的穿透性高达100%[14]。而万古霉素在肺组织中穿透性差。目前,已有充分的证据证明,万古霉素在肺组织中的浓度非常低。Cruciani报道[15],在30例患者中,万古霉素在肺组织中的浓度低于血清中的浓度,VAP患者肺上皮细胞液穿透率为18%。因此,利奈唑胺临床疗效及显效时间优于万古霉素。利奈唑胺的作用部位和方式独特,因此,不论是对其有天然或获得性耐药特征的阳性细菌,都不易与其他抑制蛋白质合成的抗菌药发生交叉耐药性,在体外也不易诱导产生耐药性[16]。利奈唑胺在体内外对引起社区和院内各种感染的阳性细菌具有广谱抗菌作用,特别对耐甲氧西林金黄色葡萄球菌[17]、耐万古霉素肠球菌等微生物有良好的抗菌作用,为治疗耐万古霉素肠球菌感染的惟一药物。
利奈唑胺注射液药物不良反应发生率较低,主要表现为腹泻、恶心、头痛、呕吐、味觉改变、口腔念珠菌病、轻度肝功能异常等。不良反应多为轻至中度,不影响用药。本研究两组间不良反应发生率差异有统计学意义。治疗组用药对肝功、肾功能无影响。利奈唑胺致1例患者血小板轻微下降,病情治愈停药后即恢复至正常;1例患者在肾功能不全(血肌酐186μmol/L)情况下接受利奈唑胺治疗,治疗结束后复查血肌酐无变化;1例患者血肌酐为147μmol/L,治疗后血肌酐恢复正常。而接受万古霉素治疗的1例患者,血肌酐由正常升至253μmol/L,提示万古霉素有一定的肾毒性。而利奈唑胺无肾毒性,其不经过P450代谢,且具有肝、肾双通道排泄的特点。对于肾功能不全患者,利奈唑胺60%可由肝脏代谢,30%由肾脏代谢,肾功能不全患者及轻中度肝功能损害的患者无需调整剂量。因此,利奈唑胺肾损害不良反应发生率明显低于万古霉素注射液。血小板减少为利奈唑胺最主要的不良反应,用药过程中应密切监测血小板动态变化趋势,必要时采取停药,加用升血小板药物等相应措施,防止发生出血。国内报道该药不良反应发生率为15.9%[18],其中以血小板减少最受关注。Grau等[19]进行了与利奈唑胺相关的血小板减少的危险因素研究。纳入49例入住ICU的严重感染患者,平均疗程为14.4 d,有12例患者出现血小板减少(24.5%),多变量分析提示,基础血小板水平是血小板减少的独立危险因素。利奈唑胺的骨髓抑制不良反应主要表现为血小板减少和贫血,骨髓抑制的发生率可能跟患者的血细胞基础水平、高龄(>58岁)、肾功能受损与之前使用过糖肽类药物有关,与利奈唑胺疗程的关系尚不清楚[20]。
综上所述,利奈唑胺与万古霉素在治疗重症肺炎方面的疗效相似,但利奈唑胺的使用相对方便,且耐受性好。在应用抗菌药物前,要了解患者的详细情况,包括与抗菌药物有关的危险因素,如年龄、肾脏疾病、糖尿病、脱水、酸中毒、合并用药等,合并肾功能不全时,应注意调整万古霉素剂量,监测血样浓度,以避免肾毒性。利奈唑胺具有抗菌活性强、临床疗效好、起效快及药物不良反应少等优点,该药对多重耐药革兰阳性细菌有良好的抗菌活性,且对肝肾功能影响小,是治疗重症肺炎患者的较好选择。
[1]朱伟东,吴英桂.重症肺炎患者的预后因素分析[J].中国医药,2010,5(6):578.
[2]南光日,李冬.利奈唑胺临床应用分析[J].实用药物与临床,2009,12(6):403-405.
[3]National committee for clinical laboratory standards.Performance standards for antimicrobial susceptibility testing,twelfth informational supplement.M100-S12[M].Pennsylvania:NCCLS,2002:1-133.
[4]抗菌药物临床应用指导原则.卫医发[2004]285号.
[5]贺鹤群,朱建华,叶继辉.重症肺炎的临床特征和死亡危险因素分析[J].实用医学杂志,2010,26(19):3532-3534.
[6]张业,刘政,孔磊.重症肺炎与病原菌耐药[J].中华医院感染学杂志,2008,18(11):1648-1650.
[7]Shinabarger DL,Marotti KR,Murry RW,et al.Mechanism of action of oxazolidinones:effects of linezolid and eperezolid on translation reaction[J].Antimicrob Agents Chemoter,1997,41:2132-2136.
[8]Swaney SM,Aoki H,Ganoza MD,et al.The oxazolidinone linezolid inhibits initiation of protein synthesis in bacteria[J].Antimicrob Agents Chemother,1998,42:3251-3255.
[9]张莉,刘晓艳.利奈唑胺治疗老年下呼吸道感染患者疗效分析[J].中国医药,2009,4(2):97-98.
[10]陈金龙,张民伟,陈福真.利奈唑胺治疗危重患者革兰阳性球菌的疗效和安全性[J].中国临床医学,2010,17(6):917-918.
[11]Zurenko GE,Yagi BH,Schaadt RD,et al.In vitro activities of U-100592 and U-100766,novel oxazolid in one antibacterial agents[J].Antimicrob Agents Chemother,1996,40:839-845.
[12]梁蓓蓓,王睿.利奈唑胺、去甲万古霉素等抗菌药物对耐甲氧西林金黄色葡萄球菌的抗菌活性[J].中国临床药理学与治疗学,2008,13(9):1044-1047.
[13]林东,吴菊芳,张婴元,等.利奈唑胺与万古霉素治疗革兰阳性菌感染的随机、双盲、对照、多中心临床试验[J].中国感染与化疗杂志,2009,9(1):10-17.
[14]Boselli EP.Pharmacokinetics and intrapulmonary concentrations of linezolid administered to critically ill patients with ventilator associated pneumonia[J].Crit Care Med,2005,33(7):1529-1534.
[15]Cruciani M,Gatti G,Lazzarini L,et al.Penetration of vancomycin into human lung tissue[J].J Antimicrob Chemother,1996,38(5):865.
[16]Diekmea DJ,Jones RN.Oxazolidinone antibiotics[J].Lancet,2001,358(9297):1975-1982.
[17]应满珍,卢阳珍,吴木莹.利奈唑胺治疗院内耐甲氧西林金黄色葡萄球菌肺炎的疗效[J].实用医学杂志,2009,25(20):3485-3486.
[18]周颖杰.利奈唑胺治疗严重感染建议在治疗复杂患者时监测不良反应[J].中国感染与化疗杂志,2006,6(5):345.
[19]Grau S,Morales-Molina JA,Mateu-de Antonio J.Linezolid:low pre-treatment platelet values could increase therisk of thrombocytopenia[J].J Antimicrob Chemother,2005,56(2):440.
[20]周明,杨明,赵曜,等.利奈唑胺不良反应研究进展[J].中国药房,2010,21(2):179-181.

