连翘三萜类化合物对前列腺癌PC-3细胞增殖抑制及放疗敏感性的实验研究
王彩莲,殷海涛,刘宝瑞
(1东南大学附属中大医院,南京210009;2南京大学医学院附属鼓楼医院)
前列腺癌(PC)多发生于老年,多数晚期患者对内分泌治疗及放化疗不敏感。三萜类化合物是近年从中药连翘中分离的单体化合物,具有抗肿瘤活性。为探讨连翘三萜类化合物达玛-24-烯-3β-乙酰氧基-20s-醇(DM)对人PC-3细胞的增殖抑制及放疗增敏作用,2009~2010年,我们进行了相关研究。现报告如下。
1 材料与方法
1.1 药物、试剂与仪器 人PC-3细胞购自上海细胞生物所,连翘购自南京市同仁药房。二甲基亚砜(DMSO,上海凌峰公司),Annexin V-FITC凋亡检测试剂盒(南京凯基生物公司),Roche端粒酶检测试剂盒(上海吉泰生物公司),流式细胞仪(美国),西门子直线加速器(德国)。
1.2 方法
1.2.1 DM分离 连翘粉碎呈粉末状,8倍量95%乙醇浸泡提取3次,乙醇提取物挥干得浸膏;用水、石油醚、乙酸乙酯分歩萃取法获得连翘乙酸乙酯提取物,干燥后上硅胶柱,经石油醚、乙酸乙酯混合液分次洗脱,收集洗脱液,用旋转蒸发仪旋干呈粉末状;置真空干燥箱40℃过夜、保存。以50 mmol/L的浓度溶于DMSO液中。
1.2.2 细胞培养 PC-3细胞传代、培养于含15%小牛血清的RPMI-1640培养液中,加入青霉素、链霉素各100 IU/ml,在37℃、5%CO2培养箱中培养,取对数生长期细胞进行实验。
1.2.3 细胞凋亡检测 取 PC-3传代细胞2 ml,以106个/ml密度接种于培养瓶中;细胞贴壁后,将DM液按终浓度 3.13、6.25、12.5、25.0、50.0 μg/ml分为5组,每组2 ml加入培养瓶中,每个浓度培养5瓶。24、48 h后,分别消化、收集经DM作用的细胞,离心、PBS洗涤各2次,4℃乙醇固定过夜。上机测定前离心去乙醇,用PBS洗涤1次;过滤后用PBS液悬浮细胞制成单细胞悬液,加人RNA酶、PI染色液;30 min后按Annexin V-FITC试剂盒说明书操作,用流式细胞仪检测细胞周期,观察细胞凋亡。
1.2.4 端粒酶活性检测 将对数生长期PC-3细胞接种于6孔板中,每组接种9个复孔,每孔接种细胞6×104个。次日分别用含25 μg/ml的DM培养基(DM组)、普通培养基(对照组)替换6孔板的培养液,6、18、48 h后用端粒重复序列扩增法检测PC-3细胞端粒酶活性。
1.2.5 细胞周期相关基因检测 将对数生长期PC-3细胞接种于6孔板中,每组接种3个复孔,每孔接种细胞6×104个。分别用含25 μg/ml的DM培养基(DM组)、普通培养基(对照组)替换6孔板的培养液,18 h后收集细胞,用 Trizol法提取总RNA;用反转录酶AMV反转录mRNA为cDNA,测定cDNA浓度,稀释为25 ng/μl。Real Time PCR循环参数为95℃预变性10 s,95℃变性5 s,60℃退火/延伸30 s,共45个循环。熔融曲线循环参数为95℃ 1 min,从55~95℃逐渐升温,并记录荧光信号。样品均设3个复孔,以提取的总RNA为阴性对照。引物均为跨内含子设计,以免荧光定量PCR过程中可能存在的DNA污染对结果的干扰。PCR序列略。以β-actin作内参,药物作用前细胞RNA作对照,参考文献[1]计算药物作用前后的肿瘤细胞周期相关基因 p21、Cyclin D1、CDC25A、TGF-β、Smad3 mRNA表达。
1.2.6 照射处理及集落形成实验 用6 mV X线对贴壁后的细胞进行照射,分 0、1、2、3、4、6 Gy 6 个剂量,分单纯和联合放疗。联合组在放疗同时按25 μg/ml终浓度加DM液2 ml,接种细胞数较单纯组多,且随照射剂量增加而增多。48 h后用PBS洗涤除去DM液,培养10~14 d后终止培养。弃去培养基,用PBS浸洗2次,纯甲醇固定15 min。弃去固定液,加适量Gimsa应用液染色20 min;然后流水缓慢洗去染色液,空气干燥后在显微镜下计数>50个细胞数的克隆数,以0 Gy集落形成率作为对照组,计算各剂量组的细胞存活分数;用Sigmaplot统计软件计算细胞存活曲线的D0、N、Dq值。
1.3 统计学方法 采用SPSS11.5统计软件,计量资料用±s表示,组间均数比较用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 不同时间、DM浓度诱导PC-3细胞凋亡率比较 见表1。
表1 不同时间、DM浓度诱导PC-3细胞凋亡率比较(%,±s)

表1 不同时间、DM浓度诱导PC-3细胞凋亡率比较(%,±s)
注:与 3.13 μg/ml比较,*P <0.05;与 6.25 μg/ml比较,△P <0.05
时间DM浓度(μg/ml)3.13 6.25 12.5 25.0 50.0 24 h 8.57 ±0.83 10.05 ±0.42 9.95 ±0.62 10.14 ±0.52 10.27 ±1.33 48 h 14.37 ±2.52 28.07 ±3.06* 45.88 ±4.93*△ 48.38 ±3.73*△ 52.34 ±5.50*△
2.2 DM对PC-3细胞周期的阻滞作用 DM可引起PC-3细胞周期重新分布,增加G1期细胞比例,减少S期细胞比例,且随着作用时间延长和浓度增加,这种趋势更加明显。
2.3 两组不同时间PC-3细胞端粒酶活性比较 见表2。
表2 两组不同时间PC-3细胞端粒酶活性比较(±s)
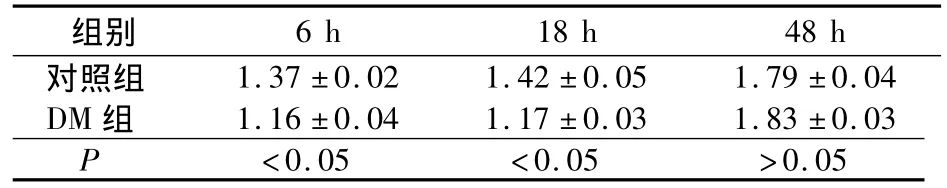
表2 两组不同时间PC-3细胞端粒酶活性比较(±s)
组别6 h 18 h 48 h对照组1.37 ±0.02 1.42 ±0.05 1.79 ±0.04 DM 组 1.16 ±0.04 1.17 ±0.03 1.83 ±0.03 P <0.05 <0.05 >0.05
2.4 两组细胞周期相关基因mRNA表达比较 见表3。
表3 两组细胞周期相关基因mRNA表达比较(CT,±s)

表3 两组细胞周期相关基因mRNA表达比较(CT,±s)
组别 p21 Cyclin D1 CDC25A TGF-βSmad3对照组 0.38 ±0.09 0.58 ±0.17 0.72 ±0.18 0.43 ±0.12 0.45 ±0.19 DM 组 0.65 ±0.13 0.36 ±0.11 0.47 ±0.22 0.61 ±0.14 0.62 ±0.25 P <0.05 <0.05 <0.05 <0.05 <0.05
2.5 两组不同放疗剂量的PC-3细胞存活率比较见表 4。单纯组 D0 值 3.486、N 值 1.523、Dq 值1.466,联合组分别为 2.946、1.318、0.813;两组放射增敏比(单纯组Dq与联合组Dq比)为1.80。
表4 两组不同放疗剂量的PC-3细胞存活率比较(%,±s)

表4 两组不同放疗剂量的PC-3细胞存活率比较(%,±s)
组别0 Gy 1 Gy 2 Gy 3 Gy 4 Gy 6 Gy单纯组 96.48 ±2.17 87.25 ±3.22 76.84 ±2.26 54.48 ±1.99 41.27 ±2.37 29.34 ±1.65联合组 94.36 ±3.21 79.59 ±2.34 64.65 ±3.07 43.47 ±4.15 31.39 ±2.63 18.87 ±1.70 P <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
3 讨论
目前,多数对连翘单体化合物功能的研究在其抗炎、抗病毒方面[2],部分研究发现,连翘提取物有较好的抗肿瘤活性[3]。2010年,我们首次从连翘中分离提取了DM,并发现其与紫杉醇、多西紫杉醇有明显协同效应[4]。三萜类化合物大部分由30个碳原子组成,可游离或以糖苷的形式存在,与糖结合的糖苷称为三萜皂苷。人参、甘草、三七、远志等中药中含有三萜类成分。三萜类化合物主要分为四环三萜、五环三萜,四环三萜的常见抗肿瘤机制为细胞毒作用、细胞周期阻滞、信号通路调控、逆转多药耐药、促进细胞分化和抑制肿瘤细胞转移等[5,6]。
本研究发现,DM 6.25 ~50.0 μg/ml能抑制PC-3细胞增殖,其随药物浓度增加和作用时间延长而增强,有明显的时效和量效关系。端粒酶是特殊的反转录酶,由RNA和蛋白质亚单位组成,能以自身RNA模板合成端粒DNA添加到染色体末端,避免染色体复制丢失端粒DNA使端粒延长,从而延长细胞寿命。我们发现DM作用PC-3细胞6 h后,肿瘤细胞端粒酶活性降低,48 h后其活性渐恢复至正常。提示DM有抑制肿瘤细胞增殖的作用。
细胞周期紊乱及细胞周期调控因子分泌失衡是肿瘤细胞的典型特征。Cyclin D1是周期相关蛋白基因,其编码蛋白质可促进细胞增殖。p21基因编码的p21蛋白可抑制细胞增殖。CDC25A是癌基因,其过度表达可致细胞生长失控后恶性转化[7]。TGF-β介导的信号转导可促进靶蛋白泛素化,Smad3是此过程的限速因子。本研究表明,DM可使细胞周期相关基因p21、TGF-β、Smad3表达增加,Cyclin D1、CDC25A表达降低;提示DM可上调凋亡基因,抑制抗凋亡基因表达,诱导肿瘤细胞凋亡,具有对肿瘤细胞多部位、多靶点调控的特点,可能成为新的抗肿瘤中药的理想候选药物之一。
本研究发现,DM液25 μg/ml有较高的细胞凋亡率,故用该浓度作为放疗增敏浓度;结果显示,联合组用25 μg/ml DM液后,其放疗增敏作用提高,细胞存活下降,提示DM液对PC-3细胞具有放疗增敏作用。
[1]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[2]Kang HS,Lee JY,Kim CJ.Anti-inflammatory activity of arctigenin from forsythiae fructus[J].J Ethnopharmacol,2008,116(2):305-312.
[3]Sun J,Liu BR,Hu WJ,et al.In vitro anticancer activity of aqueous extracts and ethanol extracts of fifteen traditional Chinese medicines on human digestive tumor cell lines[J].Phytother Res,2007,21(11):1102-1104.
[4]禹立霞,谢丽,魏嘉,等.6种中药提取物对胃癌细胞株细胞毒作用及多西紫杉醇增敏作用的研究[J].医学研究生学报,2010,23(9):962-966.
[5]Choi S,Kim TW,Singh SV.Ginsenoside Rh2-mediated G1phase cell cycle arrest in human breast cancer cells is caused by p15 Ink4B and p27 Kip1-dependent Inhibition of cyclin-dependent kinases[J].Pharm Res,2009,26(10):2280-2288.
[6]Kim SY,Kim DH,Han SJ,et al.Repression of matrix metalloproteinase gene expression by ginsenoside Rh2 in human astroglioma cells[J].Biochem Pharmacol,2007,74(11):1642-1651.
[7]Draetta G,Eckstein J.Cdc25 protein phosphatases in cell proliferation[J].Bioc Biop Acta,1997,1332(2):532-631.

