肝硬化期原发性胆汁性肝硬化患者的临床特点及预后分析
泽塔多吉,吕洪敏 ,向慧玲,李凤惠,德 吉,周佳美
(1天津医科大学三中心临床学院,天津300170;2天津市第三中心医院;3西藏昌都地区人民医院;4西藏堆龙县人民医院)
原发性胆汁性肝硬化(PBC)是慢性肝内胆汁淤积性疾病,其病因未明,免疫异常、遗传因素与其发病密切相关。PBC好发于中年妇女,血清抗线粒体抗体(AMA)阳性对其诊断具有特异性。为探讨PBC患者的临床特点及预后,我们对2004年5月~2011年2月天津市第三中心医院收治的192例患者的临床资料分析如下。
1 资料与方法
1.1 临床资料 本组因各种并发症住院的PBC患者192例,男45例、女147例(男女之比为1∶3.3),年龄32~81岁,病程1~194(29±18)个月,均符合2000年美国肝病协会制定的PBC诊断标准,并根据临床表现、实验室检查、超声、CT或病理检查证实为肝硬化期。患者入院时并发腹水88例,感染46例,出血41例,肝性脑病21例,肝癌15例,肝肾综合征9例,肝掌99例,脾肿大60例,肝肿大56例,关节畸形3例;合并干燥综合征9例,类风湿性关节炎7例,甲状腺疾病10例,黄色瘤6例。
1.2 方法
1.2.1 治疗方法 患者均采用熊去氧胆酸(UDCA)加护肝药等综合治疗,治疗6个月观察其主要临床症状(黄疸、腹胀、乏力、皮肤瘙痒、消化道出血)变化。
1.2.2 检测方法 抽取患者肘静脉血,采用全自动生化分析仪、全自动血凝分析仪分别检测其血清碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆汁酸(TBA)、总胆红素(TBIL)、白蛋白(ALB)、球蛋白(GLB)、凝血酶原活动度(PTA)、血脂;采用Olympus荧光显微镜、间接免疫荧光法检测AMA、AMAM2亚型(AMA-M2),免疫印迹法检测抗GP210抗体、抗SP100抗体、抗核抗体(ANA)及免疫球蛋白,试剂盒购自德国欧蒙医学实验诊断公司。
1.2.3 统计学方法 采用SPSS17.0统计软件,计量资料用±s表示,计数资料用百分率表示,治疗前后比较用t、χ2检验,单因素、多因素分析用Logistic回归分析。P≤0.05为差异有统计学意义。
2 结果
2.1 本组治疗前后生化指标变化 见表1。
2.2 本组治疗前后免疫学指标变化 见表2。
2.3 本组治疗前后主要临床症状变化 治疗前黄疸99 例(51.6%),腹胀 95 例(49.5%),乏力 82 例(42.7%),皮肤瘙痒 61 例(31.8%),消化道出血 45例(23.4%);治 疗 后 分 别 为 62(37.3%)、54(32.5%)、47(28.3%)、32(19.3%)、24 例(14.5%)。治疗后黄疸、腹胀、乏力、皮肤瘙痒明显改善(P<0.05),总有效率为 64.6%(124/192)。
2.4 随访 192例患者中,死亡26例(13.5%),其TBIL均>100 μmol/L;其中死于肝肾衰竭9例,肝癌及感染11例,肝性脑病6例。对67例TBIL>100 μmol/L的患者随访2 a,其中服用UDCA>2 a者生存41 例(61.2%),< 2 a者生存26 例(38.8%),两者并发症比较见表3。
表1 本组治疗前后生化指标比较(±s)

表1 本组治疗前后生化指标比较(±s)
生化指标 治疗前 治疗后P ALT(U/L)86± 27 65±15 <0.01 AST(U/L) 63± 24 48±22 <0.05 ALP(U/L) 337±147 135±30 <0.01 GGT(U/L) 157± 97 87±34 <0.01 TBA(μmol/L) 69± 52 32±30 <0.01 TBIL(μmol/L) 66± 43 40±18 <0.01 ALB(g/L) 31± 6 32± 3 <0.01 GLO(g/L) 34± 8 29± 4 <0.01 PTA(%) 80± 19 83±13 >0.05 TC(mmol/L) 4.80 ±1.40 3.30 ±1.10 <0.01 TG(mmol/L)2.29 ±2.58 1.69 ±0.96 >0.05

表2 本组治疗前后免疫学指标变化[例(%)]
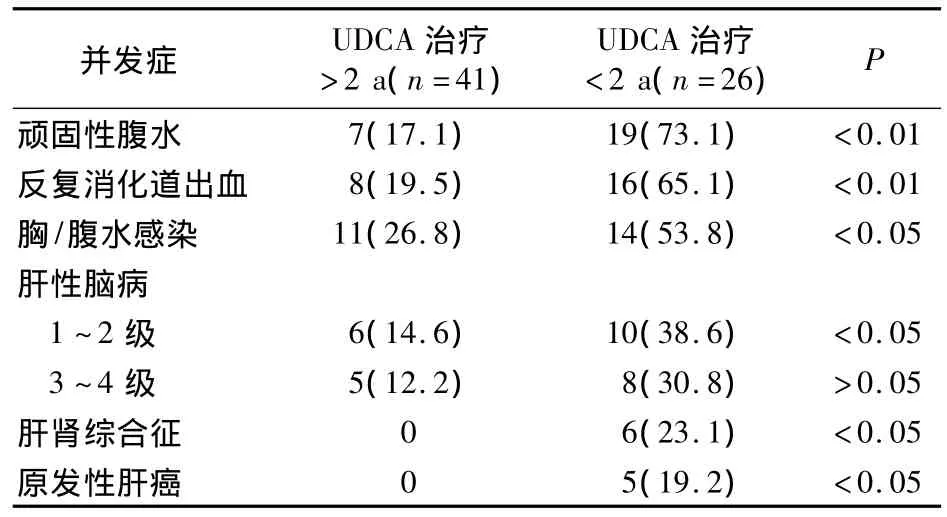
表3 67例TBIL>100 μmol/L患者的并发症发生率比较[例(%)]
2.5 并发症预后分析 以患者是否死亡为因变量,年龄、性别、胸腹水、出血、脾亢、黄疸、肝性脑病、感染、肝肾综合征、肝癌为自变量,进行单因素非条件Logistic回归分析。结果显示,肝性脑病、肝癌、肝肾综合征是PBC的危险因素,其95%CI分别为3.453~ 86.230、0.988 ~8.859、1.099 ~164.487,P 均 <0.05。
3 讨论
随着诊断技术不断提高,尤其是AMA检测技术的推广,PBC诊断率呈上升趋势,但仍有部分患者因早期诊治不及时而延误病情。国内PBC确诊患者主要在症状期,而国外无症状期确诊率达60%。本文PBC以中年女性多见,男女之比为1∶3.3,与国内文献[1]报道一致,与国外报道[2]的 1∶9 有统计学差异。本组多为失代偿肝硬化期,从发病到确诊时间1~194个月、平均27个月。PBC患者早期一般无黄疸,症状亦不明显,所以早发现、早治疗对控制病情进展尤为重要。研究显示,TBIL与PBC患者的生存率显著相关,是重要的判断PBC患者生存期的指标之一;如血清TBIL持续高于100 μmol/L,患者生存期一般 <2 a[3]。本研究发现,PBC患者 TBIL明显升高,其中>100 μmol/L者67例;对此患者随访2 a,其中死亡26例(13.5%),生存期>2 a者占61.2%,高于文献报道[3]。本组患者均以各种并发症就诊,结果显示长期存活者的并发症单一且轻,药物易控制是其重要原因;生存期>2 a且合并2种以上并发症者占14.9%(6/41),生存期<2 a且合并2种以上并发症者占80.8%(21/26),说明生存期<2 a者的并发症严重或合并多种并发症。进行Logistic回归分析显示,肝性脑病、肝肾综合征、肝癌是PBC的独立危险因素。提示判断PBC患者预后应综合分析其临床症状、生化指标,以及有无腹水、感染、肝性脑病、出血、肝肾综合征、肝癌等并发症。本组治疗前TBA明显升高,提示其可能为PBC的辅助诊断指标之一。
AMA是诊断PBC的特异性指标之一,尤其是AMA-M2阳性更具诊断价值。本组AMA或AMAM2阳性率为95.8%,与文献[4]报道一致。Worman等[5]报道,约50%的 PBC患者 ANA阳性,且其抗GP210、抗SP100抗体阳性率较高。本组抗GP210抗体阳性率为22.4%,抗SP100阳性率为8.9%。提示诊断PBC时除检测AMA-M2外,还可结合抗GP210、抗SP100抗体辅助诊断,尤其是在AMA阴性时,抗GP210、抗SP100抗体阳性可作为PBC诊断的另一重要指标[6]。本组治疗前IgM、IgA、IgG均升高,以IgM升高明显;提示PBC患者免疫球蛋白升高,符合文献[1]报道。另外,本组免疫指标治疗前后对比显示IgM改善明显(P<0.05),而AMA、ANA、抗 SP100、抗 GP210、IgA、IgG 水平治疗前后无统计学差异。目前认为PBC是自身免疫性疾病,患者常有体液免疫和细胞免疫异常,合并其他自身免疫性疾病。本组合并干燥综合征9例,类风湿性关节炎7例,甲状腺疾病10例,黄色瘤6例;提示诊断PBC时要注意其他并存的自身免疫性疾病。
目前,PBC无特效疗法,UDCA是唯一被美国FDA批准用于治疗PBC的药物,推荐剂量为13~15 mg/(kg·d)[7]。UDCA 治疗 PBC 的主要机制可能为修复损伤肝细胞,改善胆管细胞的分泌功能,以及胆汁解毒、抗凋亡作用等;治疗PBC的关键是抑制异常的免疫反应,减轻淤积胆汁的毒性作用。Pares等[8]报道,长期服用UDCA可明显改善PBC的临床症状、生化指标,延缓组织学进展、延长生存期或移植前期。研究表明,PBC患者行UDCA治疗后4~6周出现生化指标应答,3个月内80% ~90%患者的生化指标明显改善,临床表现和生化指标应答情况可用于预测患者的长期疗效[9]。本研究显示,经UDCA为主综合治疗6个月后,患者的临床症状及生化指标明显改善,总有效率为64.9%,与文献报道[10]一致。另外,本研究对 TBIL >100 μmol/L 且行UDCA治疗>2 a的67例患者追踪随访,发现生存期 >2 a者占 61.2%,高于文献报道[5],推测可能与其坚持UDCA为主的综合治疗有关。表明PBC肝硬化期坚持UDCA治疗,可明显改善患者的生化指标,提高其生活质量,延长生存期。
[1]Rinella ME.Primary biliary cirrhosis[J].Ann Hepatol,2006,5(3):198.
[2]尧颖,杨晋辉,尤丽英,等.原发性胆汁性肝硬化68例临床分析[J].肝脏,2008,13(1):35-36.
[3]Mayo MJ.Natural history of primary biliary cirrhosis[J].Clin Liver Dis,2008,12(2):277-288.
[4]周永兴.现代肝硬化诊断治疗学[M].北京:人民军医出版社,2000:183-185.
[5]Worman HJ.Nuclear envelope protein autoantigens in primary biliary cirrhosis[J].Hepatol Res,2007,37(3):406-411.
[6]Muratori P,Muratori L,Ferrari R,et al.Characterization and clinical impact of antinuclear antibodies in primary biliary cirrhosis[J].Am J Gastroenterol,2003,98(2):431-437.
[7]Sorda J,Findor J.Methotrexate therapy in primary biliary cirrhosis[J].Acta Gast roenterol Latinoam,2000,30(4):221-225.
[8]Pares A,Caballeria L,Rodes J.Excellent long-term survival in patients with primary biliary cirrhosis and biochemical response to ursodeoxycholic acid[J].Gastro-enterology,2006,130(3):715-720.
[9]Lindor K.Ursodeoxycholic acid for the treatment of primary biliary cirrhosis[J].N Engl J Med,2007,357(15):1524-1529.
[10]Leuschner M,Maier KP,Schlichting J,et al.Oral budesonide and ursodeoxycholic acid for treatment of primary biliary cirrhosis:results of a prospective doubleblind trial[J].Gastroenterology,1999,117(4):918-925.

