血管紧张素Ⅱ对肾小球系膜细胞MCP-1表达的影响
邢 燕,孙致连,董崇周,叶山东
(安徽医科大学附属省立医院·安徽省立医院内分泌科,安徽合肥230001)
肾素-血管紧张素-醛固酮系统(RAS)活化参与了多器官损伤(包括糖尿病肾小球硬化),其对肾脏的损害可通过肾小球血流动力学和非血流动力学两方面发挥作用,其中血管紧张素Ⅱ(AngⅡ)起了重要介导作用[1]。近来研究证实慢性低度炎症反应参与肾小球硬化,尤其是糖尿病肾小球硬化的发生和发展[2]。单核巨噬细胞趋化蛋白-1(MCP-1)作为一种重要的炎症趋化刺激因子,主要趋化单核细胞和T淋巴细胞,诱导单核细胞、内皮细胞表达黏附分子,使各种炎性细胞尤其是单核细胞向病变部位聚集,参与肾小球硬化的发生。
本试验应用SD大鼠肾小球系膜细胞的细胞株,观察AngⅡ对肾小球系膜细胞MCP-1 mRNA表达和蛋白合成的影响,探讨AngⅡ参与肾小球硬化的炎性机制,为临床应用血管紧张素转化酶抑制剂或AngⅡ受体阻滞剂防治肾小球硬化提供实验依据。
1 材料和方法
1.1 主要实验试剂
小牛血清(杭州四季青公司);Trizol(美国Invitrogen公司);逆转录试剂盒(美国Promega公司);PCR试剂(大连宝生物公司);DEPC(美国Sigma公司);胰蛋白酶(美国Sigma公司);L-谷氨酰胺(美国Life Technologies公司);HEPES(华美生物工程公司);MCP-1 ELISA试剂盒(美国R&D公司);PCR所用引物(上海生工生物技术有限公司);血管紧张素Ⅱ(美国Sigma公司)。
1.2 实验方法
1.2.1实验细胞 SD大鼠肾小球系膜细胞株(HBZY-1)购自中国典型培养物保藏中心。
1.2.2肾小球系膜细胞培养和标本收集 液氮罐取出冻存的细胞株快融复苏后离心弃上清后接种于培养瓶中。培养液为含10%小牛血清、0.3 g/L L-谷氨酰胺、2.38 g/L HEPES的MEM培养基。培养瓶置于5%的CO2、37℃培养箱内培养,实验用第5-7代。将系膜细胞以1.5×105接种到培养瓶中,当系膜细胞生长至80%融合,改含1%血清的培养基同步18 h后,记为0 h,按实验分组,不同浓度AngⅡ(A1组:10-9mol/L;A2组:10-7mol/L;A3组:10-5mol/L)作用后48 h收集细胞上清液和系膜细胞,于-80℃冰箱冻存,以备统一检测。10%小牛血清MEM(含糖5.6 mmol/L)为对照(C)组。每组均设6个样本。
1.2.3系膜细胞MCP-1mRNA和上清液MCP-1蛋白测定 系膜细胞MCP-1mRNA测定:各组系膜细胞的总 RNA提取按Trizol说明书进行,取1 μ g总RNA配制逆转录反应体系,70℃5 min,37℃5 min,42℃60 min孵育经AMV逆转录酶及OlidT引物等条件下,逆转录合成cDNA,用特异性引物对逆转录产物进行半定量PCR。MCP-1引物序列为:上游引物为 5′-CAC CTG CTG CTA CTC ATT CAC T-3′,下游为 5′-GTT CTC TGT CAT ACT GGT CAC TTC-3′,目的片段长度为349 bp;反应条件:94℃变性60 s后,56℃退火60 s,72℃延伸60 s的热循环,循环35次后,终末72℃延伸10 min,以GAPDH为内参照。取2.5 μ l PCR产物经2%琼脂糖凝胶电泳,EB染色,紫外灯下照相,用UVI图象分析处理系统进行灰度扫描。并以GAPDH校正作相对量分析,数值以MCP-1/GAPDH条带光密度比值表示MCP-l mRNA产物的相对半定量值。
系膜细胞上清液中MCP-1测定采用ELISA法,按照MCP-1试剂盒说明书操作。根据不同浓度标准品测定的OD值绘制标准曲线,计算各样品的浓度。
1.3 统计学处理
2 结果
2.1 不同浓度AngⅡ对系膜细胞MCP-1蛋白合成影响
与C 组比较,10-9、10-7、10-5mol/L AngⅡ作用于系膜细胞48 h后,各组上清液MCP-1浓度显著增加(均 P<0.01),A2、A3组与A1组比较,差异显著(均P<0.01),A2组上清液MCP-1浓度最高,A3组MCP-1浓度稍下降,但与A2组比较差异无显著性。见表1。
2.2 不同浓度AngⅡ对系膜细胞MCP-1mRNA表达影响
与C 组比较,10-9、10-7、10-5mol/L AngⅡ作用于系膜细胞48h后,各组MCP-1mRNA表达均显著增强(均 P<0.01),A2、A3组与A1组比较,差异显著(均P<0.01),A2组MCP-1mRNA表达最高,A3组MCP-1RNA表达有所下降,但与A2组比较差异无显著性。见表1和图1。
表1 不同浓度 AngⅡ对系膜细胞MCP-1蛋白和 MCP-1mRNA表达的影响(s,n=6)
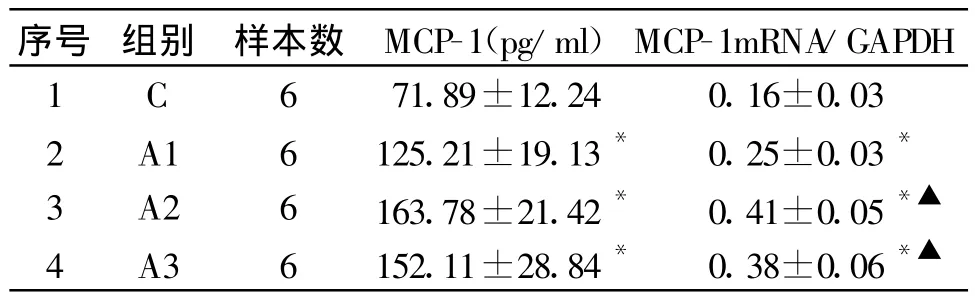
表1 不同浓度 AngⅡ对系膜细胞MCP-1蛋白和 MCP-1mRNA表达的影响(s,n=6)
注:与C组相比,*P<0.01;与A1组相比,▲P<0.01
序号 组别 样本数 MCP-1(pg/ml)MCP-1mRNA/GAPDH

图1 不同浓度AngⅡ对系膜细胞MCP-1mRNA的表达影响,H2O为只加水,C为对照组,A1为10-9 mol/L AngⅡ、A2为10-7mol/L AngⅡ、A3为10-5mol/L AngⅡ
3 讨论
MCP-1属于趋化因子CC家族中一种特异的单核/巨噬细胞趋化因子,其受体为趋化因子受体-2(CCR2)。正常肾组织中多种细胞如肾系膜细胞、小管上皮细胞、肾小球内皮细胞,成纤维细胞及浸润的免疫细胞受刺激后均可合成和分泌MCP-1。MCP-1微量表达是正常肾脏生理功能所必须的,它可以趋化单核巨噬细胞在肾组织浸润,清除Gly-Alb和氧化LDL(Ox-LDL),减轻组织损伤。本实验结果显示,肾小球系膜细胞可低度表达MCP-1,与文献报道一致[3]。糖尿病情况下,肾组织过度表达的MCP-1,介导的单核/巨噬细胞在肾脏的聚集和活化,参与肾小球硬化(包括DN)的发生和发展。
研究[4]证实,糖尿病患者肾脏局部AngⅡ活性增高,肾小管周围、肾脏间质中、髓质中AngⅡ水平高于循环中的水平,支持AngⅡ在肾脏局部合成。糖尿病肾脏局部AngⅡ活性增加促进肾小球硬化的发展,它包括改变肾小球血流动力学变化和非血流动力学两方面的作用,其确切的机制尚不十分明确。AngⅡ所引发的非血流动力学效应及其与炎症因子之间的关系正在阐明[5]。研究证实AngⅡ能维持并增强肾脏的微炎症反应,发挥促炎症作用,参与肾小球损伤的发生和发展。Lin L等报道血管紧张素受体拮抗剂坎地沙坦减少肾脏组织的AngⅡ的产生,减轻肾脏损伤和趋化因子MCP-1的增加[6]。本研究结果显示AngⅡ能明显增强体外培养的肾小球系膜细胞MCP-1 mRNA表达和蛋白合成,并且在一定范围内随AngⅡ浓度增加而表达增强,存在一定的浓度依赖性,10-7mol/L AngⅡ刺激系膜细胞MCP-1 mRNA表达和蛋白合成作用最强。而Pan Q等[7]报道Ang可诱导肾小球内皮细胞MCP-1的表达,可能是通过NADPH氧化酶依赖的NF-kappa信号通路介导。Gill PS报道AngⅡ主要通过激活NADPH氧化酶和增加线粒体内活性氧(ROS)来刺激细胞内ROS的生成,进而促进炎症因子表达[8]。替米沙坦作为AT1受体阻断剂,在系膜细胞可抑制终末糖基化产物诱导的MCP-1的表达,而这一作用可能是通过过氧化物增殖活化受体γ活化介导的终末糖基化产物受体的下调而完成的。提示终末糖基化产物系统与AngⅡ的病理生理联系可能与糖尿病肾病的发病机制有关[9]。本研究未发现10-5mol/L的AngⅡ进一步促进系膜细胞MCP-1的表达和合成,可能因为AngⅡ与受体的结合具有特异性、饱和性、可逆性、竞争性以及与其受体数量下降和受体饱和度有关。
总之,本研究初步结果显示AngⅡ可刺激大鼠肾小球系膜细胞表达和合成MCP-1,并具有一定的剂量依赖性,该结果为阻断或抑制AngⅡ为靶点来防治肾小球硬化(包括糖尿病肾病)提供了一定的实验依据,确切机制值得进一步探讨。
[1]Barlovic DP,Cooper ME.Diabetes:RAS inhibition:probably not a onesize-fits-all approach[J].Nat Rev Nephrol,2009,5(12):669.
[2]Rivero A,Mora C,Muros M,et al.Pathogenic perspectives for the role of inflammation in diabetic nephropathy[J].Clin Sci(Lond),2009,116(6):479.
[3]Giunti S,Pinach S,Arnaldi L et al.The MCP-1/CCR2 system has direct proinflammatory effects in humanmesangial cells[J].Kidney Int,2006,69(5):856.
[4]Brown NJ.Aldosterone and vascular inflammation[J].Hypertension,2008,51(2):161.
[5]Wolf G.Novel aspects of the renin-angiotensin-aldosterone-system[J].Front Biosci,2008,1(13):4993.
[6]Lin L,Phillips WE,Manning RD.Intrarenal angiotensinⅡis associated with inflammation,renal damage and dysfunction in dahl salt-sensitive hypertension[J].J Am Soc Hypertens,2009,3(5):306.
[7]Pan Q,Yang XH,Cheng YX.Angiotensin II stimulates MCP-1 production in rat glomerular endothelial cells via NAD(P)H oxidase-dependent nuclear factor-kappa B signaling[J].Braz J Med Biol Res,2009,42(6):531.
[8]Gill PS,Wilcox CS.NADPH oxidases in the kidney[J].Antioxid Redox Signal,2006,8(9-10):1597.
[9]Matsui T,Yamagishi S,Ueda S,et al.Telmisartan,an angiotensin II type 1 receptorblocker,inhibits advanced glycationend-product(AGE)-induced monocyte chemoattractant protein-1 expression in mesangial cells through downregulation of receptor for AGEs via peroxisome proliferator-activated receptor-gamma activation[J].J Int Med Res,2007,35(4):482.

