全植物蛋白饲料中添加植酸酶对草鱼生长、非特异性免疫及消化酶活力的影响
马恒甲,叶金云,郭建林,王友慧,沈斌乾,陈建明,潘 茜
(1.大连海洋大学生命科学院,辽宁大连 116023;2.浙江省淡水水产研究所,浙江湖州 313001;3.湖州师范学院,浙江湖州 3130001)
草鱼Ctenopharyngodon idellus属鲤形目Cypriniformes、鲤科Cyprinidae、雅罗鱼亚科Leuciscinae、草鱼属Ctenopharyngodon,是我国最重要的淡水养殖鱼类之一,其饲料蛋白源主要为植物性蛋白源[1]。近几年,由于鱼粉供应不足,价格不断上涨,人们广泛研究用廉价的植物蛋白来替代鱼粉作为蛋白源,但植物中含有大量的植酸(phytic acid)及其植酸盐[2],植酸的化学名称是环已六醇六磷酸酯,分子式为 C6H18O24P6,分子量为660.08,是一种黄色液体,呈强酸性,易溶于水,其化学结构决定了它对其它离子有很强的络合性,能够与营养物质、无机盐等形成络合物从而阻碍鱼类对营养物质的吸收和利用[3],植酸还可以与蛋白质和氨基酸形成络合物,从而抑制消化酶的活性[4],是饲料中重要的抗营养因子。
植酸酶(phytase)属磷酸单酯水解酶,可将植酸分解为可利用的无机磷酸盐和肌醇[5],已有研究表明,植酸酶能够使与植酸结合的内原性蛋白酶、淀粉酶、脂肪酶等游离出来,提高消化率[6]。但鱼类消化系统内缺乏内源性植酸酶[7],使其对植物饲料源中的营养物质利用率降低,从而抑制体内消化酶的活性,影响鱼体的生长和健康,所以人们一直对植酸酶在饲料中的应用研究十分关注。
关于草鱼全植物蛋白饲料中添加植酸酶对其生长等影响的研究至今未见报道,本试验通过在全植物蛋白饲料中添加植酸酶,研究和探讨植酸酶对草鱼生长、非特异性免疫及消化酶活力的影响,旨在为草鱼高效环保型饲料配方的研制和草鱼环境友好型养殖技术的开发提供依据。
1 材料与方法
1.1 试验饲料
试验共设 5 个试验组:分别添加 500(S1)、750(S2)、1 000(S3)、1 250(S4)、2 500 U/kg(S5)的植酸酶,设置2个对照组,对照组1(D1):全植物蛋白基础饲料中添加无机磷(Ca(H2PO4)2),对照组2(D2):全植物蛋白基础饲料中不添加植酸酶和无机磷,饲料配方见表1。
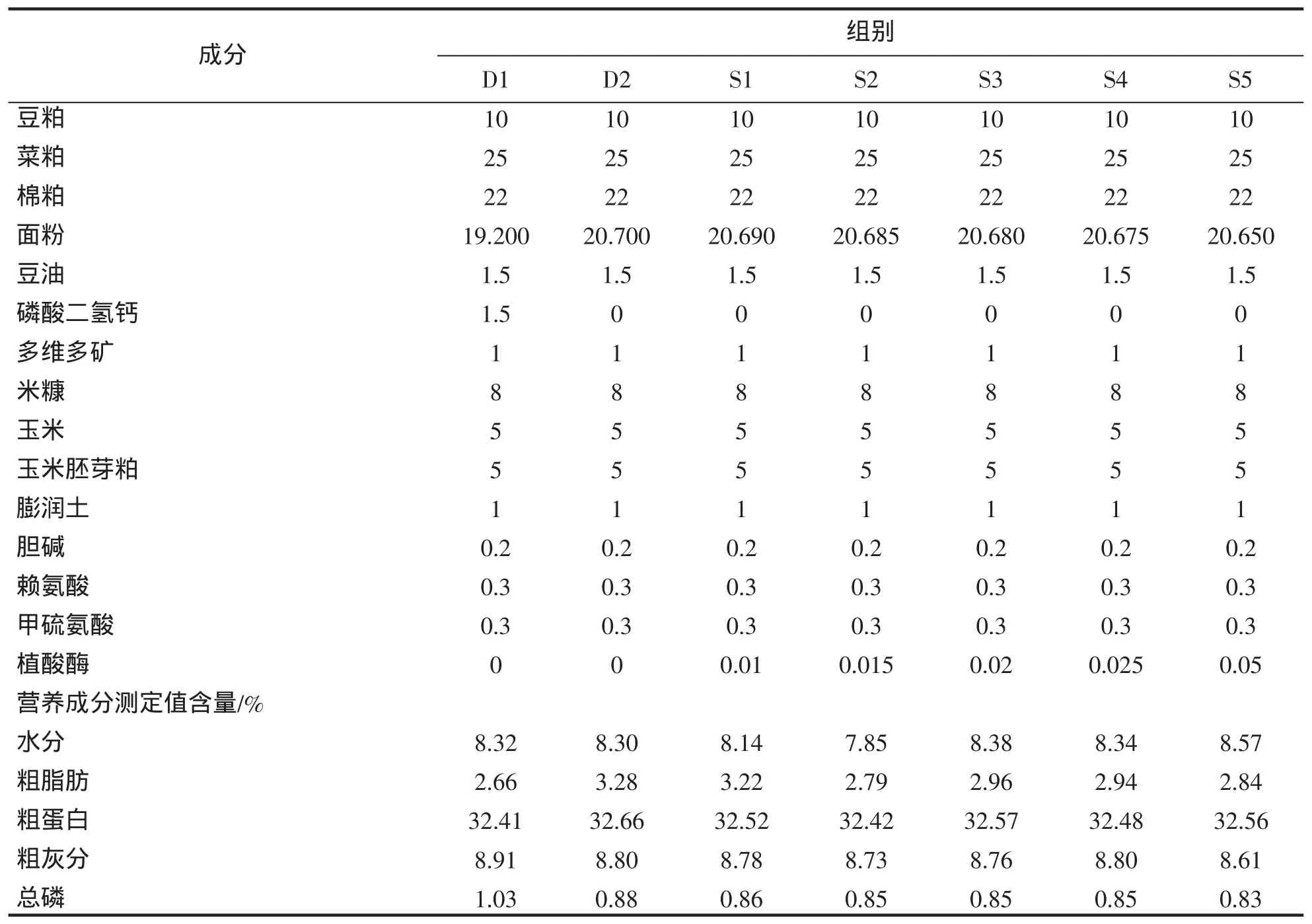
表1 试验饲料组成及营养成分含量(干物质基础%)Tab.1 Composition and nutrient levels of the experimental diets(dry matter basis%)
1.2 试验鱼和饲养管理
试验鱼采用健康的一冬龄草鱼鱼种,初始体重为(39.68±3.05)g。
养殖试验在浙江省淡水水产研究所特种水产苗种基地流过式养殖系统中进行,共21个玻璃纤维水族缸(D 150 cm)。将试验鱼随机分成7组,每组3个重复,每个重复15尾鱼,每天08:30、12:30、16:30定时换水,饱食投饲,保持水缸中无剩余残饵。每天投饲前换水约30%,连续充氧,暂养2周后进行养殖试验,试验时间为8周,试验水为自然曝气的自来水,试验期间水温控制在20~25℃,pH为6.9~7.6,溶解氧含量为5~6 mg/L,氨氮含量0.15~0.20 mg/L。养殖试验结束后禁食2 d称重,并采集试验样品。
1.3 样品采集
每个缸随机取8尾鱼,抽取血液后将血液冷冻离心(3 500 r/min)10 min后取上层血清备用,然后进行解剖,分离出肠道和肝胰脏,将肠道、肝胰脏组织称重,在冰盘上剔除脂肪及内容物,以10倍生理盐水匀浆,将组织悬液冷冻离心(3 000 r/min),上清液为粗酶提取物,于4℃冰箱中备用。
1.4 草鱼生长指标和形体指标测定
试验过程中记录饲料消耗量,根据终末体重和初始体重分别计算特定生长率(SGR)、饲料系数(FCR)和蛋白质效率(PER)等指标。
SGR(%/d)=100×(lnFBW-lnIBW)/t
FCR(%)=FI/(FBW+DBW-IBW)
PER(%)=(FBW-IBW)×100/(FI×PC)
存活率 SR(%)=Nt×100/N0
其中IBW为初始体重,FBW为终末体重,DBW为死亡鱼重,FI为摄食量,PC为蛋白质含量,N0和Nt分别为初始尾数和终末尾数。
1.5 草鱼非特异性免疫指标的测定
非特异性免疫指标中,分别测定超氧化物歧化酶(SOD)和碱性磷酸酶(AKP)活性;血液冷冻离心(3 500 r/min)10 min后取中间层备用;将肝胰脏于10倍鱼用生理盐水中匀浆,冷冻离心(10 000 r/min)10 min后取中间澄清部分测定酶活,置于4℃冰箱中备测。SOD活力采用黄嘌呤氧化酶法测定;AKP活力采用对硝基苯磷酸盐法(试剂盒均购自南京建成生物技术研究所)。
1.6 草鱼消化酶活力的测定
蛋白酶活力采用福林-酚试剂 (Folin-phenol)法测定,酶单位活力定义为在pH 7.5,酪蛋白浓度为0.5%,37℃下每min水解酪素产生1 g酪氨酸为一个酶活力单位[8]。
淀粉酶活力采用碘-淀粉比色法,每mg蛋白在37℃与底物反应30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。
脂肪酶活力测定脂肪酶活性测定参照聚乙烯醇橄榄油乳化液水解法进行;1 g组织中的脂肪酶1 min催化脂肪水解产生1 μmol脂肪酸的酶量定为一个活力单位[8]。
1.7 数据统计分析
试验数据用平均数±标准偏差 (M±SD)表示,分析采用SPSS16.0 for Windows统计分析软件,做单因素方差分析(One way-ANOVA),若有显著差异后再做组间Duncan’s多重比较,显著性水平P为0.05。
2 结果
2.1 全植物蛋白饲料中添加植酸酶对草鱼生长性能的影响
从表2可以看出,全植物蛋白饲料中添加植酸酶对草鱼的SGR、FCR和PER有一定的影响。当植酸酶添加水平大于1 000 U/kg(S3)时,其SGR和PER明显大于D2、FCR则显著低于D2(P<0.05),但其SGR和PER显著低于D1,FCR则明显高于D1(P<0.05)。当植酸酶含量小于1 000 U/kg时,试验组的SGR、FCR和PER与D2之间无显著性差异(P>0.05)。各组之间存活率无显著性差异(P>0.05)。
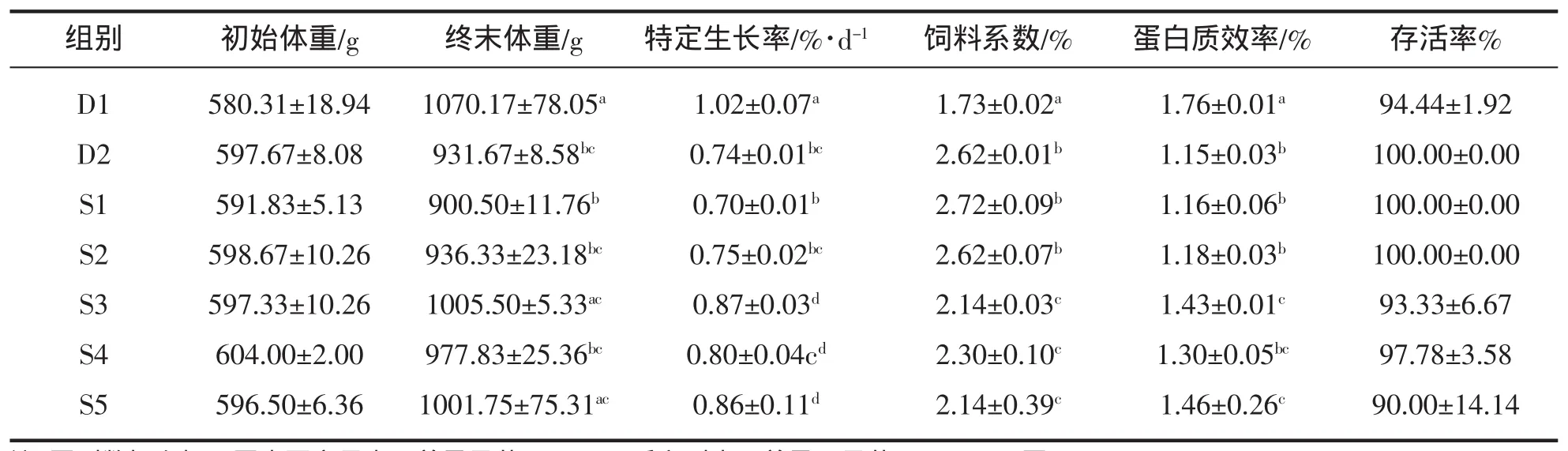
表2 各饲料组草鱼的特定生长率、饲料系数、蛋白质利用率和存活率Tab.2 Specific growth rate,feed conversion ratio,protein efficiency ratio and survival ratio of grass carp fed on experimental diets
2.2 全植物蛋白饲料中添加植酸酶对草鱼非特异性免疫机能的影响
表3中D1的血清SOD活性显著高于其它各组(P<0.05),D2与其他各组之间有显著性差异(P<0.05);各组之间血清AKP活性没有显著性差异(P>0.05)。S4的肝胰脏SOD活性显著高于D1和D2;各组之间肝胰脏AKP活性无显著性差异(P>0.05)。

表3 全植物蛋白饲料中添加植酸酶对草鱼非特异性免疫机能的影响Tab.3 Effects of plant based diets containing different levels of phytase on non-immune of grass carp
2.3 全植物蛋白饲料中添加植酸酶对草鱼消化酶活性的影响
从表4可以看出,当植酸酶添加水平大于1 000 U/kg时,草鱼肝胰脏中的蛋白酶活性明显增强,酶活大于其它各组 (P<0.05);D1、D2和S1之间无显著性差异(P>0.05),S2显著大于2个对照组(P<0.05),对照组之间无显著性差异;当植酸酶活性大于750 U/kg时,各组之间蛋白酶活性无显著性差异(P>0.05),但显著大于D1、D2和S1;S1的肠道蛋白酶活性最低,且与对照组有显著性差异(P<0.05);对照组之间无显著性差异(P>0.05)。
当植酸酶添加水平大于1 250 U/kg时,肝胰脏中的淀粉酶活性显著大于D1、D2及S1(P<0.05),与S2和S3之间无显著性差异 (P>0.05);D1的肝胰脏淀粉酶活性最低,与D2、S1及S2之间无显著性差异 (P>0.05);肠道中S3的淀粉酶活性最高,且与D1、D2和S1之间有显著性差异(P<0.05),试验组之间无显著性差异(P>0.05),对照组的酶活最低,S5与对照组之间有显著性差异(P<0.05),但S1、S2及S4与对照组无显著性差异(P>0.05),对照组之间也无显著性差异(P<0.05)。
当植酸酶添加水平为大于1 000 U/kg时,其肝胰脏脂肪酶活性显著大于对照组和S1(P<0.05),与S2之间无显著性差异(P>0.05),但大于S2;D2的酶活最低,与D1、S1之间无显著性差异(P>0.05);肠道脂肪酶活性中,S1的酶活最低,并与S3、S4、S5之间有显著性差异(P<0.05),S3的酶活最高,与S1、D1之间有显著性差异(P<0.05),与其他各组无显著性差异(P>0.05)。
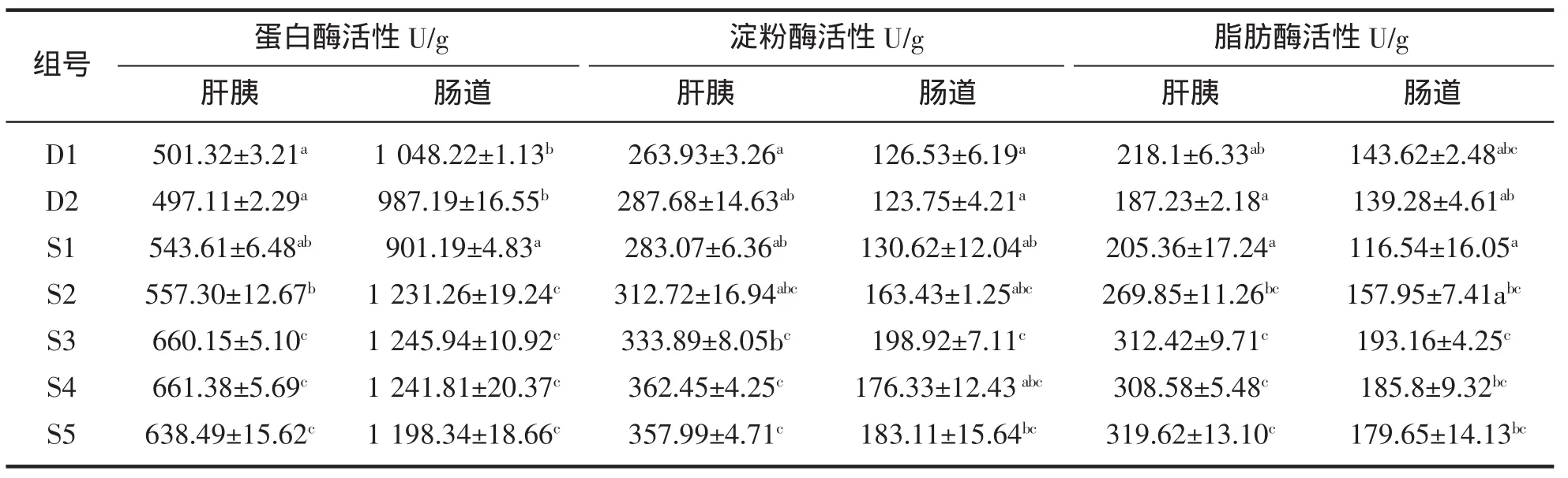
表4 全植物蛋白饲料中添加植酸酶对草鱼消化酶活性的影响Tab.4 Effects of plant based diets containing different levels of phytase on digestive enzyme activities of grass carp
3 讨论
3.1 全植物蛋白饲料中添加植酸酶对草鱼生长的影响
本试验中,添加无机磷组的蛋白质效率最高、饲料系数最低,且与其它各组有明显差异(P<0.05),说明磷对草鱼生长性能的提高十分重要。有研究表明,在饲料中添加植酸酶可以提高奥尼罗非鱼Oreochromis aureus♂×Oreochromis niloticus♀[4]、点带石斑鱼 Epinephelus coioides[9]、尼罗罗非鱼 Oreochromis niloticus[10]等的平均日增重和蛋白质效率,降低饵料系数和死亡率。但也有研究发现植酸酶对韩国石斑鱼[11]、大西洋鲑Salmo salar[12]等的生长无显著影响。刘晓侠等[13]研究表明,添加1 000 U/kg植酸酶能够有效降低鲫鱼Carassius auratus饵料系数;吕林兰等[14]研究也发现饲料中植酸酶添加量1 000 U/kg为时,异育银鲫Carassius auratus gibelio的平均增重率最大(P<0.05),这些研究虽然植酸酶添加量相同,但彼此的基础配方、鱼种、植酸酶质量与种类、试验条件等之间的差异对实验结果有很大影响,本试验中添加的是酸性植酸酶,且当添加植酸酶的添加水平大于1 000 U/kg时,饲料系数显著低于对照组2(D2),蛋白质效率显著提高,说明在添加植酸酶后,草鱼的生长性能得到提高。这可能是在添加植酸酶后部分植酸磷得到释放或有些消化酶被从螯合状态中释放出来从而提高鱼体的生长,从表2可以看出对照组1(D1)的总磷含量远大于其它各组,这可能是由于鱼类在利用磷时通常先利用易于利用的无机磷,当无机磷不足时,植酸酶的作用才得以体现。本试验中,随着植酸酶添加量的增加草鱼的饲料系数呈现下降趋势、蛋白质效率呈现上升趋势,且当添加植酸酶的添加水平大于1 000 U/kg时,草鱼饲料系数较D2显著降低(P<0.05)。
3.2 全植物蛋白饲料中添加植酸酶对草鱼非特异性免疫的影响
植酸酶可与蛋白质等物质形成络合物,影响某些酶和蛋白质的功能和活性,从而对鱼的免疫产生一定的影响。AKP是一种膜结合蛋白,与维持体内钙磷比有关,在免疫反应中发挥作用,当肝细胞受损时,血清AKP活性升高[15]。郑涛等[7]研究表明,无鱼粉饲料中添加植酸酶和磷酸二氢钙有助于降低AKP活性。但本试验结果表明,植酸酶对血清和肝胰脏AKP活性则无显著性影响,这可能是不同的试验鱼和试验条件产生不同的试验结果,同时,在家禽方面也对血清AKP活性有研究,封伟贤等[16]研究发现,在猪饲料中添加酸性植酸酶对猪血清的AKP活性无显著性差异,此结果与本试验结果类似。
SOD是重要的抗氧化酶之一,在消除自由基、防生物分子损伤方面有十分重要的作用,是保护机体免受伤害的一种关键酶,其活性与生物的免疫水平密切相关[15],植酸酶对鱼类SOD活性的影响还未见报道。从表3可以看出,虽然试验组血清SOD活性比添加无机磷(D1)组小,但与D2相比,植酸酶对草鱼血清和肝胰脏中SOD活性有一定的提高作用,且当植酸酶含量大于1 000 U/kg时其作用比较明显,从而说明当植酸酶含量大于1 000 U/kg时,植酸酶对提高草鱼血清及肝胰脏SOD活性有一定的作用,从而有助于草鱼非特异性免疫功能的提高。
3.3 全植物蛋白饲料中添加植酸酶对草鱼消化酶活性的影响
鱼类消化酶活性是反映其消化性能机理的一项重要指标,植酸的络合性影响了鱼类对营养物质的吸收和利用,YOON报道,饲料中的植酸可以降低动物对淀粉的消化率,NYMAN研究表明,大鼠日粮中添加植酸钠时脂肪的消化率有所降低[3]。宋金彩等[17]研究表明,植酸酶可将与植酸络合的蛋白质释放出来,便于消化道分泌的各种蛋白酶作用,同时植酸酶的添加可以解除植酸与内源性蛋白酶、淀粉酶、脂肪酶结合,提高营养物质的消化利用率。朱丽英等[18]研究表明植酸酶能够提高异育银鲫的肝胰脏蛋白酶和脂肪酶,但淀粉酶活性降低,肠道脂肪酶活性增强,但蛋白酶和淀粉酶相对对照组较低。姚瑞清等[19]研究发现1 000 U/kg植酸酶显著提高了奥尼罗非鱼肠道蛋白酶与淀粉酶活性。张璐等[20]研究表明,饲料中添加植酸酶对鲈鱼Lateolabrax japonicus胃和肠道中的脂肪酶和淀粉酶的活性无显著影响,但是显著提高了其胃和肠道中蛋白酶的活性,在本试验中,当植酸酶添加添加水平大于1 000 U/kg时,草鱼肝胰脏及肠道蛋白酶、脂肪酶和淀粉酶活性都显著提高。植酸酶对草鱼肝胰脏和肠道消化酶活性有提高作用,其原因可能是在低pH时,植酸可与蛋白质分子的碱性基团结合,抑制消化酶的活性,而植酸酶可以释放与其结合的消化酶,从而提高消化酶的活性[14];同时,磷的吸收量会影响鱼体内能量的代谢从而影响鱼类消化酶的代谢过程。
4 结论
试验表明,全植物蛋白饲料中添加植酸酶能够提高草鱼的特定生长率和蛋白质效率、降低饲料系数,有助于增强草鱼的非特异性免疫机能,并有效提高草鱼肝胰脏和肠道中的消化酶活性。在本试验条件下,植酸酶适宜添加量为1 000~1 250 U/kg。
[1]文 华,高 文,罗 莉,等.草鱼幼鱼的饲料苏氨酸需求量[J].中国水产科学,2009,16(2):236-246.
[2]DENSTADLI V,SKREDE A,KROGDAHL Å,et al.Feed intake,growth,feed conversion,digestibility,enzyme activities and intestinal structure in Atlantic salmon(Salmo salar L)fed graded levels of phytic acid[J].Aquaculture,2006,256(1/4):365-376.
[3]訾乃涛,常巧玲.植酸酶在水产养殖中的应用研究[J].饲料研究,2005(4):52-55.
[4]聂国兴,李学军,乔志刚,等.植酸酶及其在鱼饲料中的应用[J].淡水渔业,2000,30(2):42-44.
[5]王爱民,殷玉岗,刘文斌.植酸酶在水产动物中作用机制及其应用研究[J].盐城工学院学报:自然科学版,2005,18(1):52-55.
[6]高 明,赵国先,李双安.植酸酶在鱼类饲料中的应用[J].河北渔业,2004(6):8-9.
[7]郑 涛,潘 庆,李桂峰,等.无鱼粉饲料中添加磷和植酸酶对奥尼罗非鱼生长性能及体成分的影响[J].中国水产科学,2006,13(1):112-118.
[8]桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004:113-165.
[9]阮成旭,袁重桂,石祥柱.植酸酶在点带石斑鱼配合饲料中的应用[J].福建水产,2005(1):13-16.
[10]LIEBERT F,PORTZ L.Nutrient utilization of Nile tilapia Oreochromis niloticus fed plant based low phosphorus diets supplemented with graded levels of different sources of microbial phytase[J].Aquaculture,2005,248(1/4):111-119.
[11]YOO G Y,WANG X J,CHOI S,et al.Dietary microbial phytase increased the phosphorus digestibility in juvenile Korean rockfish Sebastes schlegeli fed diets containing soybean meal[J].Aquaculture,2005,243(1/4):315-322.
[12]SAJJADI M,CARTER C G.Dietary phytase supplementation and the utilization of phosphorus by Atlantic salmon(Salmo salar L.)fed a canola-meal-based diet[J].Aquaculture,2004,240:417-431.
[13]刘晓侠,王玉洁,于建兴,等.植酸酶对鲫鱼生长、营养及磷排放的试验[J].饲料研究,2009(3):55-57.
[14]吕林兰,王爱民,殷玉岗,等.植酸酶对异育银鲫鱼种生长及内源酶的影响[J].粮食与饲料工业,2007(3):36-37.
[15]田 娟,冷向军,李小勤,等.复方中草药制剂对草鱼生长性能、肌肉成分和血清非特异性免疫的影响[J].安徽农业科学,2008,36(28):282-298.
[16]封伟贤,廖志超,黄所含,等.饲粮中添加植酸酶对猪生长性能和血清生化指标的影响[J].饲料工业,2006,27(18):37-39.
[17]仇 明,王爱民,吕林兰,等.中性植酸酶对异育银鲫鱼种生长的影响及其在肠道中酶活分布状况[J].粮食与饲料工业,2010(2):38-41.
[18]宋金彩,单安山.植酸酶对蛋白质和氨基酸利用率的影响[J].中国饲料,2000(10):14-15.
[19]朱丽英.植酸酶对异育银鲫生长、内源酶及肌肉成分的影响[D].南京:南京农业大学,2006.
[20]曹 露,叶金云,王友慧,等.植酸酶对日本沼虾生长、体组成和消化酶的影响[J].浙江海洋学院学报:自然科学版,2010,29(3):227-232.
[21]姚瑞清,刘 波,吴婷婷,等.植酸酶对奥尼罗非鱼生长、表观消化率与消化酶活性的影响[J].中国饲料,2008(17):30-32.
[22]张 璐,艾庆辉,麦康森,等.植酸酶和非淀粉多糖酶对鲈鱼生长和消化酶活性的影响[J].水生生物学报,2009,33(1):82-88.

