食线虫真菌的筛选及菌株DF09002的鉴定与产酶特性分析
曾庆飞, 黄惠琴, 朱 军, 方 哲, 吴晓鹏, 孙前光, 鲍时翔*
(1.中国热带农业科学院热带生物技术研究所,海口 571101; 2.海南大学农学院,海口 570228)
根结线虫(Meloidogyne spp.)是线虫中一类分布广、危害大、难以防治的植物寄生线虫,多数种类寄主范围广、致病性强,而且繁殖快、易于传播扩散,已成为世界性威胁农作物生产的最重要的病原物类群之一,由根结线虫为害植物根系引起的土传病害已上升为世界性的重要农作物病害[1-2]。我国热带、亚热带地区的省份及寒带温室蔬菜都有根结线虫发生,一般造成减产10%~20%,严重时减产达70%以上[3]。根结线虫的防治方法目前仍以化学防治为主,但化学药剂广泛使用所带来的环境污染等一系列副作用已日趋凸显,生产应用正逐步受到限制,研究符合现代农业可持续发展战略理念的生物防治方法已显得十分重要和迫切[4]。
在线虫生防资源中,食线虫真菌是一类能寄生、捕捉、定殖或毒杀线虫的微生物,是自然界中控制、平衡和调节线虫种群数量的重要生物因子,在植物病原昆虫和线虫的生物防治中起着非常重要的作用[5]。目前已开发的商品化生防制剂为数不多,而且存在防效偏低或防效不稳定等问题[6],不断筛选在自然土壤条件下对寄生线虫毒力更强的生防菌株具有十分重要的意义。本课题组从海南五指山原始森林、定安雷鸣根结线虫发病胡椒园采集土壤样品及死亡线虫尸体,从中分离筛选获得一批具有抗根结线虫活性的真菌,本文报道了菌株分离、筛选、分类鉴定及其酶系分析的研究结果。
1 材料与方法
1.1 样品采集
从海南五指山原始森林采集土壤样品,从定安雷鸣等地的根结线虫发病胡椒园采集根际土样及死亡线虫尸体。
1.2 培养基
①真菌分离及分类鉴定培养基:采用PDA培养基,灭菌冷却后加入双抗(青霉素100 U/mL、链霉素100 U/mL);②发酵培养基:20%土豆汁1 000 mL,葡萄糖20 g,pH自然;③刚果红羧甲基纤维素钠(CMCNa)琼脂培养基:(NH4)2SO40.2%,MgSO4◦7H2O 0.05%,KH2PO40.1%,NaCl 0.05%,CMC-Na 2%,刚果红0.02%,琼脂2%,pH7.2;④酪蛋白培养基:干酪素1%,琼脂2%;⑤胶态几丁质培养基:K2HPO4 0.07%,KH2PO40.03%,MgSO4◦7H2O 0.05%,FeSO4◦7H2O 0.002%,ZnSO40.001%,NaCl 0.45%,1%(W/V)胶态几丁质15%(V/V),胰蛋白胨0.2%,琼脂1.8%,pH7.0。
1.3 供试线虫
南方根结线虫(M.incognita)采自番茄根结线虫病根,用本室发明的离体方法人工培养(另文发表)。
1.4 真菌分离与待测样品的制备
将土壤及线虫尸体样品经处理制成的水悬液分别稀释,涂布于分离培养基平板,28℃倒置培养2~5 d。通过肉眼观察菌落的不同,挑取单菌落纯化、保存。将活性菌株接种于发酵培养基中,28℃、200 r/min培养6 d,离心发酵液,取上清,备活性检测用。
1.5 抗线虫活性测定
采用菌体-线虫筛选法。取部分离体培养处于繁殖旺盛期的南方根结线虫,连同培养基转入纯化培养已长满菌丝并刚开始产孢的待测真菌平板,轻轻涂布,28℃培养箱内静置,24 h后定期刮取板内线虫,24孔细胞培养板中蒸馏水稀释后倒置显微镜下观察死亡情况,以转入无菌PDA平板中的培养线虫为对照,计算校正死亡率;将活菌丝对线虫的致死率达70%以上的菌株发酵培养,24孔细胞培养板中分别加入1 mL发酵液和约200条经过滤分离的培养线虫,混匀,28℃静置24 h后倒置显微镜下观察,以无菌空白发酵培养基处理作对照,每处理重复3次,计算线虫校正死亡率。
1.6 菌株鉴定
1.6.1 形态学鉴定
参照文献[7],采用平皿插片法进行菌株的培养及形态特征的观察。
1.6.2 分子鉴定
1.6.2.1 DNA的提取
参照文献[8]提取菌株的基因组DNA。
1.6.2.2 PCR扩增
采用ITS序列通用引物(上海生工合成),ITS4:TCCTCCGCTTATTGATATGC;ITS5:GGAAGTAAAAGTCGTAACAAGG 。50 μ L 反应 体积 :10 ×Buffer 5 μ L,dNTPs(各 2.5 mmol/L)4 μ L,10 μ mol/L 引物各 2 μ L,Taq 酶 0.25 μ L,模板 DNA 1 μ L,无菌ddH2O 35.75 μ L 。反应程序:95 ℃预变性2 min;95℃变性1 min,54℃退火1 min,72℃延伸1.5 min,35个循环;72℃延伸10 min,4℃保存。取5 μ L PCR扩增产物在1.5%琼脂糖凝胶上电泳检测,其余产物经纯化后送上海生物工程有限公司测序。
1.7 酶系分析
1.7.1 产酶种类鉴定
无菌条件下用打孔器分别在CMC-Na琼脂平板、酪蛋白平板以及胶态几丁质平板上打孔,加入制备好的菌株发酵液,28℃静置12 h后观察透明圈的形成。
1.7.2 酶活测定
1.7.2.1 几丁质酶活测定
采用DNS(3,5-二硝基水杨酸)测定还原糖的方法测定几丁质酶活。先将培养液用滤纸过滤,取4支试管,分别加入0.5 mL滤液(粗酶液)和0.5 mL 1%几丁质胶体,其中3支试管于40℃水浴60 min,另外1支4℃放置作为对照;水浴60 min后在样品和对照中各加入0.5 mL DNS,沸水浴10 min;加入4.5 mL蒸馏水,离心取上清液于540 nm测量吸光度。还原糖含量以葡萄糖作标准曲线计算。酶活力单位(U)以在上述反应条件下1 min产生1 μ mol还原糖所需的酶量计算。
1.7.2.2 蛋白酶活力测定
采用福林-酚试剂法测定蛋白酶活力。取1%酪蛋白0.5 mL和粗酶液1 mL,40℃水浴10 min,加入0.4 mol/L三氯乙酸3 mL终止反应,3 000 r/min离心3 min,取上清1 mL,加入5 mL 0.4 mol/L Na2CO3和0.5 mL福林-酚试剂,40℃水浴20 min后在650 nm下测定吸光值。在上述条件下1 h由底物产生1 μ mol酪氨酸所需的酶量为一个酶活单位(U)。
2 结果与分析
2.1 真菌的分离与筛选结果
在27份样品中共分离到126株菌落形态有差异的真菌。通过菌体-线虫筛选模型,获得7株菌丝体对线虫具有较强致死作用(校正死亡率在70%以上)的菌株,占供试菌株的5.6%。其中菌株DF09002的杀虫活性最强,校正死亡率达95.3%,且死亡虫体及卵粒体壁全部变得透明、体内组织呈裂解状(图1a)。用24孔板线虫液筛选模型进一步筛选,发现也是菌株DF09002的发酵液活性最高,24 h内能将供试线虫全部杀灭,稀释5倍后校正击倒率仍达68.5%,死亡虫体依然呈透明裂解状(图1b)。对其产生杀线虫活性物质的遗传稳定性进行试验,结果表明,连续5代的菌丝体及发酵液对根结线虫的致死效果保持稳定。因此选取分离自定安雷鸣胡椒根际土样中的菌株DF09002作为研究对象。

图 1 菌株DF09002菌丝体致死线虫特征(150×)
2.2 菌株DF09002的鉴定结果
2.2.1 形态和培养特征
菌落形态:在PDA培养基上菌落为绒毛状,初生时白色,3 d后逐渐变成棕、黑色,反面乳白色。28℃下生长7 d直径可达4.0~5.0 cm。菌丝、分生孢子梗和孢子形态:显微镜下可见不分支的孢子梗,从营养菌丝的厚壁细胞上着生出来,孢子梗顶端圆形,孢子布满于孢子梗顶端的整个膨大部分,聚集成球状分生孢子头,分生孢子呈球形或椭圆形,分生孢子壁光滑;菌丝体透明,分支繁复,有隔膜。
根据形态学观察结果,参阅文献[9],该菌株的形态特征与子囊菌纲、真子囊亚纲、散囊菌目、散囊菌科、曲霉属的黑曲霉符合,初步鉴定为黑曲霉(Aspergullus niger)。
2.2.2 菌株分子鉴定结果
对菌株DF09002的 rDNA-ITS扩增获得了约600 bp的序列(GenBank注册号GU338398),将该序列在GenBank中进行同源性比对,发现与黑曲霉和塔宾曲霉的同源性均达 99%。选择与菌株DF09002同源性高的8个序列进行系统发育学分析,结果如图2所示。结合形态培养特征,将其归类为曲霉属黑色组曲霉黑曲霉集合体,命名为Aspergillus niger DF09002。

图2 基于ITS的菌株DF09002与相关菌株的系统发育树
2.3 菌株DF09002的产酶特性
2.3.1 酶系分析及酶活测定结果
菌株DF09002的发酵液在刚果红CMC-Na琼脂培养基上不产生透明圈,在胶态几丁质和酪蛋白平板上产生了明显透明圈(图 3、图 4),表明菌株DF09002在该培养条件下能产生几丁质酶和胞外蛋白酶,不产生纤维素酶。几丁质酶和蛋白酶的酶活测定结果分别为0.67、41.63 U/mL。
2.3.2 粗酶液反应最适温度
设置不同水浴温度检测酶活,结果表明几丁质酶反应的最适温度为40℃,蛋白酶的最适反应温度 为55℃(图5)。

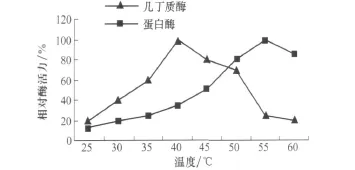
图5 温度对粗酶液酶活力的影响
2.3.3 粗酶液反应最适pH
以柠檬酸缓冲液(pH2.5~6.5)以及磷酸缓冲液(pH6.5~8.0)稀释10%几丁质胶体至1%,成为浓度梯度几丁质胶体底物,测得粗酶液中几丁质酶的最适反应pH为6.8;用不同pH的混合缓冲液(pH2.5~11.0)调节底物酪蛋白的pH,测得粗酶液中蛋白酶的最适反应pH为9.0(图6)。

图6 pH对粗酶液酶活力的影响
产酶特性试验结果显示,菌株DF09002具有较强的几丁质酶活性,而且与多数几丁质酶不同的是,该几丁质酶的最适作用pH不在酸性区,而是在接近中性的环境中。蛋白酶的最适作用pH在碱性范围内,推测可能为丝氨酸类蛋白酶。
3 讨论
本研究中,利用本室发明的根结线虫离体培养技术,采用真菌菌丝与培养基中生长繁殖线虫直接接触的筛选方法,目的是希望能发现以寄生或毒杀方式作用于线虫的菌株;对活性菌株的发酵培养选用马铃薯培养液,是出于该培养液对线虫活性无影响的考虑。本文筛出的活性菌株DF09002是以毒杀方式侵染线虫的,其产孢初期的菌丝体对半固体培养基中的根结线虫即具有较强的抑杀作用,而发酵原液对培养虫体的校正死亡率高达100%,且死亡线虫均呈透明裂解状。在检测的胞外酶种类中,菌株具有较强的几丁质酶和碱性蛋白酶活力,显示它们是DF09002的重要毒力因子之一。
根据形态培养和 ITS序列鉴定结果,将菌株DF09002归类为曲霉属黑色组曲霉黑曲霉集合体,与黑曲霉和塔宾曲霉的同源性均达99%。黑曲霉是一种在发酵工业中用途较广的多种活性酶系的产生菌,据报道部分菌株具有线虫拮抗活性。1903年Metcalf首次描述了小杆线虫上黑色的曲霉属真菌对其有致死作用[10],后来Mankau报道黑曲霉的培养滤液对燕麦真滑刃线虫有活性[11]。1994年Zuckerman报道了黑曲霉菌株PD242的发酵液中主要杀线虫物质为柠檬酸和草酸,还有分子量大于8000MW的一种未测定物质[12]。国内朱晓峰等报道黑曲霉菌株Snf009的发酵液对南方根结线虫2龄幼虫具有抑制作用,并测出以草酸为主的有机酸是主要的线虫拮抗因子[13]。塔宾曲霉中的一些菌株因高产果胶酶而在固态发酵中应用较多,是一种可供利用的糖化菌[14]。HeC,FanY等报道塔宾曲霉菌株NJA-1能高效降解脱氧雪腐镰刀菌烯醇毒素(DON),而且发现是菌株中的一种未知化合物在DON的生物转化过程中起重要作用[15]。但未见塔宾曲霉中有线虫拮抗菌株的报道。
本文中的活性菌株DF09002在产孢初期的菌丝体以及菌体发酵液对线虫及卵粒体壁都有穿透分解作用,在这一侵染毒杀过程中,除几丁质酶和碱性蛋白酶外,可能还存在有机酸等类代谢物的共同作用。下步研究将集中在抗虫活性物质的系统鉴定上,并对菌株的线虫毒杀机理作出综合探讨。
[1]Hesamedin R.Effect of different initial population densities of Meloidogyne incognita on the g rowth of Cicer arietinum[J].Commun Agric Appl Biol Sci,2006,71(3A):669-674.
[2]Khan Z,Kim S G,Jeon Y H,et al.Plant g rowth promoting rhizobacterium,Paenibacillus polymy xa strain GBR-1,suppresses root-knot nematode[J].Bioresource Technol,2008,99(8):3016-3023.
[3]刘维志.植物病原线虫学[M].北京:中国农业出版社,2000.
[4]Siddiqui Z A,Mahmood I.Biological control of plant parasitic nematodes by fungi:a review[J].Bioresource T echnol,1996,58:229-239.
[5]Jain A,M ohan J,Singh M,et al.Potentiality of different isolates of wilt fungus Fusariumoxysporum collected from rhizosphere of tomato against root-knot nematode Meloidogyne incognita[J].Environ Sci Health B,2008,43(8):686-691.
[6]杨宁,段玉玺,陈立杰.植物寄生线虫生物防治中存在的问题及解决途径[J].植物保护,2006,32(4):4-9.
[7]沈萍.微生物学实验[M].第 3版.北京:高等教育出版社,1999:44-45.
[8]杨艳秋.真菌DNA提取方法的建立和比较[J].中国组织工程研究与临床康复,2007,11(50):10093-10096.
[9]戴芳澜.真菌的形态和分类[M].北京:科学出版社,1987,89-94.
[10]Metcal F H.Cultural studies of a nematode associated with plant decay[J].Am Microbiol Soc T rans,1903,24:89-103.
[11]Mankau R.Nematicidal activity of Aspergillus niger culture filtrates[J].Phytopathology,1969,59:1170.
[12]Zunkerman B M,Matheny M,Acosta N.Control of plant-parasitic nematodes by a nematicidal strain of Aspergillus niger[J].Journal of Chemical Ecology,1994,20(1):33-43.
[13]朱晓峰,段玉玺,陈立杰,等.黑曲霉Snf009发酵液对根结线虫的毒性测定及温室防效研究[J].河南农业科学,2009(4):84-85.
[14]Decker C H,Visser J,Schreier P.Beta-glucosidase multiplicity from Aspergillus tubingensis CBS 643.92:purification and characterization of four beta-glucosidases and their differentiation with respect to substrate specificity,glucose inhibition and acid tolerance[J].Appl Microbiol Biotechnol,2001,55(2):157-63.
[15]He C,Fan Y,Liu G,et al.Isolation and identification of a strain of Aspergillus tubingensis with deoxynivalenol biotransformation capability[J].Int J Mol Sci,2008,9(12):2366-2375.

