宁波检验检疫局多次截获非洲伞滑刃组线虫
王江岭, 顾建锋
(宁波出入境检验检疫局技术中心,宁波 315012)
近年来,随着国际木材及木质包装贸易的发展及国内的木材调运等,松树萎蔫病的病原—松材线虫(Bursaphelenchus xylophilus)不断在世界各国传播和扩散。松材线虫起源于美国,逐渐扩散到加拿大、墨西哥、日本、中国、韩国。1998年,葡萄牙海岸松上发现松材线虫[1]后,葡萄牙(包括欧盟其他国家)立即展开调查,并制订了根除计划。但欧洲其他国家仍面临着较大的威胁。2009年7月在南京举行的国际松萎蔫病研讨会上,葡萄牙Evora大学的Mota教授称与葡萄牙接壤的西班牙某地已发现松材线虫[2]。
在进境木质包装检测过程中,宁波出入境检验检疫局植检实验室曾多次截获非洲伞滑刃组线虫。其中2006年5月从来自南非的木质包装中截获非洲伞滑刃线虫(B.africanus);2006年10月、2009年4月分别从来自日本和巴西的木质包装中截获伯氏伞滑刃线虫(B.burgermeisteri);2006年5月、2007年2月、2009年2月分别从来自印度尼西亚、印度尼西亚和巴西的木质包装中截获欧斐切伞滑刃线虫(B.obeche)。现将截获的非洲伞滑刃组线虫报道如下。
1 材料与方法
1.1 样本采集
选取有蓝变或虫蛀特征的木质包装用锯子截成小段,编号后用塑料袋密封,带回实验室。如无症状则随机取样。
1.2 线虫分离与形态鉴定
1.2.1 线虫分离
采用改良漏斗法进行线虫分离。将木样劈成长100 mm、宽10 mm左右的薄片,置于漏斗中,加入适量水(以淹没薄片为宜),25℃恒温培养24 h后,用表面皿接取5~10 mL线虫分离液,镜检。
1.2.2 形态鉴定与测量
用Zeiss Axioskop 40显微镜和Leica DFC 320数码相机对线虫的整体形态和内部特征进行观察、摄影,并用De Man公式法进行形态特征测计。根据形态特征和测计结果,结合相关文献,对该线虫种类进行鉴定。
1.3 ITS-RFLP鉴定
1.3.1 线虫DNA的提取
将线虫放入ddH2O清洗,挑取单条线虫放入200 μ L PCR 管 中[含 8 μ L ddH2O 和 1 μ L 10 ×PCR Buffer(Mg2+free)],85℃加热5 min,-70℃放置30 min,85℃加热2 min,向PCR管中加入1 μ L 1 000 μ g/mL 蛋白酶 K,56 ℃加热 2 h,95 ℃加热10 min,13 000 r/min离心PCR管1 min,得到DNA粗提液,-20℃保存备用。
1.3.2 PCR扩增
PCR 扩增采用50 μ L 反应体系 :ddH2O 19.4 μ L,10 ×PCR Buffer(Mg2+free)5 μ L,25 mmol/L MgCl2 5 μ L,0.1 mmol/L dNTP 4 μ L,10 μ mol/L 上游引物 F 194[3](5′-CGTAACAAGGTAGCTGTAG-3′)3 μ L,10 μ mol/L下游引物 5 368 r[4](5′-T TTCACTCGCCGT TACTAAGG-3′)3 μ L,5 U/μ L Taq 酶 0.6 μ L,模板 DNA 10 μ L 。
扩增程序为:94℃4 min;94℃40 s,52℃1 min,72℃1.5 min,36个循环;72℃8 min。
1.3.3 RFLP分析
取上述 PCR 扩 增产物 8 μ L加 入 0.5 μ L ddH2O,并分别用 0.5 μ L的限制性内切酶Rsa I、Hae III、Msp I、Hinf I、Alu I于 37 ℃酶切 3 h,酶切后的DNA用加了EB的1.5%琼脂糖凝胶电泳(5 V/cm,50 min),紫外检测仪上观察记录结果并拍照,获得线虫的ITS-RFLP指纹图谱(图2)。
2 结果与分析
2.1 分类地位
非洲伞滑刃组线虫隶属滑刃目(Aphelenchida),滑刃总科(Aphelenchoidoidea),寄生滑刃科(Parasitaphelenchidae),伞滑刃属(Bursaphelenchus)。
2.2 测量值
具体测量值如表1所示。

表1 非洲伞滑刃组线虫测量值表μ m

续表1 μ m

图1 非洲伞滑刃组显微照片
2.3 形态描述
非洲伞滑刃组线虫的主要鉴定特征是:侧线4条;尾乳突7个(第3对和第4对靠近并位于交合伞起始处,第3对略位于第4对前并更靠近腹面);交合刺较直,中部有横纹,冠状体愈合(基顶和喙突不明显),远端无盘状突,后阴子宫囊约占肛阴距1/2[5]。非洲伞滑刃组目前已知种类包括:非洲伞滑刃线虫(B.af ricanus)、伯氏伞滑刃线虫(B.burgermeisteri)、欧斐切伞滑刃线虫(B.obeche)。
2.3.1 非洲伞滑刃线虫
雌虫:虫体几乎直,侧线4条。唇缢缩明显。中食道球卵形至梨形,瓣门位于中部。食道腺背覆盖肠,长约4倍体宽。排泄孔位于中食道球对应处。卵巢长,占体长的3/4,卵母细胞多行排列,后渐成单行排列。阴门位于虫体的77%处,明显向内凹陷,形成显著的阴门盖。后阴子宫囊为肛阴距的2/3,偶尔可见精子。尾圆锥形,直,长约3~4倍肛门处体宽,末端圆。
雄虫:虫体前部与雌虫相似,尾部呈钩状。精巢占虫体的1/2至3/4,精母细胞多行渐至单行排列。肛门唇微突出。交合刺长约 21.7 μ m,略腹弯,基顶和喙突不明显,中部有横纹,远端无盘状突。交合伞显著,长约15 μ m,边缘有 3~4个突起,有时不规则。尾乳突7个。
2.3.2 伯氏伞滑刃线虫
雌虫:虫体略腹弯,侧线4条。缢缩明显。中食道球圆形、卵形或梨形,瓣门位于中部。食道腺背覆盖肠,长约4倍体宽。排泄孔紧邻中食道球或位于中食道球后0.5倍体宽处。卵巢长,占体长的3/4,卵母细胞多行排列,后渐成单行排列。阴门位于虫体的77%处,有显著的阴门盖。后阴子宫囊为肛阴距的60%~70%,偶尔可见精子。尾在肛门后明显变细,圆锥形,明显向腹面弯曲,长约 4~5倍肛门处体宽,末端圆。
雄虫:虫体前部与雌虫相似,尾部呈钩状。精巢占虫体的1/2~3/4,精母细胞多行排列。肛门唇微突出。交合刺长约 27.4 μ m,较直,但远端明显弯曲,呈“J”形。基顶和喙突不明显,中部有横纹,远端无盘状突。交合伞显著,长约 15 μ m,铲形或不规则形。尾乳突7个。
2.3.3 欧斐切伞滑刃线虫
雌虫:虫体略向腹面弯曲,侧线4条。唇缢缩明显。中食道球卵形至梨形,瓣门位于中部。食道腺背覆盖肠,长约3.5倍体宽。排泄孔位于中食道球对应处。卵巢长,占体长的2/3~3/4,卵母细胞多行排列。阴门位于虫体的75%处,阴门盖显著。后阴子宫囊为肛阴距的2/3,偶尔可见精子。肛门后虫体明显变细,尾圆锥形,向腹面弯成钩状,长约4~5倍肛门处体宽,末端圆。
雄虫:虫体前部与雌虫相似,尾部呈钩状。精巢占虫体的3/4,精母细胞多行排列。肛门唇明显突出 。交合刺长约23.1 μ m,远端明显腹弯 ,呈“J”形,中部有横纹,基顶不明显,喙突短小,末端锐尖或钝尖,远端无盘状突。交合伞显著,长约 13~14 μ m,卵圆形,有时不规则。
2.4 主要鉴别特征及区别
非洲伞滑刃线虫:侧线4条;交合刺较直,长约21.7 μ m,基顶和喙突不明显;雌虫阴门盖显著,尾较直,末端圆。
伯氏伞滑刃线虫:侧线 4条;交合刺长约27.4 μ m,较直,但远端腹弯呈“J”形,基顶和喙突不明显;雌虫阴门盖显著,尾腹弯,末端圆。
欧斐切伞滑刃线虫:虫体细长,侧线4条;交合刺“J”形,中部有横纹,冠状体几乎愈合,长约23.1 μ m;雌虫阴门盖显著,尾腹弯成钩状,末端圆。
非洲伞滑刃线虫区别于另外2种线虫在于:交合刺较直、微腹弯,雌虫尾部较直。欧斐切伞滑刃线虫与伯氏伞滑刃线虫十分近似,其雄虫交合刺都呈“J”形。区别是前者雌虫尾腹弯更明显,肛门后更明显变细,且末端更宽圆;前者排泄孔位于中食道球对应处,而后者一般位于中食道球后;后者交合刺更长,平均达27.4 μ m,且后者交合刺喙突更锐尖。
2.5 ITS-RFLP图谱
非洲伞滑刃组线虫ITS序列大小分别为:非洲伞滑刃线虫813 bp、伯氏伞滑刃线虫853 bp、欧斐切伞滑刃线虫814 bp。将获得的非洲伞滑刃组线虫的ITS-RFLP图谱(图2)进行比较,限制性内切酶RsaⅠ、HaeⅢ所切出的片段基本一致;限制性内切酶MspⅠ 、HinfⅠ、AluⅠ所切出的片段有所不同,具体酶切片段大小见表2。

图2 非洲伞滑刃组线虫ITS-RFLP图谱的比较
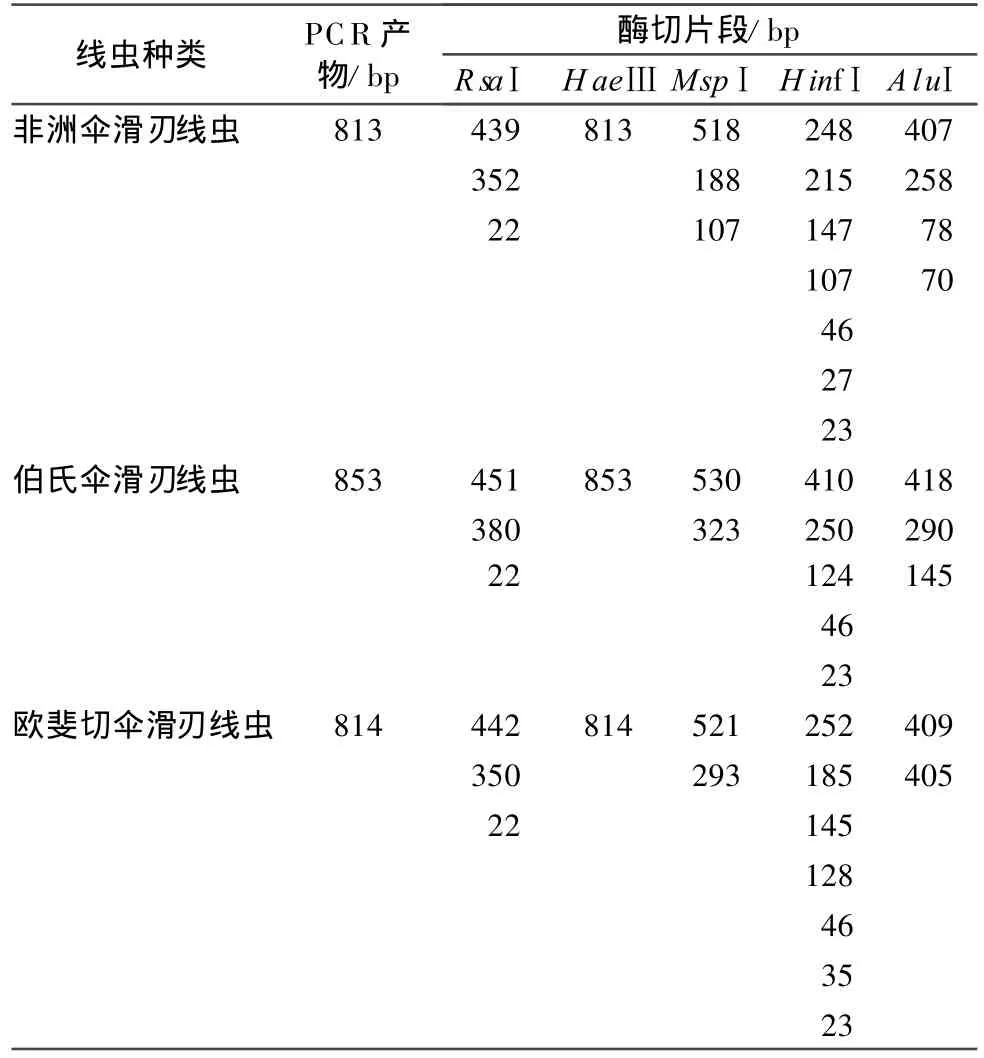
表2 非洲伞滑刃组线虫ITS-RFLP酶切片段大小[8]
3 讨论
上述3种非洲伞滑刃组线虫都是宁波口岸从南非、巴西、印尼和日本等国的白梧桐(Triplochiton scleroxylon)、辐射松(Pinus radiata)和其他松木(Pinus sp.)中截获的。由于木质包装的重复运输和使用,其真正来源尚无法确定。
Braasch[5]等结合形态学和分子生物学特征,认为非洲伞滑刃组线虫与松材线虫组线虫十分接近。由于松材线虫危害极大,其近似种线虫的致病性也值得高度重视。目前尚未开展非洲伞滑刃组线虫的致病性研究,并且我国还没有该组线虫发生的报道,因此,要加强对进境木质包装的检疫,严防其传入我国。
通过对非洲伞滑刃组线虫的ITS-RFLP图谱的比较,作者发现ITS-RFLP方法结果稳定、清晰,可重复性强,是有效而可靠的伞滑刃属线虫种类鉴定辅助手段[9]。
[1]Mota M,Braasch H,Bravo M A,et al.First report of Bursaphelenchus xy lophilus in Portugal and in Europe[J].Nematology,1999,1(7-8):727-734.
[2]Vieira P,M ota M.Progress in research on the pinewood nematode(Bursaphelenchus xy lophilus),2006-2009[C]∥Nanjing Forestry University.International Symposium on Pine Wilt Disease Program and Abstracts.Nanjing:2009:20.
[3]Ferris V R,Ferris J M,Faghihi J.Variation in spacer ribosomal DNA in some cyst-fo rming species of plant parasitic nematodes[J].Fundamental and Applied Nematology,1993,16:177-184.
[4]Vrain T C.Restriction fragment length polymorphism separates species of the Xiphinema americanus group[J].Journal of Nematology,1993,25:361-364.
[5]Braasch H,Burgermeister W,Gu Jianfeng.Revised intra-generic grouping of Fuchs,1937(Nematoda:Aphelenchoididae)[J].Journal of Nematode Morphology and Systematics,2009,12(1):65-88.
[6]Braasch H,Gu Jianfeng,Burgermeister W,et al.Bursaphelenchus af ricanus sp.n.(Nematoda:Parasitaphelenchida found in packaging wood exported from South Africa to Ningbo/China[J].J Nematode Morphol Sy st,2007,9(2):71-81.
[7]Braasch H,Gu Jianfeng,Burgermeister W,et al.Bursaphelenchusburgermeisteri sp.n.(Nematoda:Parasitaphelenchidae)in packaging wood from Japan-a second species of the‘af ricanus'group[J].J Nematode Morphol Syst,2007,10(1):39-48.
[8]Gu Jianfeng,Braasch H,Zhen Wei,et al.Bursaphelenchus obeche sp.n.(Nematoda:Parasitaphelenchidae)found in packaging wood exported from Indonesia to Ningbo,China[J].J Nematode Morphol Syst,2008,10(2):165-175.
[9]Burgermeister W,Braasch H,Metge K,et al.ITS-RFLP analysis,an efficient tool for differentiation of Bursaphelenchus species[J].Nematology,2009,11(5):649-668.

