胃泌素对大鼠胃黏膜的影响
陶琴琴 周丽雅 邓 凯 李 渊 林三仁 杨燕琳 黄 琛 陈 栎
(北京大学第三医院消化科,北京 100191)
在胃肠道激素参与消化系统疾病发生与发展的研究中,胃泌素(gastrin,GAS)尤为引人注目,随着对肿瘤分子生物学的不断研究,在胃癌[1]、大肠癌[2]、胰腺癌[3]以及小细胞肺癌[4]等肿瘤组织中均观察到有胃泌素基因的表达,在癌组织和癌旁组织中胃泌素受体阳性表达率也明显高于正常组织,提示胃泌素可作为肿瘤临床诊断与预后的一项参考指标。Michael等[5]指出胃癌患者血清胃泌素水平明显升高,肿瘤经手术切除后,血清胃泌素明显下降,术后当肿瘤复发时胃泌素水平又再次升高,提示胃泌素的升高可能是胃癌癌前病变的一种征象,可作为鉴别胃良恶性疾病的一个较好的生物学标志物。幽门螺杆菌(Helicobacter pylori,Hp)感染与消化道肿瘤形成的关系正受到人们的重视,Robertson等[6]认为可能与其诱导的胃泌素水平升高有关。因此,对胃泌素的研究,有助于临床上对患者采取合理的治疗方式。本研究通过单独的胃泌素刺激W istar大鼠,探索胃泌素对大鼠胃黏膜的影响。
1 材料与方法
1.1 试剂
胃泌素(注射用)购于 Sigma公司,为白色粉末,使用前用二甲基亚砜(DMSO)配制成浓度为 0.2 μg/μl的溶液。小鼠抗大鼠多克隆胃泌素抗体购于中山金桥公司,兔抗大鼠多克隆组胺酸脱羧酶(histidine decarboxylase,HDC)抗体购于 America Research Product公司,这两种抗体在使用前分别用抗体稀释液配成所需浓度。二抗鼠/兔通用型抗体和 DAB(二氨基联苯胺或联苯二胺,3,3′-diaminobenzidine tetrahydrochloride)显色液均购于Dako公司。
1.2 实验动物及分组
健康雄性 Wistar大鼠 60只,4周龄,体重 70 g左右,北京维通利华实验动物中心提供[合格证号:SCXK(京)2006-0008],饲养于北京大学医学部的实验动物中心。所有动物随机分为 2组,空白对照组 22只,不加任何处理因素,自由饮用纯净水;胃泌素组 38只,连续每天每只皮下注射胃泌素 300 μg/kg,共 30天,自由饮用纯净水。
1.3 动物标本取材和染色
实验第 12周开始取材,每隔 4周取材一次,共观察 56周。空白对照组每次处死 2只(第 54周和第 56周由于动物只数有限各处死了 1只),胃泌素组每次处死 3只。禁食 24小时,2.5%戊巴比妥钠腹腔注射麻醉后,取出大鼠胃,沿胃大弯切开,用生理盐水把胃表面充分清洗干净,然后肉眼观察胃黏膜大体形态变化,每只动物在胃体和胃窦分别取材2块,随后将组织固定于 10%中性福尔马林溶液中,经石蜡包埋、切片(厚度 5μm),进行苏木精 -伊红(hematoxylin-eosin,HE)染色,观察胃黏膜的组织病理学变化,并且在 10倍光学显微镜下,每张切片随机取 10个视野,测量胃泌酸区黏膜层的厚度,取平均值(mm)。
1.4 大鼠胃组织免疫组织化学染色
上述石蜡切片,分别做胃泌素抗体(1∶100)和HDC抗体(1∶400)的免疫组化染色,用磷酸盐缓冲溶液(phosphate buffered saline,PBS)代替一抗作为阴性对照,用公司提供的阳性反应组织作为阳性对照。具体步骤参照操作说明书进行。结果判定标准:凡胞浆中出现明显的棕黄色颗粒为蛋白阳性细胞。每张切片随机观察 10个高倍视野进行细胞计数分析,将上述免疫组化结果用 Image-Pro-Plus6.0图像分析软件进行图像分析,细胞计数。
2 结果
2.1 两组大鼠胃组织 HE染色情况
见图1、2。空白对照组动物胃未见明显异常,且胃黏膜层厚度处于相对平稳的状态。胃泌素组动物胃黏膜层出现腺体的单纯增生,厚度增加。
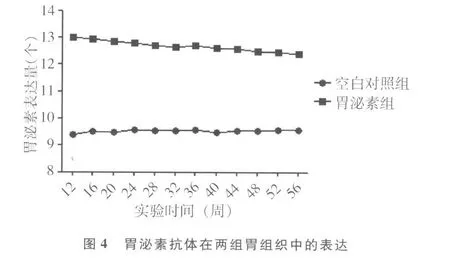
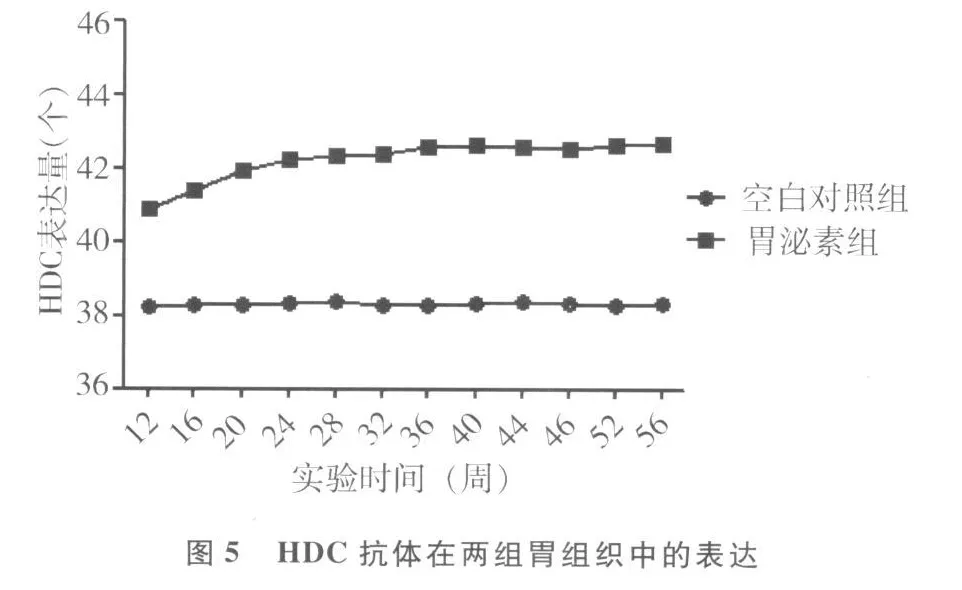
2.2 胃泌素抗体和 HDC抗体在两组胃组织中表达的比较见图3~5。空白对照组胃组织中胃泌素抗体和 HDC抗体的表达始终处于相对平稳的状态。随着实验时间的延长,胃泌素组胃组织中胃泌素抗体的表达虽然逐渐下降,但其表达一直处于相对较高水平状态,而 HDC抗体的表达呈逐渐上升,然后趋于平稳。
3 讨论
胃泌素由分布于胃窦和十二指肠近端的 G细胞分泌,与肠嗜铬样细胞(enterochromaffin-like cell,ECL)上特异受体即胆囊收缩素 B(cholecystokinin-B,CCK-B)结合后,作用于组胺酸脱羧酶,刺激 ECL细胞合成和释放组胺,介导对壁细胞胃酸分泌的调节[7]。同时胃泌素亦作为一种营养性胃肠道激素,不仅刺激正常胃肠道黏膜组织的生长,还能通过与其受体介导的细胞内信号传导途径刺激 ECL细胞过度增殖,刺激胃癌、大肠癌等肿瘤细胞的生长[8]。
本研究结果显示:胃泌素组动物出现了腺体的单纯增生,黏膜层增厚,黏膜快速增厚期为前 24周。尽管本实验胃泌素只连续使用了 30天,但是增厚的胃黏膜在停止了外源性胃泌素的刺激后,在观察的56周内增厚的胃黏膜也没有恢复到正常。对高胃泌素血症的Zollinger-Ellison综合征患者进行结肠镜检查和细胞增殖动力学的研究[9],结果表明长期高胃泌素血症可以促进肠道黏膜过度增生而发生癌变。在癌旁组织中胃泌素阳性表达率明显高于正常组织[10]。癌旁组织中虽然没有明显的组织形态学改变,但是胃泌素的表达已经增高,提示此处组织可能已经处于癌前病变状态,在需要实行手术切除肿瘤治疗时,在切除范围允许的条件下,其远端的切缘应尽可能地远离癌变组织[11]。Kawase等[12]在雄性棉鼠中单独使用 H2受体拮抗剂 loxtidine(即拉伏替丁),造成棉鼠的高胃泌素血症,6个月后 4/5只棉鼠泌酸黏膜出现不规则增厚和胃的重量增加,发生了胃癌。但是本实验没有诱导出胃癌,可能与胃泌素只使用了 30天,使用的时间过短有一定关系,动物的饲养方式、给药方式和药物剂量等均可能导致出现不同的诱癌效果,因此单独使用胃泌素能否引起胃癌发生的研究还有待于进一步深入的探讨。
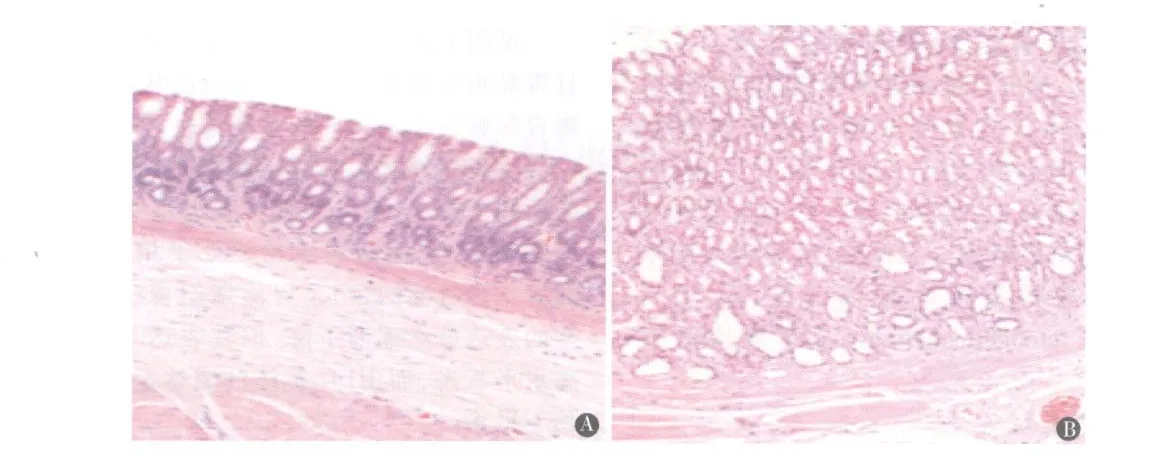
图1 两组大鼠胃体 HE染色图(×100)A.空白对照组;B.胃泌素组。可见胃泌素组腺体单纯增生,胃黏膜层增厚
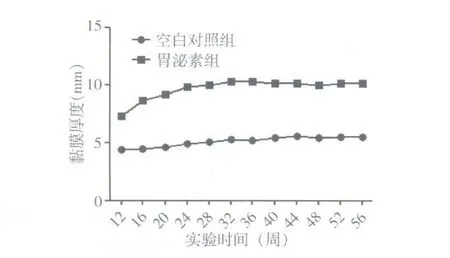
图2 两组大鼠胃泌酸区黏膜层的厚度
为了进一步探讨胃黏膜层增厚的可能机制,本研究采用免疫组化方法对两组胃组织标本进行分析处理。胃泌素抗体作为 G细胞的标记物,HDC是ECL细胞合成组胺所必需的酶,可以作为 ECL细胞的标记物。与空白对照组相比,胃泌素组动物胃泌素抗体和 HDC抗体的表达均升高,提示胃泌素水平升高后,与 ECL细胞上特异性 CCK-B受体结合,刺激 ECL细胞增殖及生长分化,这与既往的研究结论相一致。胃泌素升高后,刺激 ECL细胞的过度增殖是胃泌素促进胃黏膜增厚的可能机制之一。长期使用质子泵抑制剂(proton pump inhibitors,PPIs)的患者,高胃泌素血症导致胃黏膜 ECL细胞增生的现象也比较常见,甚至可以出现 ECL细胞微小结节样增生,连续的组织学观察显示,高胃泌素血症刺激 ECL细胞发生增生以后,即使停用PPIs,不但高胃泌素血症难以恢复,ECL细胞增生也不会恢复,这两者可以互相促进,互为因果[13]。合并 Hp感染的服药患者,由于叠加的影响,随着高胃泌素的加重,胃黏膜ECL细胞增生的现象更为明显[14]。
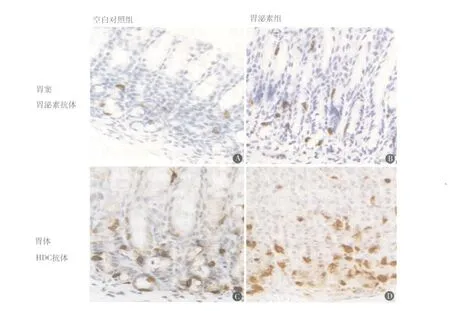
图3 胃泌素抗体和 HDC抗体免疫组化图(×400),两种抗体阳性反应物主要位于胞浆,呈棕黄色颗粒,经苏木素复染后胞核呈蓝色。A.空白对照组胃窦胃泌素抗体;B.胃泌素组胃窦胃泌素抗体;C.空白对照组胃体 HDC抗体;D.胃泌素组胃体HDC抗体。胃泌素组大鼠不同胃组织中胃泌素抗体和 HDC抗体的表达均高于空白对照组
目前临床上常用的 H2受体拮抗剂和 PPIs类药物均可能在抑酸的同时导致胃泌素水平升高,胃食管反流病发生率的升高也会使这两类药物的使用有所增加。而且中国又是一个 Hp感染高发的国家,Hp的感染又会进一步使胃泌素升高。胃泌素水平升高后,可以引起 ECL细胞的过度增殖,黏膜层增厚,且有潜在的诱发胃肠道肿瘤的作用。因此,在使用这些药物之前是否需要根除 Hp,而且在使用这些药物期间是否需要进行随访及药物的使用期限等,均是需要我们解决的问题。分子生物学技术的发展,将会加快对胃泌素及其受体研究的深入,将有助于揭示消化道肿瘤的发病机制,为临床设计受体激动剂和拮抗剂奠定基础。胃泌素及其受体拮抗剂的研究将为消化道肿瘤的内分泌治疗开辟新的途径。
1 Jensen RT.Consequences of long-term proton pump blockade:insights from studies of patients with gastrinomas.Basic Clin Pharmacol Toxicol,2006,98(6):4-19.
2 Kovac S,Anderson GJ,Baldwin GS.Gastrins,iron homeostasis and colorectal cancer.Biochim Biophys Acta,2011,1813(5):889-895.
3 Morton M,Prenderqast C,Barrett TD.Targeting gastrin for the treatment of gastric acid related disorders and pancreatic cancer.Trends Pharmacol Sci,2011,32(4):201-205.
4 王纪文,高 佳,赫 捷.ProGRP与 NSE对小细胞肺癌诊断价值的meta分析.中国肺癌杂志,2010,13(12):1094-1100.
5 Michael DB,Andrea V.Importanceofgastrin in the pathogenesisand treatment of gastric tumors.World JGastroenterol,2009,15(1):1-16.
6 Robertson DJ,Sandler RS,Baron JA,et al.Gastrin,Helicobacter pylori,and colorectal adenomas.Clin Gastroenterol Hepatol,2009,7(2):163-167.
7 Lindstrom E,Chen D,Norlen P,et al.Control of gastric acid secretion:the gastrin-ECL cell-pariet al cell axis.Comp Biochem Physiol A,2001,128(2):505-514.
8 Ito M,Tanaka S,Maeda M,et al.Role of the gastrin-gastrin receptor systemin the expansive growth of human gastric neoplasms.Digestion,2008,784(2-3):163-170.
9 Schott M,Saqert C,Ramp U,et al.Carcinogenic hypergastrinem ia:signet-ring cell carcinoma in a patient with multiple endocrine neoplasia type 1 with Zollinger-Ellison's syndrome.Clin Endocrinol Metab,2007,92(9):3378-3382.
10 王 丽,周丽雅,李 渊,等.胃泌素在胃炎与胃癌中表达的差异及意义.中国微创外科杂志,2011,11(5):435-438.
11 赵想法,王汝俊.胃泌素及其受体与消化道肿瘤的关系考略.中医药学刊,2004,22(9):1638-1640.
12 Kawase S,Waldum HL.ECL-cell derived gastric cancer in male cotton rats dosed with the H 2-blocker loxtidine.Cancer Res,2004,64(10):3687-3693.
13 Geboes K,Dekker W,Mulder CJ,et al.Long-termlansoprazole treatment for gastrooesophageal reflux disease:c linical efficacy and influence on gastric mucosa.Aliment Pharmacol Ther,2001,15(11):1189-1826.
14 沈 健,吴建新,李定国.长期使用质子泵抑制剂所致高胃泌素血症及其对策.中国临床药理学与治疗学,2006,11(12):1321-1325.

