多发性硬化病人血清和脑脊液壳三糖苷酶活性的研究
王运良 张玉镇 耿同超 张晓席 曾志磊 韩 冰 尹红蕾
1)解放军第148医院神经内科 淄博 255300 2)清华大学玉泉医院神经内科 北京 100049 3)郑州大学第二附属医院神经内科 郑州 450014
多发性硬化(MS)是由淋巴细胞、巨噬细胞、小胶质细胞、抗体及补体介导的一种中枢神经系统(CNS)的炎症脱髓鞘疾病。巨噬细胞产生细胞因子并激活CD4细胞启动炎症反应成为T辅助细胞,巨噬细胞吸收细胞碎片、蛋白酶并释放细胞因子,在脱髓鞘中起重要作用[1]。
壳多糖酶家族属于18家族糖基水解酶,人类壳多糖酶的壳三糖苷酶(CCTS)在活化的巨噬细胞,尤其病理条件下长期表达。组织巨噬细胞表达高活性的CCTS,引起脂质积聚,在溶酶体脂质紊乱、地中海贫血、镰刀状贫血等病人的血液中,CCTS活性明显升高[2]。活动性 MS病变的特点是血管周围淋巴细胞和单核细胞浸润,由星型胶质细胞产生的巨噬细胞趋化因子,诱导单核细胞从血液向脑组织迁移,并分化为巨噬细胞。斑块中央早期损伤部位为巨噬细胞充填,在慢性活动性MS时,细胞浸润不明显,仅限于斑块周围,充填脂质的巨噬细胞和淋巴细胞围绕在缺少细胞的斑块中央,提示浸润的巨噬细胞和小胶质细胞的活化,使CNS的CTTS活性增加和脑脊液(CSF)内CTTS积聚[3]。我们研究的目的是探讨MS病人CSF中CCTS活性,以及CTTS活性增高与炎症或免疫活化的关系,为MS的治疗提供理论依据。
1 材料和方法
1.1 病例收集 2004-01~2010-12我们在解放军第148医院、清华大学玉泉医院、郑州大学第二附属医院神经内科对诊断为MS的住院病人开展此项试验,排除缺少腰穿(LP)记录、临床资料不完整者,共178例病人入组。根据 MS的诊断标准,符合复发缓解型 MS(RRMS)120例,继发进展型MS(SPMS)32例,原发进展型 MS(PPMS)26例。另外选择40例其他神经疾患(OND),和30非神经疾患病人作为对照组。OND包括脊髓型颈椎病、B12缺乏、血管病、肌萎缩侧索硬化(ALS)、脊髓空洞、脊髓损伤等。对照组病人包括同时间内在上述三所医院腰穿检查排除神经疾病者,包括头痛、良性颅内压增高、无明显原因震颤、发作性感觉丧失、眼睑下垂等,对其血清和CSF中CTTS活性及CSF单核细胞数(MNC)和鞘内IgG产物进行检测。
1.2 方法 所有入组病例在24h内完成体检、辅助检查和生化检查,静脉穿刺收集血液标本,室温下离心5min(1500×g),取上清液分储于-80℃ 冰箱备用。选择第3~4腰椎间隙为穿刺点,穿刺成功后收集CSF,常规检查后将CSF离心5 min(800×g),将上清液分装于小试管内,-80℃ 冰箱冻存备用。待标本收集完成后进行常规酶活性测和CSF及血清壳三糖苷酶检查。简述如下:将冰冻的CSF和血清标本复温,用4MU三乙酰壳三糖孵育2h,CTTS与三乙酰壳三糖形成4甲基伞形酮,加入过量甘氨酸缓冲液终止反应。应用CobasFara荧光定量分析仪(Roch公司,荷兰)测定4甲基伞形酮含量,计算CTTS比率,CTTS比率除以Q白蛋白(CSF和血清白蛋白浓度的比例)来计算CTTS指数。CSF检查的变化系数(CV)在10.6μmol/(h·L)(n=10)活性时是3.8%,在4.88 μmol/(h·L)(n=10)活性时为0.66%。血清化验检查中的CV 在52.4μmol/(h·L)(n=10)时为 1.54%,在 134.3 μmol/(h·L)(n=10)时为1.55%。CSF化验检查中CVs如下,5.0% (4.8μmol/(h·L),n=3),血 清 2.2% (118.5 μmol/(h·L),n=3)。CTTS活性不受性别影响。免疫印迹方法分析CSF和血清寡克隆IgG带,比浊法测定白蛋白和IgG浓度(贝克曼图像分析仪,荷兰)。IgG指数=(CSFIgG除以血清IgG)/(CSF白蛋白/血清白蛋白),以IgG指数>0.58为升高。按照Reiber等的方法计算鞘内Ig产物[4]。
1.3 统计学分析 应用SPSS 10.0统计程序软件包完成统计分析,对两组间比较应用秩和检验,多组间比较应用Kruskal-Wallis检验,其他应用post-hoc检验。
2 结果
2.1 临床特点和CSF标志物 RRMS、PPMS、SPMS组与OND组和对照组年龄无明显差异。SPMS和PPMS组扩展残疾状态量表(EDSS)评分高与OND组,而RRMS组不明显。RRMS、PPMS和SPMS组与OND组病程类似。与OND组相比,RRMS、PPMS和SPMS组CSF单核细胞数增高。MS组病人76.5%~95%(全部 MS病人82.6%)CSF发现克隆IgG带,而OND组为8.9%。MS病人IgG指数增高但与鞘内IgG产物的比例降低(见表1)。
2.2 CTTS活性和CTTS指数 MS病人血清CTTS活性与OND组相比无明显不同,但CSF中CTTS活性明显高于OND组(P<0.001)。MS组CTTS指数也明显高于OND组(P<0.05)和对照组(P<0.001)。在全部 MS病人,RRMS和SPMS组CTTS指数与OND和对照组明显升高。按照对照组测定的数值,我们界定CTTS的参考上限(p95=均数+2×SD)为0.045,大部分 RRMS、SPMS和P PMS组病人CTTS指数均高于0.047(见表2)。
2.3 CTTS活性与CSF免疫活化及炎症的关系 在RRMS组,CSF伴有MNC增高或寡克隆IgG带病人的CTTS指数高于无MNC增高或寡克隆IgG带病人,这种现象也见于整体MS组。在SPMS与PPMS病人,伴有CSF寡克隆IgG带病人CTTS指数高于无寡克隆IgG带病人,而MNC没有这种关系(见表3)。
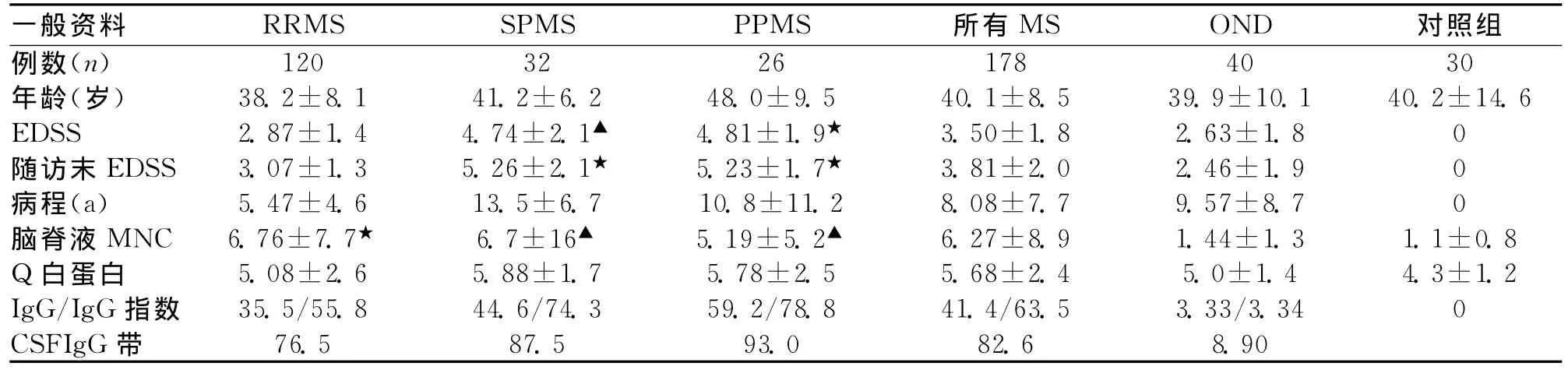
表1 临床特点与炎症或免疫活化的CSF标志物比较
表2 CSF与血清CTTS活性和CTTS指数 ()
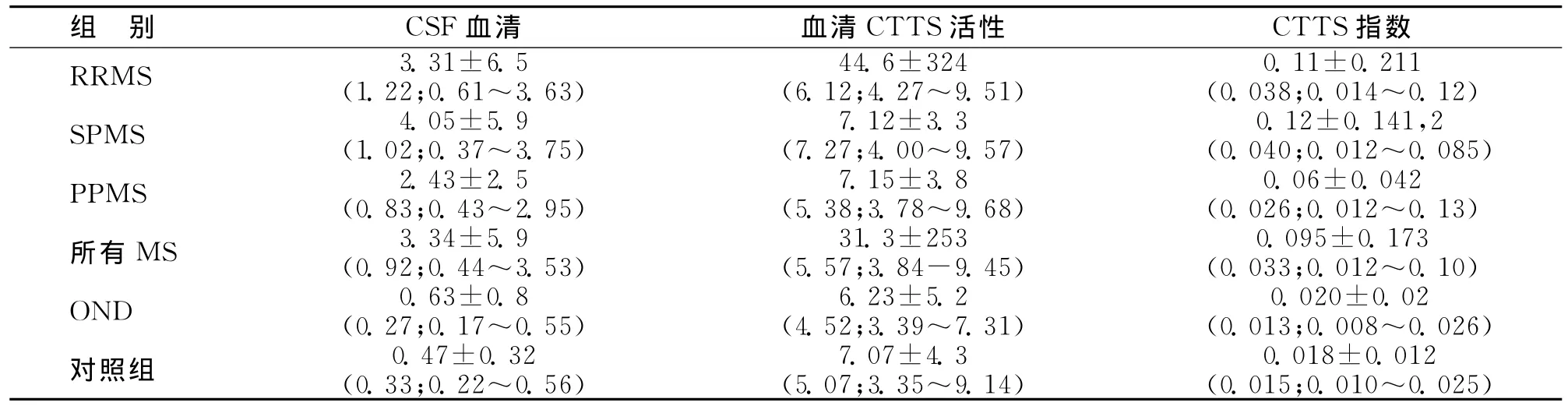
表2 CSF与血清CTTS活性和CTTS指数 ()
注:(1)RRMS和SPMS组与对照组比较,P<0.05;(2)SPMS组与OND组比较,P<0.05;(3)MS组与 OND组比较,P<0.05;(4)MS组与对照组比较,P<0.001
表3 CTTS指数与MNC、鞘内IgG产物及寡克隆IgG带 ()

表3 CTTS指数与MNC、鞘内IgG产物及寡克隆IgG带 ()
注:组内比较,癎P<0.05;组内比较,▲P<0.01;组内比较,★P<0.001
3 讨论
我们的研究发现,在 MS病人,RRMS和SPMS病人CTTS指数增高,尤其是RRMS病人CTTS指数更高,认为CCTS指数增高与鞘内免疫活化或炎症有关。人类的CTTS主要来自单核细胞或巨噬细胞家族,包括小胶质细胞,这些细胞活化导致CTTS分泌增加。MS时巨噬细胞或小胶质细胞介导炎症和吞噬作用,因此认为CSF中CTTS活性增高可能是由于鞘内炎症反应或吞噬作用引起。有研究报道,亚洲人群视神经脊髓炎病人活化的CD4阳性T细胞产生白介素-17可引起中性粒细胞的增殖、成熟和趋化性,但仅限于MS的视神经脊髓炎症,而欧洲病人缺乏这种相关性[5]。
以往认为,SPMS病人炎症和免疫活化较RRMS少见,我们发现RRMS和SPMS病人与对照组相比CTTS指数增高,但在SPMS病人,CTTS指数增高仅限于CSF寡克隆IgG带病人,在不伴有IgG指数增高或鞘内产物的SPMS病人,尽管CSF内MNC升高,CTTS没有明显增加。这种现象提示免疫介导的炎症反应并非是SPMS病人CTTS活性增高的主要原因,说明SPMS病人的CSF病理学较RRMS更复杂,无论是MRI对比增强或免疫组织化学显示炎症证据不明显,尸检证实SPMS组织结构紊乱主要是由于退行性变伴有轴突变性[6]。由此推断,与RRMS相比,SPMS病人的CTTS指数增高,可能反应有其他的病理过程参与,并非炎症或吞噬作用等简单的病理过程。
最近欧洲的一项研究报道,MS病人CSF和血浆CTTS活性明显增高,而且SPMS病人血液CTTS活性高于RRMS病人[7]。但我们研究发现MS病人血液CTTS活性不增高,SPMS病人与RRMS相比无明显变化,PMS病人与RRMS相比CSF中CTTS活性轻度升高,但CTTS指数无明显差别。部分原因可能是由于亚洲与欧洲人群之间不同的临床特点造成的,也可能是由于欧洲人群特定的基因或免疫学特点与SPMS病人巨噬细胞或小胶质细胞活性增高有关,确切原因有待进一步研究。另有文献报道,欧洲撒丁岛人群MS的发病机制与特定的人类白细胞抗原(HLA)等位基因有关,且不同HLA亚型的淋巴细胞产生不同的细胞因子[8]。我们总共对178例MS病人,其中包括26例PPMS病人进行研究,而它们的研究为22例MS病人,仅包括2例PPMS病人,样本数远远多于它们的研究报道。我们发现PPMS的CTTS指数没有升高,提示PPMS病人的巨噬细胞或小胶质细胞活性较SPMS病人明显降低。一般情况下,PPMS病人很少有头颅MRI异常,常表现典型的脊髓纵向损害,脊髓损伤常导致残疾,邻近损害部位的蛛网膜下腔CSF检查更易发现CTTS增高,但由于脊髓体积小,周围损伤不明显,这也是PPMS病人CTTS活性没有增高的部分原因。
另外,我们发现82.6%的MS病人CSF出现寡克隆IgG区带,鞘内IgG产物为41.4%,63.5%病人IgG指数增高,低于其他文献报道。由于我们的研究样本来自三家不同的医院,经过临床专家和MRI、CSF和诱发电位检查,包括少数非典型或症状和体征不明显得到确诊的MS病人,与来自单个医院或某一地区其他的报道可能有某些区别。因此,我们的研究发现RRMS和SPMS病人CSF的CTTS指数增高,这种增高与CSF的炎症及免疫活化有关,但其确切机制需要独立的相关研究进一步证实。
[1]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8:958-969.
[2]Aguilera B,Ghauharali VD,Helmond MT,et al.Transglycosidase activity of chitotriosidase:improved enzymatic assay for the human macrophage chitinase[J].J Biol Chem,2003,278:40911-40916.
[3]Petzold A,Eikelenboom MJ,Keir G,et al.Axonal damageaccumulates in the progressive phase of multiple sclerosis:three year follow up study[J].J Neurol Psychiatry,2005,76:206-211.
[4]Reiber H,Thompson EJ,Grimsley G,et al.Quality assurance for cerebrospinal fluid protein analysis:international consensus by an internet-based group discussion[J].Clin Chem Lab Med,2003,41:331-337.
[5]Ishizu T,Osoegawa M,Mei FJ,et al.Intrathecal activation of the IL-17/IL-18axis in opticospinal multiple sclerosis[J].Brain,2005,128:988-1002.
[6]Liu B,Hong JS.Role of microglia in inflammation-mediated neurodegenerative disease:mechanisms and strategies for rherapeutic intervention[J].J Pharmacol Exp Ther,2003,304:1-7.
[7]Comabella M,Dominguez C,Rio J,et al.Plasma chitotriosidase activity in multiple sclerosis[J].Clin Immunol,2009,131:216-222.
[8]Sotgiu S,Barone R,Arru G,et al.Intrathecal chitotriosidase and the outcome of multiple sclerosis[J].Mult Scler,2006,12:551-557.

