青蒿素的免疫抑制作用及其调控机制研究
李 覃,陈 虹,梅 昕,那春祺,韦 娜,曹 波,白淑芳
(1.天津武警医学院免疫学教研室,2.天津市职业与环境危害生物标志物重点实验室,3.天津武警医学院生药学教研室,天津 300162)
近年来,随着工业化程度的逐步提高,自身免疫性疾病、超敏反应性疾病等由免疫反应过度而引起的疾病也在不断增加,寻找高效低毒的免疫抑制剂已成为当前一个研究热点。有证据表明,中药免疫抑制剂具有高效低毒的特殊疗效,但由于制剂质量难以控制、作用机制难以明确,限制了其在临床中的广泛应用。采用现代提取分离技术,从中药中获得具有免疫抑制活性的单体化合物,将克服这些不足,并有望创制免疫抑制新药。青蒿为菊科植物黄花蒿Artemisia annuaL的干燥地上部分,主要含有青蒿素、青蒿甲素、青蒿丙素、青蒿酸、青蒿内酯、黄酮、香豆素和挥发油等成分,具有清热解暑、除蒸、截疟等功效[1]。其中,化学单体青蒿素(artemisinin,Art)由我国药学家首先于20世纪70年代提取分离得到,分子式C15H22O5(Fig 1),是我国第一个被WHO认可按西药研究标准开发的高效抗疟药。由于脑型疟疾的发病机制与自身免疫有关,因此人们推测Art除直接杀灭疟原虫外,还可能具有免疫调节作用。通过近十年的实验及临床研究证实,青蒿素具有一定的免疫抑制活性,对类风湿性关节炎、红斑狼疮等自身免疫性疾病都显示出不同程度的治疗或保护作用[2],但具体作用机制尚未完全阐明。本文通过体外细胞培养和体内动物实验,进一步探讨青蒿素调节机体免疫系统及其免疫抑制的作用机制。
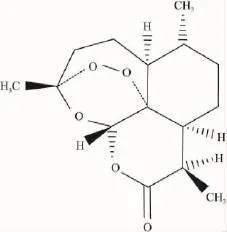
Fig 1 Chemical structure of artemisinin
1 材料与方法
1.1主要材料Art(纯度99.5%)购于郑州荔诺生物科技发展有限公司;DMSO、MTT、二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)、ConA、地塞米松(dexamethasone,Dex,纯度≥ 98%)购于 Sigma 公司;RPMI 1640、胎牛血清(FCS)购于 Gibco公司;p38 MAPK及其磷酸化抗体Phospho-p38 MAPK(Thy180/Tyr182)购于Santa Cruz公司,WST-1细胞增殖试剂盒、p-38MAPK抑制剂SB203580购于碧云天公司;Bradford蛋白浓度测定试剂盒、增强化学发光(enhanced chemiluminescence,ECL)试剂盒购于Pierce公司;TGF-β1 ELISA试剂盒购于R&D公司;ICR小鼠(6~8周龄,♀)购于中国人民解放军军事医学科学院实验动物中心,动物合格证SCXK-(军)2007-004。
1.2细胞悬液的制备小鼠眼球取血处死,无菌分离小鼠颈部、颌下、锁骨下、腋窝等处淋巴结,200目筛网研磨过滤,收集细胞悬液,洗涤3次(4℃,250×g,5 min),以RPMI 1640完全培养基(含10%热灭活FCS,100 ku·L-1青霉素 - 链霉素)调细胞密度为1 ×109·L-1。
1.3细胞培养及增殖活性分析Art溶于DMSO成1 mmol·L-1,滤过除菌,-20℃贮存,体外实验时以RPMI 1640培养基稀释至所需浓度(DMSO终浓度不高于0.1%,该浓度对细胞生长无明显影响)。检测ConA刺激的T淋巴细胞增殖。实验分组如下:空白本底(只加RPMI 1640完全培养基)、对照组(5 mg·L-1Con A)和不同浓度Art干预下的ConA实验组,培养48 h。按照WST-1细胞增殖试剂盒说明,每孔加20 μl WST-1溶液,450 nm处测定光吸收度(A值),计算细胞生长抑制率。抑制率/%=(对照组A均值-实验组A均值)/(对照组A均值-空白本底A均值)×100%。以地塞米松(Dex)作为阳性对照药物。同时,另设DMSO溶剂对照组,观察其对细胞增殖活性的影响。
1.4MTT法检测药物毒性参照文献,以MTT法检测药物的毒性作用[3]。将已制备好的单细胞悬液接种于96孔板,设空白本底、对照组(只加淋巴细胞悬液)、实验组(加入相应浓度的药物)。48 h后,加入5 g·L-1MTT 20 μl,37C 避光孵育4 h,250×g离心5 min,弃上清,加入100 μl/孔 DMSO 溶解甲臜结晶,于490 nm波长检测各孔A值,计算各组细胞的相对存活率。相对存活率/%=[(A实验组-A空白本底)/(A对照组-A空白本底)]×100% 。同时,另设DMSO溶剂对照组观察其对细胞生长状态的影响。1.5动物模型的建立及给药方法以典型的细胞免疫反应——迟发型超敏反应(delayed-type hypersensitivity,DTH)为指标,体内给药探讨 Art的免疫调节功能。参照文献方法[4]建立DTH小鼠模型:实验前1 d小鼠腹部去毛约3 cm。开始日(d 0)和d 1于去毛部位涂0.5%DNFB(以4∶1丙酮橄榄油配制)40 μl致敏。d 6于左耳内外侧涂0.3%DNFB 20 μl激发。诱发前0.5 h和诱发后6 h小鼠左耳外涂Art乳膏(本室自制,Art浓度分别为2%、4%、8%)。激发后48 h处死小鼠。以Dex作为阳性对照。以乳膏基质作为基质对照。同时另设正常小鼠对照组,以相应剂量Art处理,观察正常机体对Art是否有毒副反应。
1.6DTH反应的测定颈椎脱臼处死小鼠,剪下左右耳壳,用打孔器在相同部位取直径8 mm耳片,游标卡尺测厚度、电子天平称重量;同时取小鼠胸腺及脾脏称重。以左右耳片厚度、重量之差为肿胀度;以每10g小鼠的脾重和胸腺重作为脾指数和胸腺指数。胸腺(脾)指数=[胸腺(脾)质量(mg)/体质量(g)]×10。
1.7RT-RCR法检测T-bet、GATA-3的mRNA表达收集各组小鼠引流淋巴结,采用异硫氰酸胍法提取组织RNA,分光光度计测 A260/A280比值在1.8~2.0之间。引物序列由金思特科技有限公司合成如下:T-bet(413 bp):上游引物5'-GATCGTCCTGCAGTCTCTCC-3',下游引物 5'-AACTGTGTTCCCGAGGTGTC-3';GATA-3(364 bp):上游引物5'-AGTGTGTGAACTGCGGGGCA-3',下游引物 5'-TCCAGCGCGTCATGCACCTT-3';GAPDH(225 bp):上游引物5'-TGGAGAAACCTGCCAAGTATG-3',下游引物5'-CCCTGTTGCTGTAGCCGTAT-3'。按照 Promega公司逆转录试剂盒说明进行cDNA合成。PCR扩增条件为:预变性94℃ 5 min,94℃ 30 s、57℃ 45 s、72℃ 30 s,共34个循环。扩增产物经1.0%琼脂糖凝胶电泳后,应用Gel-Doc2000凝胶成像分析系统测定各组条带。
1.8双抗体夹心ELISA法检测TGF-β1含量收集各组小鼠耳片组织,置于含0.1%Tween 20的PBS中匀浆,取上清,双抗体夹心 ELISA法检测TGF-β1含量。将抗小鼠TGF-β1单抗包被于酶标板,标准品和样品中的TGF-β1与单抗结合形成免疫复合物,加入生物素化的抗小鼠TGF-β1抗体和辣根过氧化物酶标记的亲和素、生物素与亲和素结合,加酶底物显色,用MK3酶标仪在450nm处测定A值,通过绘制标准曲线求出标本中TGF-β1含量。
1.9Western blot检测p38 MAPK的活性表达收集各组小鼠淋巴结,提取组织蛋白,Bradford法定量蛋白含量,SDS-PAGE电泳,半干法转至 PVDF膜,5%脱脂奶粉封闭,一抗(phospho-p38 MAPK,1∶1 000)孵育,4℃过夜,TBST洗膜后以辣根过氧化物酶标记的二抗(1∶2 000)室温孵育2 h,ECL法检测。用Stripping Solution洗脱、封闭后,再次加入一抗(p38 MAPK,1∶1 000)、二抗,显影。采用BioRad系统进行数据分析处理。此外,另建DTH模型,给予p-38MAPK的选择性抑制剂SB203580(0.2%)进行干预,给药方式同前,观察小鼠耳肿胀情况。
1.10统计学方法计量资料以±s表示,所有数据均用SPSS 13.0统计软件进行统计分析,采用单因素方差分析进行组间比较。
2 结果
2.1Art对小鼠T淋巴细胞增殖的影响如Fig 2所示,各剂量Art对ConA诱导的T细胞增殖呈现明显的抑制作用,与低剂量 3.13 μmol·L-1相比,25~200 μmol·L-1抑制率差异有显著性。达到 200 μmol·L-1时,Art的抑制效应甚至高于Dex阳性对照组。
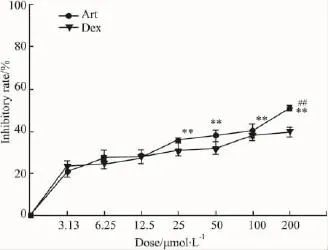
Fig 2 Artemisinin inhibited ConA-induced lymphocyte proliferation
2.2Art的细胞毒性作用3.13 ~200 μmol·L-1的Art作用48 h后,细胞存活率都在70%以上(Fig 3),毒性低于最高的毒性致死量(一般指50%致死所需的药物剂量),因此可认为该药物毒性较小。阳性对照Dex的毒性作用明显高于Art(P<0.01),最低存活率仅(38.97±3.18)%。此外,实验条件下DMSO溶剂对细胞生长增殖和活性状态均未见明显影响。

Fig 3 The cytotoxicity of artemisinin
2.3Art抑制DTH小鼠耳肿胀度与DTH模型小鼠相比(Fig 4),透皮给药的各剂量Art均明显抑制小鼠耳肿胀,且呈一定的剂量依赖性。Art对DTH的抑制效应提示其能有效下调机体的细胞免疫应答。此外,乳膏基质对照组对小鼠未见明显影响,说明基质对DTH没有作用(数据未显示)。

Fig 4 Artemisinin suppressed the DTH in mice
2.4Art对脾/胸腺指数的影响DTH模型组脾指数、胸腺指数均明显升高,Art干预组可降低免疫器官的脏器指数,差异具有显著性(Fig 5)。因此,实验条件下Art显示出一定的免疫抑制效应。与初始体重相比,各剂量Art对小鼠体质量均无明显影响,而Dex则明显降低小鼠体质量,占初始体质量的(97.61±2.85)%,显示出一定的机体毒性。此外,接受相应剂量Art的正常小鼠未见有何不良反应,说明实验条件下Art对正常机体无明显毒副作用。
2.5Art对Th1/Th2细胞转录因子基因表达的影响T-bet选择性表达于Th1细胞,是Th1细胞特异性转录因子,在Th1细胞的分化过程中起决定性作用[5];GATA-3 则是 Th2 细胞的特异性转录因子[6]。为探讨Art对Th1/Th2免疫平衡的调节作用,采用RT-PCR检测T-bet和GATA-3的基因表达。结果显示(Fig 6),Art能够抑制T-bet基因表达,同时上调GATA-3的mRNA水平,最终使T-bet/GATA-3比值明显降低。可见,Art通过影响T-bet和GATA-3基因表达抑制Th1细胞分化、促进Th2细胞分化,从而调节Th1和Th2免疫应答的平衡。
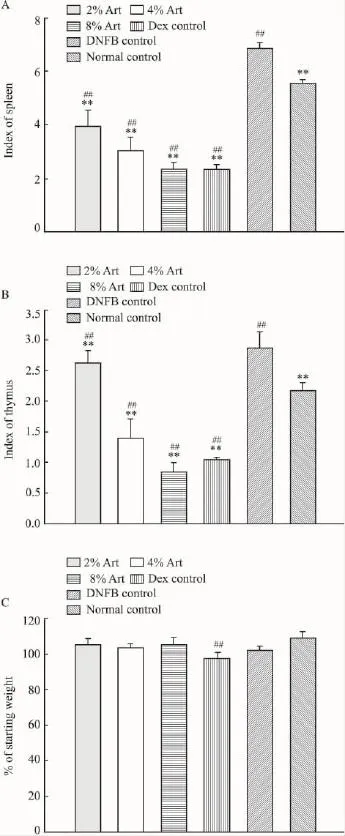
Fig 5 Effect of artemisinin on body weight and immune organ index
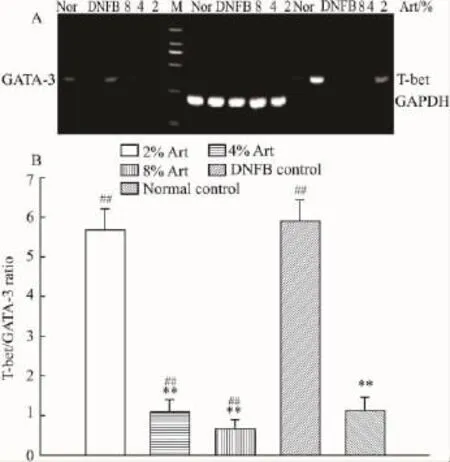
Fig 6 Effect of artemisinin on the T-bet and GATA-3 expression
2.6Art上调TGF-β1与对照组相比,Art能够剂量依赖的增加DTH小鼠耳组织TGF-β1含量,提示通过调节TGF-β1水平发挥免疫抑制效应是其作用机制之一(Fig 7)。
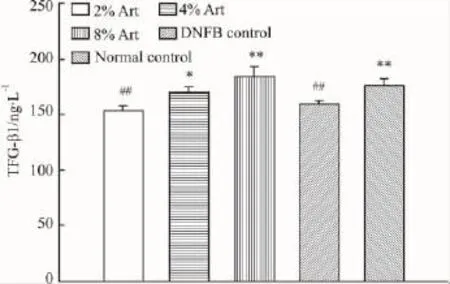
Fig 7 Effect of artemisinin on the production of TFG-β1
2.7Art抑制Phospho-p38 MAPK的活性表达水平Western blot结果显示(Fig 8),DTH模型组Phospho-p38 MAPK蛋白表达较正常组明显升高,Art干预组均能抑制p38 MAPK蛋白的磷酸化活性表达,同时非磷酸化p38 MAPK表达无明显变化。DTH小鼠耳部外用p-38MAPK选择性抑制剂SB203580后,耳肿胀明显抑制,与模型对照组相比差异具有显著性,而与Dex阳性对照组无差别,提示p38 MAPK通路或许是Art抑制DTH的的重要途径之一。
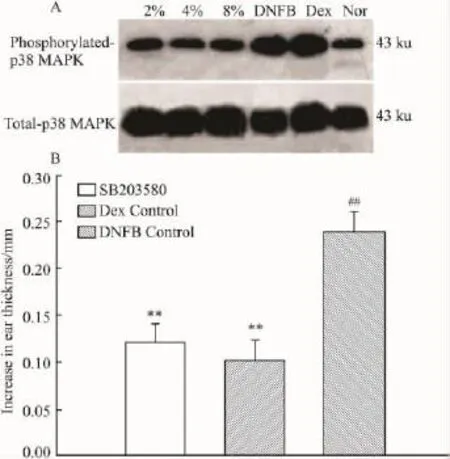
Fig 8 Inhibitory effect of artemisinin on phosphorylated-p38 MAPK expression
3 讨论
传统的免疫抑制剂如环磷酰胺、糖皮质激素等在器官移植和自身免疫性疾病等方面发挥着重要作用,但这些药物具有选择性不强,毒副作用大等缺点,限制了其在临床上的广泛应用。而中药免疫抑制剂具有药理作用广泛、毒副作用小、无依赖性等特点,故从天然药物中寻找提取高效低毒的免疫抑制剂已成为制药界的热点。Art是一种天然植物提取物,已被广泛用于治疗疟疾。此外,它还具有抗肿瘤、抗病毒、抗寄生虫等多方面的药理学作用[7]。近年来,国内外研究表明,Art及其衍生物对免疫系统有着较为复杂的影响,不同条件下能够表现出双向免疫调节作用。例如Yang等[8]报道,Art能增强正常小鼠T细胞介导的免疫应答,对免疫功能的重建具有一定作用;而中国科学院上海药物研究所的系列研究显示:蒿甲醚[9]等青蒿素类衍生物具有广泛的免疫抑制效应,包括抑制T细胞增殖分裂、阻止促炎因子及炎症介质的释放、抑制B细胞增殖和抗体分泌等。新近研究显示[10],Art的免疫抑制作用甚至强于环孢素A,可用于自身免疫性疾病的治疗,因此对该类药物的研究也越来越受到重视。
本研究首先通过体外细胞培养证明,Art对ConA诱导的小鼠T细胞增殖具有明显的抑制作用,高剂量时其抑制效应甚至高于Dex,而且毒性更低。体内研究采用的动物接触性超敏反应为皮肤接触致敏原引起的一种特殊DTH,大多在致敏原激发后24~48 h到达高峰,是由特异性致敏T淋巴细胞介导的细胞免疫反应[11]。免疫器官(胸腺、脾)不仅是淋巴细胞分化成熟的场所,也是产生特异性免疫应答的场所,其重量降低或升高程度反映了机体的免疫功能状态。本研究结果表明,Art明显降低DTH模型小鼠免疫器官的脏器指数,减轻耳肿胀度,提示其通过下调机体细胞免疫应答发挥免疫抑制作用,而且较Dex显示出更为优越的安全性。
目前认为,Th1细胞是参与DTH的重要细胞之一,通过分泌干扰素-γ(IFN-γ)等细胞因子介导细胞免疫;Th2细胞则分泌白介素-4(IL-4)等细胞因子介导体液免疫。Th1和Th2互为抑制细胞,导致DTH中Th1/Th2免疫失衡。国内外已有大量研究通过细胞因子水平干预治疗来纠正Th1/Th2的免疫失衡,包括用Th2因子基因封闭和Th1因子基因转染,但疗效并不满意。T-bet为Th1细胞转录因子,是反映Th1释放细胞因子的特异性标志。GATA-3选择性表达于Th2细胞,是目前确定的唯一能调控Th2型细胞因子合成的特异性转录因子。研究表明,T-bet可以抑制GATA-3表达并诱导已分化成熟的 Th2 向 Th1 逆向转化[12-13],而 GATA-3 在促进Th2发育的同时也能抑制T-bet,因此,调控T-bet/GATA-3基因表达可以从Th1/Th2细胞分化的上游控制Th1/Th2平衡,克服单一细胞因子作用的片面性。本研究结果显示,Art不仅明显抑制T-bet基因表达,而且能够促进 GATA-3的表达,从而影响Th1/Th2细胞分化。
TGF-β是细胞生长、分化的重要调控因子,可由活化的 T细胞产生,有 β1、β2、β3三种亚型,其中TGF-β1所占比例最高(>90%),活性最强,能抑制淋巴细胞增生及转化,诱导免疫活性细胞凋亡[14]。新近研究发现[15],体内存在一类具有免疫无能和免疫抑制两大特性的细胞,称为调节性T细胞(regulatory T cell,Treg),其中诱导性Treg中的Th3细胞主要通过产生TGF-β抑制Th1和Th2细胞增殖和功能,从而发挥免疫抑制作用。本研究发现,Art能够剂量依赖的促进 TGF-β1产生,提示其通过上调TGF-β1水平,抑制DTH小鼠的炎症反应,并且还能在抗过敏方面发挥重要作用。但Art对TGF-β的影响是否与其促进Th3有关尚需进一步研究阐明。
DNFB诱导的DTH是由T细胞介导的、在多种细胞因子参与下的皮肤炎症反应,而炎症过程中的信号转导系统及相互关系错综复杂,现已初步证明丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路在其中发挥着重要作用。哺乳动物细胞中MAPKs主要由3个成员构成,即细胞外信号调节激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38丝裂原活化蛋白激酶(p38 MAPK)。其中p38 MAPK作为信号转导通路的交汇点在炎症、肿瘤等多种疾病的发生发展中起着重要作用[16]。本研究显示,Art明显减弱p38 MAPK的磷酸化活性表达,其对DTH的抑制效应与p-38MAPK选择性抑制剂SB203580相近。需要指出的是,作为p38 MAPK信号途径中重要的上游介质,TGF-β1亦可通过MKK介导激活p38 MAPK,继而通过对下游多种靶基因的转录调控,参与细胞凋亡、转分化等过程。因此,Art对TGF-β1与p38 MAPK之间的这种双向调控作用的具体机制还需进一步研究阐明。
总之,本研究中,Art能够明显抑制ConA诱导的T细胞增殖及DTH反应;影响Th1/Th2免疫失衡,促使Th1型免疫应答向Th2型转变;促进抑制性因子TGF-β1产生以及下调p38 MAPK信号。因此,通过对其独特的作用机制进行更深入的研究,将有利于青蒿素类药物更广泛的用于临床,并为将其开发成新型免疫抑制药物提供实验依据。
[1]国家药典委员会编.中国药典.一部[S].2005:113.
[1]State Pharmacopoeia Committee.Chinese Pharmacopoeia[S].2005:113.
[2]Gavigan C S,Shen M,Machado S G,et al.Influence of the Plasmodium falciparum P-glycoprotein homologue 1(pfmdr1 gene product)on the antimalarial action of cyclosporin[J].J Antimicrob Chemother,2007,59(2):197 -203.
[3]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55 -63.
[4]Takeshita K,Yamasaki T,Akira S,et al.Essential role of MHCⅡ-independent CD4+T cells,IL-4 and STAT6 in contact hypersensitivity induced by fluorescein isothiocyanate in the mouse[J].Int Immunol,2004,16(5):685 -95.
[5]Bowen H,Kelly A,Lee T,et al.Control of cytokine gene transcription in Th1 and Th2 cells[J].Clin Exp Allergy,2008,38(9):1422-31.
[6]Jenner R G,Townsend M J,Jackson I,et al.The transcription factors T-bet and GATA-3 control alternative pathways of T-cell differentiation through a shared set of target genes[J].Proc Natl Acad Sci USA,2009,106(42):17876-81.
[7]陆金健.青蒿素类化合物抗肿瘤研究进展[J].中国药理学通报,2010,26(6):818-20.
[7]Lu J J.Progress in the research on the anti2cancer activ ity of artem isin in compounds[J].Chin Pharmacol Bull,2010,26(6):818-20.
[8]Yang S X,Xie S S,Gao H L,et al.Artemisinin and its derivatives enhance T lymphocyte-mediated immune responses in normal mice and accelerate immunoreconstitution of mice with syngeneic bone marrow transplantation[J].Clin Immunol Immunopathol,1993,69(2):143 -8.
[9]Wang J X,Tang W,Shi L P,et al.Investigation of the immunosuppressive activity of artemether on T-cell activation and proliferation[J].Br J Pharmacol,2007,150(5):652 -61.
[10]Lopez P,Gomez J,Mozo L,et al.Cytokine polymorphism influence treatment outcomes in SLE patients treated with antimalarial drugs[J].Arthritis Res Ther,2006,8(2):R42.
[11]郑咏秋,魏伟,戴 敏,等.木瓜总苷抑制小鼠接触性超敏反应及对其胸腺T淋巴细胞亚型的调节作用[J].中国药理学通报,2004,20(9):1016-20.
[11]Zheng Y Q,Wei W,Dai M,et al.Glucosides of chaenomeles speciosasuppressed contact hypersensitivity response via modulating the thymus T lymphocytes subsets in mice[J].Chin Pharmacol Bull,2004,20(9):1016 -20.
[12]Kanai T,Shiraishi H,Yamagata T,et al.Th2 cells predominate in idiopathic steroid-sensitive nephrotic syndrome[J].Clin Exp Nephrol,2010,14(6):578 -83.
[13]Hwang E S,Szabo S J,Schwartzberg P L,et al.T helper cell fate specified by kinase mediated interaction of T-bet with GATA-3[J].Science,2005,307(5708):430 -3.
[14]Lasfar A,Cohen-Solal K A.Resistance to transforming growth factor β-mediated tumor suppression in melanoma:are multiple mechanisms in place[J]?.Carcinogenesis,2010,31(10):1710-7.
[15]Carrier Y,Yuan J,Kuchroo V K,et al.Th3 cells in peripheral tolerance.II.TGF-beta-transgenic Th3 cells rescue IL-2-deficient mice from autoimmunity[J].J Immunol,2007,178(1):172 -8.
[16]Cuadrado A,Nebreda A R.Mechanisms and functions of p38 MAPK signalling[J].Biochem J,2010,429(3):403 - 17.
——青蒿素

