饲用酶与芽孢杆菌协同作用发酵豆粕的相关研究
常 磊 刘永萍 徐聪聪 陈洁梅
豆粕是大豆经提油后得到的副产品,其蛋白质含量高、氨基酸组成平衡,是动物饲养中常用的一种优质植物性蛋白原料,具有很大的利用价值 (赵韦璇,2006;Adetayo,2005)。但动物对大分子豆粕蛋白的吸收明显没有对小分子多肽和氨基酸的吸收好 (陈培赛,2008),同时豆粕中存在有多种抗营养因子(ANFs),如脲酶、胰蛋白酶抑制剂、植酸、凝集素、脂肪氧化酶和大豆抗原蛋白等,也影响了营养成分的消化、吸收和代谢,对动物体的健康和生产性能产生不良影响,从而制约了豆粕在畜禽饲养中更有效的应用 (张明峰等,1999;何玉华等,2009)。
一般认为,豆粕发酵主要是利用微生物的作用降解豆粕中的大分子蛋白质以及抗营养因子等,或者是直接利用外源蛋白酶的作用将豆粕进行酶解,从而达到发酵的目的。近年也有少量关于利用微生物和酶的协同作用混合处理豆粕的相关报道(方乐等,2011)。
本研究主要通过比较利用饲用复合酶酶解豆粕、芽孢杆菌发酵豆粕和复合酶加芽孢杆菌协同作用发酵豆粕的结果,得到最佳的发酵工艺条件,以提高豆粕的利用率与营养价值,缩短发酵周期,降低生产成本,为实际生产提供参考。
1 材料与方法
1.1 试验材料
豆粕:经粉碎机粉碎,由肇庆市益信农业发展有限公司提供。
饲用复合酶(发酵豆粕用):宁夏夏盛实业集团有限公司产品,其中蛋白酶活力为100000 U/g。
营养琼脂斜面培养基:牛肉膏3 g/l、蛋白胨10 g/l、琼脂粉 20 g/l、NaCl 5 g/l,pH 值(7.4±0.2);
液体种子培养基:牛肉膏3 g/l、NaCl 5 g/l、蛋白胨10 g/l,pH 值(7.3±0.2);
发酵培养基:发酵基质为豆粕,加适量水混匀后装于500 ml锥形瓶中,加水量根据具体试验设计而定。
菌种:1号菌(SN-2-1-D)和 3号菌(ND-1-2-D),均为芽孢杆菌,暨南大学生物工程学系微生物学实验室保藏菌株。
1.2 方法
1.2.1 液体种子的制备
从活化的营养琼脂斜面刮取2环菌苔到液体种子培养基,于180 r/min、35℃摇床培养24 h备用。1.2.2 酶解发酵工艺单因素试验
1.2.2.1 料水比对酶解豆粕酸溶性蛋白含量的影响
在500 ml锥形瓶中装入100 g豆粕,加入不同量的自来水混匀,使料水比分别为1:0.3、1: 0.4、1:0.5、1: 0.6、1: 0.7、1: 0.8,121 ℃、0.1 MPa条件下灭菌 20 min。加酶量为豆粕量的0.10%,37℃恒温培养箱保温酶解24 h,取样后于60℃烘箱内烘干并粉碎,测定酸溶性蛋白含量。
1.2.2.2 加酶量对酶解豆粕酸溶性蛋白含量的影响
在500 ml锥形瓶中装入100 g豆粕,加水混匀使料水比为1: 0.6,121℃、0.1 MPa条件下灭菌20 min,冷却后加入饲用复合酶混匀,加酶量分别为0.05%、0.10%、0.15%、0.20%、0.30%,37℃恒温培养箱保温酶解24 h,取样后于60℃烘箱内烘干并粉碎,测定酸溶性蛋白含量。
1.2.2.3 初始酶解温度对酶解豆粕酸溶性蛋白含量的影响
在500 ml锥形瓶中装入100 g豆粕,加水混匀使料水比为1: 0.6,121℃、0.1 MPa条件下灭菌20 min,加酶量为 0.10%,分别在 20、25、30、35、40 ℃的恒温培养箱中保温酶解24 h,取样后于60℃烘箱内烘干并粉碎,测定酸溶性蛋白含量。
1.2.3 酶解发酵工艺正交试验
在单因素试验的基础上,设计3因素(料水比、加酶量、作用温度)、3水平L9(33)的正交试验进行酶解条件优化。
1.2.4 酶解时间对豆粕酸溶性蛋白含量的影响
为了更好地研究酶解过程中豆粕酸溶性蛋白含量随时间的变化情况,同时也为了减少试验次数,保证试验精确度,因此,本研究将时间因素进行了单独分析,即在正交试验确立的酶解方案基础上进行独立的酶解时间分析,并分别于 4、8、12、20、24、36、48、60 h 时取样,于60℃烘箱内烘干并粉碎,测定酸溶性蛋白含量。
1.2.5 芽孢杆菌发酵对豆粕酸溶性蛋白含量的影响
基于工厂化大池发酵试验方面的研究,以及实际生产过程中的成本问题,本研究在参考课题组之前已确立菌种发酵条件(陈洁梅,2011)的基础上做了如下试验设计:料水比1:0.7,接种量1%(0.5%1号菌+0.5%3号菌),初始发酵温度35℃,并以此进行发酵试验研究。考虑到菌种要有一段时间先大量繁殖,故分别于 20、24、36、48、60 h取样,取样后于 60 ℃烘箱内烘干并粉碎,测定酸溶性蛋白含量。
1.2.6 饲用复合酶和芽孢杆菌混合发酵试验
根据前面所确立的最佳发酵条件,进行复合酶加芽孢杆菌的混合发酵试验,即:料水比为1:0.7,培养基在121℃、0.1 MPa条件下灭菌20 min。加酶量为0.05%,接种量为1%,初始发酵温度为35℃,分别于12、20、24、36、48、60 h 取样,取样后于 60 ℃烘箱内烘干并粉碎,测定酸溶性蛋白含量。
1.2.7 酸溶性蛋白含量的测定
根据NY/T1205—2006中的方法提取豆粕水溶性蛋白。取10 ml水溶性蛋白提取液加入10 ml 15%的三氯乙酸(TCA)溶液,振荡片刻后静置10 min,4000 r/min离心5 min,上清液即为酸溶性蛋白提取液。酸溶性蛋白含量的测定采用凯氏定氮法,参照GB/T5009.5—2003。
1.2.8 聚丙烯酰胺变性凝胶电泳(SDS-PAGE)分析
称取1.2.4中收集的样品各1.00 g,加入0.03 mol/l Tris-HCl(pH值=8.8)缓冲液20 ml,150 r/min摇床浸提0.5 h,调节pH值8.2以上,继续于摇床上浸提1 h,后用4000 r/min离心机离心5 min,电泳时取适量上清液与等体积的样品缓冲液混合,并煮沸10 min使蛋白质变性,配置5%的浓缩胶和12%的分离胶,按条件进行SDS-PAGE电泳分析(欧阳亮等,2008;严鹤松,2009)。
同时从实际生产条件出发,为了能够更加明确直观地反映豆粕在未灭菌条件下的发酵情况,本研究将豆粕在未灭菌条件下分别进行加酶、接菌以及酶加菌处理,并取48 h后的样品做SDS-PAGE电泳分析,与未发酵豆粕比较,分析大分子蛋白质的降解情况。
1.2.9 样品中总酸含量的测定
测定参照陈洁梅等(2011)的方法,总酸含量以乳酸含量表示。
1.2.10 抗营养因子含量的测定
脲酶活性的测定:参照GB/T8622—2006。
凝集素效价的测定:参照戴大章(2005)以及孙册等(1986)的方法测定。
植酸含量的测定:参照傅启高等(1997)的方法测定。
脂肪氧化酶含量的测定:参照张小侠等(1997)的方法测定。
2 结果与分析
2.1 酶解发酵工艺单因素试验
2.1.1 料水比对酶解豆粕酸溶性蛋白含量的影响(见图1)
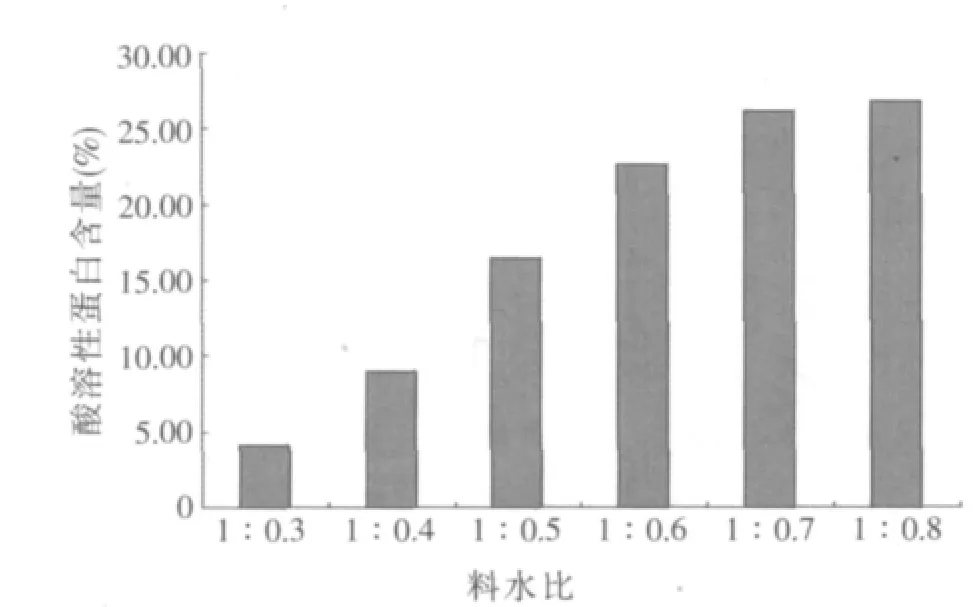
图1 不同料水比对豆粕酸溶性蛋白含量的影响
图1结果表明,随着料水比的增加,样品中酸溶性蛋白含量呈逐渐增大的趋势,并在料水比达到1:0.7后开始变缓。根据需要,本研究选择料水比1:0.5、1:0.6和1:0.7作为多因素正交试验料水比因素的3个水平。
2.1.2 加酶量对酶解豆粕酸溶性蛋白含量的影响(见图2)

图2 不同加酶量对豆粕酸溶性蛋白含量的影响
图2结果表明,当酶添加量<0.10%时,加酶量对酸溶性蛋白含量的升高影响较大;当酶添加量>0.10%时,增加酶的添加量对酸溶性蛋白含量的升高影响不大,这说明酶的添加量有一个逐渐饱和的趋势。同时也根据实际生产的需要,尽可能降低酶的用量,降低生产成本,所以,选择加酶量0.05%、0.10%和0.15%作为多因素正交试验加酶量因素的3个水平。
2.1.3 初始酶解温度对酶解豆粕酸溶性蛋白含量的影响(见图3)

图3 不同初始酶解温度对豆粕酸溶性蛋白含量的影响
图3结果表明,随着初始酶解温度的升高,样品中酸溶性蛋白含量呈逐渐增大的趋势,至30℃后基本维持不变,所以,本研究选择初始酶解温度30、35和40℃作为多因素正交试验初始酶解温度因素的3个水平。
2.2 酶解发酵工艺正交试验
2.2.1 正交试验直观结果分析
根据单因素试验的结果,设计3因素(料水比、加酶量、作用温度)3水平L9(33)的正交试验进行酶解条件优化。正交试验因素水平表如表1所示,实施方案和结果见表2。
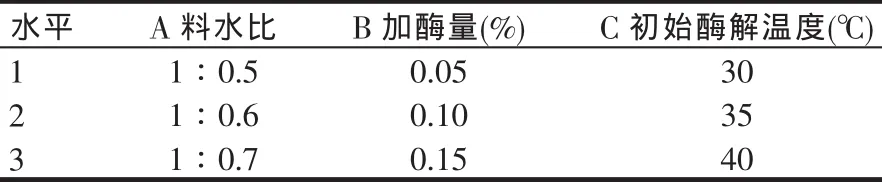
表1 正交试验因素水平
从表2可以直观地看出,料水比和初始酶解温度的极差最大,料水比和初始酶解温度对发酵样品中酸溶性蛋白含量影响最大。理论最佳酶解发酵方案为A3B2C3,即料水比为1:0.7、加酶量为0.10%、初始酶解温度为40℃。
2.2.2 正交试验方差分析
正交试验方差分析的结果见表3。从表3可以看出,上述3个因素中,料水比和初始酶解温度对酶解豆粕中酸溶性蛋白含量的影响极显著,加酶量影响不显著。

表2 正交试验实施方案和结果

表3 正交试验方差分析
2.2.3 酶解条件的确定
根据正交试验所确立的理论最佳酶解方案为A3B2C3,即料水比为 1:0.7、加酶量为0.10%、初始酶解温度为40℃。考虑到实际生产中要最大限度的降低生产成本,同时结合表3所示的结果,加酶量对酶解豆粕中酸溶性蛋白含量的影响并不显著,所以,综合考虑,本研究选择最少加酶量作为最终的酶解方案,即料水比为1:0.7、加酶量为0.05%、初始酶解温度为40℃。
2.3 加酶、加菌、酶菌协同作用处理豆粕后样品中酸溶性蛋白含量的比较
在只加复合酶作用的情况下,酶解时间对豆粕酸溶性蛋白含量影响的结果如图4中曲线①所示。结果表明,从8~24 h样品中的酸溶性蛋白含量急剧增加,这是由于酶的作用快速高效,能够很快地利用底物进行酶解,而随着酶解时间的延长,其酸溶性蛋白含量呈现持续增高的趋势,但增速明显降低。
芽孢杆菌发酵对豆粕酸溶性蛋白含量影响的结果如图4中曲线②所示。结果表明,36 h后菌种代谢活动旺盛,开始大量利用底物,样品中酸溶性蛋白含量开始快速增加,随着发酵时间的延长酸溶性蛋白含量持续增加。
复合酶加芽孢杆菌混合发酵对豆粕酸溶性蛋白含量影响的结果如图4中曲线③所示。结果表明,12~36 h之间,样品中酸溶性蛋白含量急剧增加,之后增速变缓,48 h时达到最大值。
图4的结果表明,利用酶加菌的协同作用处理豆粕,效果优于单独加酶和单独加菌的情况,在发酵48 h时酸溶性蛋白含量达到最高,为24.55%,这在实际生产过程中具有较好的指导意义。
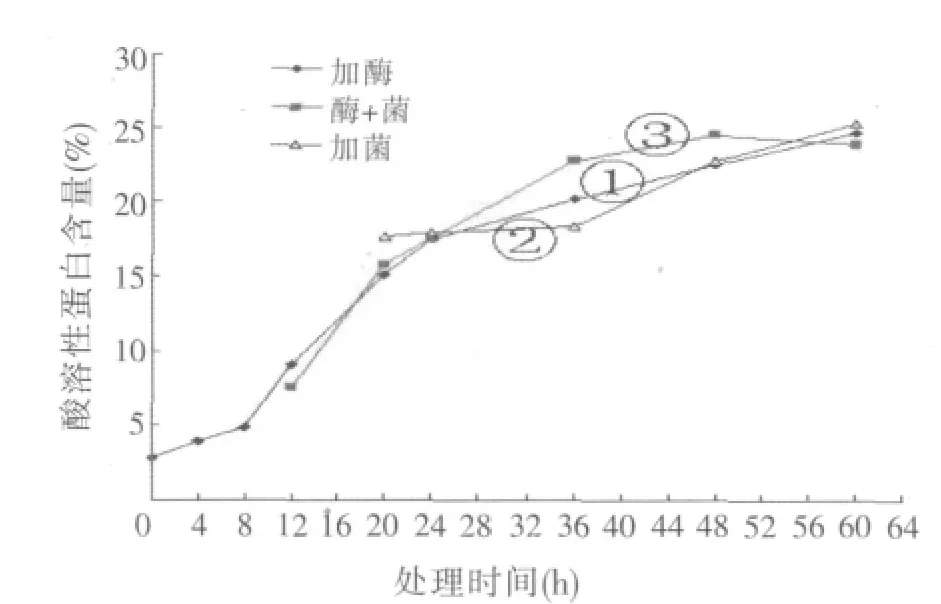
图4 不同处理豆粕酸溶性蛋白含量随时间变化趋势
2.4 聚丙烯酰胺变性凝胶电泳(SDS-PAGE)
酶解样品大分子蛋白降解后的分子量变化情况如图5 SDS-PAGE电泳图谱所示。从图5可以看出,样品经灭菌处理后酶解4~12 h,40 kD以上的蛋白质基本上被降解。随着酶解时间的逐渐延长,大分子蛋白质进一步被降解,36 h后基本上都被降解成分子量为20 kD或以下的小分子。

图5 不同酶解时间豆粕中大分子蛋白质的降解情况
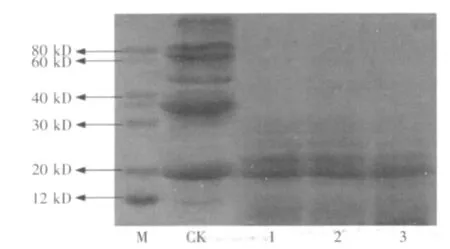
图6 未灭菌条件下豆粕中大分子蛋白质降解情况
图6为基质在未灭菌条件下,加酶、加菌、酶加菌处理48 h后样品中蛋白质分子量的变化情况。结果表明,3种处理均能够较好降解豆粕中的大分子蛋白质,基本达到灭菌条件下(图5)蛋白质降解的水平,特别是酶加菌处理(图6中的3)与灭菌酶解处理相同时间(图5中的7)的电泳条带相似,蛋白质降解后分子量基本在20 kD或以下,说明复合酶和芽孢杆菌协同作用处理豆粕有利于抵抗基质未灭菌状态下杂菌的影响,提高了发酵豆粕的品质。
2.5 发酵豆粕中总酸含量的比较
不同处理的发酵豆粕的总酸含量(以乳酸含量计)见表4。结果表明:基质在灭菌和未灭菌状态,3种不同处理均能够提高其总酸含量,其中基质在未灭菌状态下酶加菌以及加菌处理后所测得的总酸含量比在灭菌状态下高,推测是杂菌的作用使生成了更多的有机酸。其中酶加菌协同处理(未灭菌状态)乳酸含量由1.26%提高到4.70%,提高了2.7倍。

表4 不同处理的发酵豆粕中乳酸含量
豆粕经过复合酶和芽孢杆菌的发酵处理以后,可以产生大量的有机酸和芽孢杆菌活菌体,能很好地改善动物消化道的微生态环境,从而提高动物的免疫力,减少肠道病害的发生,在乳猪饲料中使用时,可以大大降低仔猪消化道疾病的发病率,起到预防仔猪下痢的效果(俞晓辉,2008)。
2.6 发酵样品中抗营养因子含量的测定
处理前后豆粕中抗营养因子含量变化如表5所示。结果表明,在灭菌和未灭菌状态下,经过3种不同的处理方式,豆粕中的各种抗营养因子均能够被降解,其中在未灭菌状态下利用酶加菌处理豆粕,各抗营养因子的降解水平均能达到较好效果,符合实际生产时的需要。
由于豆粕中的胰蛋白酶抑制因子含量与其中的脲酶含量呈正相关关系,通过测定脲酶活性就可间接地知道该豆粕中胰蛋白酶抑制因子含量的高低,所以本研究将豆粕中的脲酶活性作为检测胰蛋白酶抑制因子的间接衡量指标。
3 讨论
酸溶性蛋白指能溶于15%三氯乙酸的分子量较小的多肽或小肽,也包括了游离的氨基酸,易于被动物肠道吸收和消化利用,所以通过检测处理后样品中的酸溶性蛋白含量,可以反映出豆粕蛋白质被降解的情况,它是豆粕发酵过程中的一个重要参数。
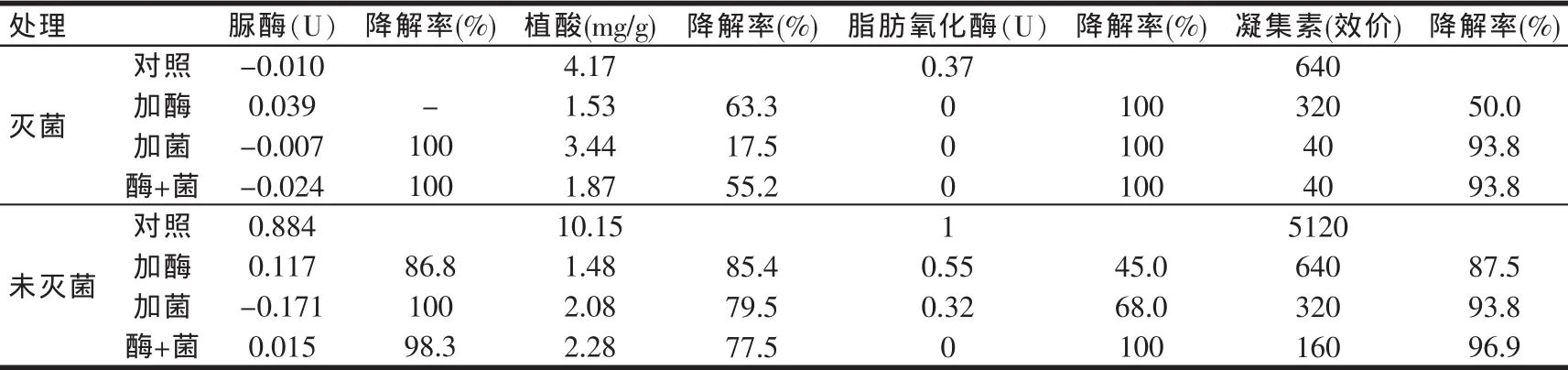
表5 处理前后豆粕中抗营养因子含量的变化
本研究利用芽孢杆菌和复合酶混合发酵豆粕,既能缩短发酵周期,又能利用芽孢杆菌抵抗其他杂菌的影响,提高效率,降低生产成本,还能通过产品中含有的大量的芽孢杆菌活菌体改变动物肠道内的微生态环境,增强饲养动物对疾病的抵抗能力,减少抗生素的使用。
4 结论
以豆粕为原料进行加酶、加菌、酶加菌协同处理试验,通过发酵条件的优化及对比,在菌液接种量1%(0.5%1号菌+0.5%3号菌)、加酶量0.05%(蛋白酶活性50 U/g),料水比1:0.7,初始发酵温度40℃,发酵时间48 h的条件下,酸溶性蛋白含量从2.74%提高到24.55%,豆粕中大分子蛋白质基本降解为分子量20 kD或以下的小分子物质,总酸含量(以乳酸计)从1.26%提高到4.70%,主要抗营养因子大部分被降解,其各项指标均达到了发酵豆粕行业的评判标准(葛向阳,2010),这对实际生产具有重要的参考价值。
15篇,刊略,需者可函索)

