乳腺原发性淋巴瘤诊断及鉴别诊断(附病例报告)
姜 波,刘全新,盛 莹,高爱民,田 密
原发性乳腺淋巴瘤(primary breast lymphoma,PBL)为临床少见疾病,由于临床表现及相关检查缺乏特异性,极易出现误诊或漏诊。现总结1例误诊的PBL,通过系统的临床病理分析及相关鉴别诊断,以期提高诊断经验。
1 病例报告
1.1 一般资料 患者,女,50岁。自诉1年前无意中发现右乳腺内侧有一枣核大小的肿块,后在当地县医院就诊,县医院B超示病灶位于右乳头水平偏内侧,内见不规则回声结节,大小范围约 1.2 cm×1.0 cm×1.0 cm,诊为“右乳腺增生”。门诊体检示肿块质略硬,略有活动,无触痛,乳头无内陷,皮肤缘光整无增厚。病理穿刺检查报告:“右乳腺小叶增生,有较多淋巴细胞,考虑乳腺慢性炎症”。后按乳腺炎及乳腺增生治疗,未手术切除。初诊2个月后,肿块逐渐增大,其内可扪及多个结节,乳腺表面皮肤红肿,有点灶状破溃,表面有红黄色分泌物,触痛明显。由于患者家境贫困,未到县医院就诊,于当地乡卫生院按化脓性乳腺炎继续治疗,经用“抗生素”治疗及中草药贴敷,略有好转。但数月后,肿块生长加快,皮肤出现较大溃烂,乳腺疼痛加剧,后转入笔者所在医院就诊。体检:右乳腺较对侧明显增大,乳腺内侧表面可见7 cm×6.5 cm×4.5 cm大小的结节状肿物(图1),表面溃烂并形成溃疡,有大量黄白渗出物,有明显触痛。乳头无凹陷,皮肤无橘皮样改变,肿物周围皮肤红肿明显。全身浅表淋巴结、肝、脾未见肿大。行胸部CT检查示:“右侧乳腺体积增大,其内可见8.5 cm×7 cm×5 cm大小的等密度结节,增强呈中等不均匀强化。双腋窝可见肿大淋巴结;胸腹部及盆腔未见异常”。病理细胞学诊断:“右乳腺小细胞性肿瘤,背景可见大量淋巴样细胞,部分淋巴样细胞有明显核异型,不排除恶性淋巴瘤”。后行右乳腺改良根治手术。
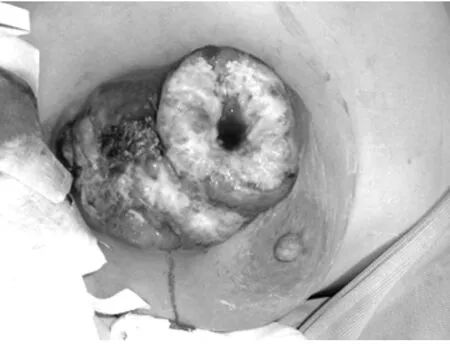
图1 结节性肿块,表面溃烂形成溃疡,有明显渗出
1.2 病理检查方法 病理诊断依据WHO(2001)淋巴瘤的诊断标准。标本经常规10%中性甲醛固定,常规脱水,石蜡包埋,连续石蜡切片3 μm,分别做HE染色及免疫组化染色。免疫组化采用EnVision二步法。所有适用抗体均为鼠抗,包括:CK、EMA、LCA、CD20、CD79a、CD3、CD45RO、CD30、CD15、Bcl-2、CD68、TIA-1、Pax-5、Ki-67、ER、PR、CerbB-2,方法 SP法。所用抗体、第二抗体及DAB显色液均为即用型,均购自美国Dako公司。
1.3 病理检查结果 ①巨检:肿瘤位于右乳腺内上象限,体积约8 cm×6.9 cm×5.5 cm大小,呈结节状,与周围乳腺组织边界不清,无包膜,切面灰白色,质均匀细腻,鱼肉样,部分区域伴有出血,表面有渗出;另见腋窝淋巴结黄豆、绿豆大小10枚,切面灰白色,质软,被膜完整;②镜检:肿瘤细胞呈圆形、卵圆形,核形不规则,形态类似淋巴单核细胞,但体积约为正常淋巴细胞1~2倍,核膜较厚,染色质粗糙,呈颗粒状,可见明显核仁,病理性核分裂象易见(1~2个/高倍视野);肿瘤细胞呈弥漫性分布,无积聚成团成巢,并成片浸润或包裹乳腺小叶及导管上皮,甚至浸润至周围纤维脂肪组织内(图2),部分区域乳腺小叶和导管上皮消失或残存不全,有的肿瘤细胞围绕残存的乳腺导管排列形成同心圆靶状;有的肿瘤细胞沿纤维条索呈单行排列,与浸润性小叶癌相似。
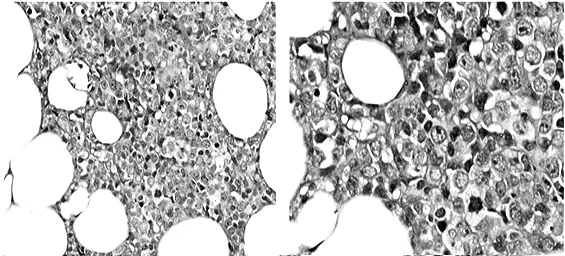
图2 乳腺大B细胞性淋巴瘤(普通型200×)
1.4 免疫组化表型 肿瘤细胞表达 LCA、CD20、CD79a、Pax-5,Ki-67 增生指数>80%表达 (见图3);CK、EMA、CD3、CD45RO、CD30、CD15、CD68、Bcl-2、TIA-1、ER、PR、CerbB-2均表达阴性。

图3 免疫组化表型
1.5 病理诊断 右乳腺非霍奇金淋巴瘤,免疫组化表型支持弥漫大B细胞淋巴瘤(DLBL),普通型。
2 讨 论
乳腺原发性淋巴瘤(PBL),临床比较少见。笔者所在医院自2001~2009年,共诊断乳腺恶性肿瘤1424例,其中3例乳腺原发性淋巴瘤,占乳腺恶性肿瘤的0.21%,3例均为非霍奇金淋巴瘤(NHL)。文献报道,PBL占乳腺所有恶性肿瘤的0.04%~0.53%[1],占所有结外淋巴瘤的 1.7%~2.2%[2]。
Wiseman等[3]首先提出原发性乳腺NHL的4项诊断依据:①病检材料必须严格符合技术要求;②淋巴瘤必须与乳腺组织紧密相连;③以往无乳腺外淋巴瘤和白血病存在病史证据;④乳腺作为临床首发部位。本例符合以上标准。大多数乳腺原发淋巴瘤为B细胞来源的非霍奇金淋巴瘤,主要为弥漫大B细胞淋巴瘤和黏膜相关淋巴组织型边缘区B细胞淋巴瘤两种类型,罕见霍奇金淋巴瘤(HL)。而本例为弥漫大B细胞淋巴瘤。该瘤一般好发于右侧,大约有10%~25%的患者双侧乳腺同时受累及,即使双侧受累其首发病变亦多位于右侧[4]。患者主要为女性,偶见男性。发病年龄为15~88岁,中位年龄为58.5~69岁[4]。临床表现相对其它乳腺恶性肿瘤没有特征性,常见的症状为该瘤生长迅速,病期较短,体积较小时无疼痛,肿块境界较清,活动好,多为孤立性,但也可为多灶状或弥漫浸润状,与胸肌及皮肤无粘连,无橘皮样外观,无乳头溢液。本例亦与之相符。肿物较大时,皮肤菲薄并破溃,血管显露,皮温较高。
乳腺恶性淋巴瘤由于是一种临床少见病,易误诊为乳腺癌、乳腺炎症、乳腺增生,纤维腺瘤等,本例即在当地县医院误诊为乳腺增生和乳腺炎。其主要误诊原因有:①肿瘤早期病变时,临床表现不典型,影像学及临床表现均不能明确确定为乳腺肿瘤;②尤为重要的是,病理穿刺细胞学由于标本获取量的有限,对于淋巴瘤的诊断有明显的局限性,并且早期淋巴瘤,由于增生的异型淋巴细胞存在着分布少,与正常淋巴细胞相比异型性不明显的特点,因此通过穿刺细胞学很难做出明确的诊断,从而误诊和漏诊;③进展期时,由于临床表现出皮肤破溃,并可见“脓样”分泌物,基层医院对肿瘤认识的不足,导致进一步的误诊。
由于乳腺淋巴瘤的临床表现缺乏特征性,早期因其与乳腺良性肿瘤临床表现相似,乳腺X线摄影、B超、近红外线乳腺扫描检查也无特征性影像,尤其是在临床普遍开展的乳腺肿瘤穿刺术及其病理细胞学诊断,由于其自身存在的局限性,如存在所取细胞量少,涂片内无法显示组织学结构,穿刺方式为盲穿而导致穿刺不到位等问题。当遇到其他类似病变,有相同或类似的病变成分时,极易引起误诊和漏诊,故术前想明确诊断相当困难。Jeon等[5]复习了152例原发性乳腺淋巴瘤,无一例在术前作出正确的诊断。因此乳腺淋巴瘤的确诊必须依靠病理组织学切片及相关免疫组化标记。
在病理组织学上乳腺淋巴瘤以异型淋巴细胞弥漫性分布、包绕和浸润乳腺导管和小叶为重要的诊断依据,但其诊断还应与乳腺的淋巴组织反应性增生(假淋巴瘤)、硬化性淋巴细胞性小叶炎、浸润性小叶癌以及髓样癌相鉴别。这些肿瘤与乳腺淋巴瘤在组织结构与细胞形态上都有很多相似之处,需要合理利用免疫组化为其鉴别诊断提供帮助。①淋巴细胞反应性增生 (假性淋巴瘤 Pseudolymphoma of breast,PLB):病变可见多种淋巴细胞浸润,但以成熟的小淋巴细胞为主,并具有明确的生发中心,增生的淋巴细胞没有沿小叶分布的特点,小叶和导管上皮可以出现萎缩,但不会消失,周围也可见到少许浆细胞、组织细胞、嗜中性粒细胞以及嗜酸性 粒 细 胞 分 布 ; 免 疫 组 化 表达 :LCA、CD20、CD79a、CD3、CD45RO、CD15、CD68均有不同数量的细胞表达,Bcl-2表达生发中心以外的淋巴细胞,而Ki-67对于生发中心以外的细胞表达则很少(1%~5%左右);②硬化性淋巴细胞性小叶炎(sclerosing lymphocytic lobulitis,SLL):该病其病变特征类似于桥本甲状腺炎,通常多发于青中年妇女[6],通常表现为乳腺小叶之间有大量成熟的淋巴细胞和浆细胞浸润,小叶萎缩消失,部分仅见残存小管,导管周围和血管周围也可见淋巴细胞浸润,间质明显纤维化及透明变性;部分患者还伴发1型糖尿病、多关节炎等疾病,提示SLL与自身免疫有关;免疫组化表达:LCA、CD20、CD79a、CD3、CD45RO、CD15、CD68 均有不同数量的细胞表达,且分布不均,提示T、B淋巴细胞无分布上的特殊,Ki-67<1%表达;③浸润性小叶癌(invasive lobular carcinoma,ILC):是一种临床常见的浸润性乳腺癌,其癌细胞体积较小,形态较一致,其重要的病理组织学特征是该肿瘤细胞常呈由单个细胞排列呈条索状或线状,形成特征性的“列兵样“结构,有时癌细胞也可围绕导管或小叶形成同心圆结构,当乳腺NHL的瘤细胞围绕小叶或导管浸润,并侵犯硬化的间质,呈单行,靶样或腺泡样排列,其形态特点确实与浸润性小叶癌极为相似;免疫组化表达:癌细胞通常均表达 CK、EMA,而不表达 LCA、CD20、CD79a、CD3、CD45RO 等淋巴细胞相关抗体,大多数癌细胞表达ER、PR及CerbB-2。④伴淋巴细胞浸润性髓样癌 (medullary cancinoma with lymphoid):是乳腺癌一种特殊类型,因其癌细胞成分多、间质少,因而质地软,犹如脑髓,故称髓样癌,也称之为软癌,髓样癌瘤细胞异型性明显,可呈多边形、梭性,并可出现奇异形的巨细胞等,这些癌细胞常聚在一起,胞浆界限不清,呈合胞体状,尤其在其癌巢周围的纤维间质内以及肿瘤边缘的纤维组织内,常常可见大量淋巴细胞及浆细胞浸润。有时,淋巴细胞、浆细胞浸润非常密集,被包围的癌巢尤如位于淋巴细胞内,与淋巴结转移癌相似。因此在病理诊断中,尤其是病理穿刺细胞诊断中,极易误诊为大细胞性淋巴瘤;免疫组化表达:癌细胞通常均表达CK、EMA,而不表达LCA、CD20、CD79a、CD3、CD45RO等淋巴细胞相关抗体。
综上所述,临床医师和病理医师在临床诊疗过程中,当遇到类似肿瘤和病变时,就是要综合的考虑到以上各种因素,充分利用免疫组化在鉴别诊断上的优势,并结合临床资料再下结论,以免造成误诊,贻误治疗。
[1]Lamovec J,Jancer J.Primary malignant lymphoma of the breast:lymphoma of the mucosa-associated lymphoid tissue[J].Cancer,1987,60:3033.
[2]Aozasa K,Ohsawa M,Saeki K.Malignant lymphoma of the breast:immunologic type and association with lymphocytic mastopathy[J].Am J Clinical Pathol,1992,97:699.
[3]Wiesman C,Liao KJ.Primary lymphoma of the breast[J].Cancer,1972,29:1705-1712.
[4]武忠弼,杨光华.中华外科病理学[M].北京:人民卫生出版社,2002.1685-1686.
[5]Jeon HJ,Akagi T,Hoshida Y,et al.Primary non-Hodgkim malignant lymphoma of the breast.An immunohistochemical study of seven patients and literature review of 152 patients with breast lymphoma in Japan[J].Cancer,1992,70:2451.
[6]何丽娟,叶明光,施 全.乳腺硬化性淋巴细胞性小叶炎1例[J].诊断病理学杂志,2000,7(3):213.

