食用菌提取液中氨基酸与金属离子锌配合工艺
陈 平,殷辉莉
(哈尔滨商业大学食品工程学院,哈尔滨 150076)
食用菌有较高的食用价值,例如香菇中含有各种人体必需的氨基酸.锌是动物体内许多酶的组成成分,参与了氨基酸、核酸、脂肪、碳水化合物及微量元素等营养元素的代谢[1].而复合氨基酸配合盐具有抵抗干扰,很容易被动物体消化吸收.在补充锌的同时又补充了动物体所需的氨基酸.
本文采用食用菌香菇等为原料经酸法提取得复合氨基酸与乙酸锌(Zn(CH3OO)2)在适当条件下进行配合反应制备复合氨基-锌(II)的配合,并对其最适反应条件及结构进行初步的研究.
1 材料与方法
1.1 材料与试剂
复合氨基酸,自制;蒸馏水,实验室自制;乙酸锌、盐酸、氢氧化钠、硫代硫酸钠、冰醋酸、乙酸钠、二硫腙、四氯化碳和百里香酚兰均为分析纯,天津市嘉兴化工有限公司.
1.2 仪器与设备
FA2004N电子天平,上海精密科学仪器有限公司;85-2控温磁力搅拌器,江苏金坛医疗仪器厂;LD4-2A低速离心机,上海科贺圣华科技有限公司;TU1901双光束紫外可见分光光度计,北京普析通用仪器有限公责任公司;722E分光光度计,上海光谱仪器有限公司;RE52-98旋转蒸发器,上海亚荣生化仪器厂;GZX-DH-30×35电热恒温箱,上海跃进医疗器械厂,Spectrum one红外分光光度计,PerkinElmer公司.
1.3 复合氨基酸的制备
经过研磨的食用菌粉取5 g用5 mol/L盐酸水解,料液比1∶30加热回流5 h,水解液趁热过滤,滤液经调酸度pH值为1.5后加活性碳,在80℃属于震荡30min脱色完全,并使用氨基酸交换树脂对提取液中复合氨基酸进行纯化,然后将纯化液加NaOH调酸度pH值为3.0,再加入丙酮,产生乳白色沉淀,经过离心烘干,制得混合氨基酸[2].
1.4 锌标准曲线的的绘制
采用GB/T 5009.14—1996食品中锌的测定方法中的二硫腙比色法.
锌标准溶液:准确称取0.1000 g锌,加10mL盐酸(2 mol/L),溶解后移入1000mL容量瓶中,加水稀释至刻度.此溶液每毫升相当于100.0μg锌.
锌标准使用液:吸取1.0mL锌标准溶液,置于100mL容量瓶中,加1mL盐酸(2 mol/L),定容.此溶液每毫升相当于1.0μg锌.
吸取 0、1.0、2.0、3.0、4.0、5.0、6.0、7.0mL 锌标准使用液,分别置于125mL分液漏斗中,各加盐酸(0.02 moL/L)至20mL.在各分液漏斗中加10mL乙酸-乙酸盐缓冲液、1mL硫代硫酸钠溶液(250 g/L),摇匀,再各加入10.0mL二硫腙使用液,剧烈振摇3min.静置分层后,将四氯化碳层滤入1 cm比色杯中,以四氯化碳调节零点,于波长520 nm处测吸光度,以吸光度为纵坐标,锌质量比(μg)为横坐标,绘制标准曲线.
1.5 配合物的合成工艺
取一定质量比的复合氨基酸和乙酸锌混合溶于250mL水中,控制溶液温的反应度,调节pH值,反应一定时间后[3],减压抽滤,洗涤沉淀3次.将所得沉淀干燥,得到微黄色产品.
1.5.1 配合物的最佳合成工艺的确定
在复合反应过程中,反应液pH值、温度、反应时间,这些因素都会影响着整个反应的进程,因而采用单因素分析的方法,固定其中两个变量的值,改变另一个变量的值,从而分析该变量的变化对复合反应的影响.最后用正交实验确定最佳的配合条件[4-5].采用 GB/T 5009.14—1996 食品中锌的测定方法中的二硫腙比色分光光度法分析.据吸光度的变化趋势,确定出最适反应条件.取反应后离心分离得到的上清液做吸光度测定,来确定残余的锌离子浓度.
1.5.2 配合率的计算
准确移取复合氨基酸-锌(II)配合物浓缩液10mL于100mL容量瓶中,定容,摇匀.用EDTA络合滴定法测定微量元素的总量.
另移取复合氨基酸-锌(II)配合物浓缩液10mL于100mL烧杯中,继续加热浓缩至近干.加入50mL无水乙醇,水浴温热充分搅拌后,离心分离,将沉淀用水溶解,转移至100mL容量瓶中,定容,摇匀.用EDTA络合滴定法测定螯合态微量元素的质量比.
准确移取25mL试液于250mL锥形瓶中,加入50mL水,滴加2~3滴 PAN指示剂,用0.02 mol/L EDTA标准溶液滴定,溶液颜色由紫红变为淡黄色即为滴定终点[6].
1.5.3 配合物的配合比的确定
采用等摩尔连续变化法[7],配制一系列浓度的金属锌离子溶液和复合氨基酸溶液,使锌离子和复合氨基酸的浓度总和为一定值,而连续改变金属离子和复合氨基酸的浓度之比值,测定各测试溶液的配合率,以吸光度A-f(复合氨基酸的物质的量与锌离子的物质的量之比)作图,由图可确定配合物的配合比.
1.5.4 配合产物的确定
对产物进行红外分析,确定其为目标产物[8].
2 结果与分析
2.1 香菇中复合氨基酸的组分
分析如表1.

表1 香菇中非必需氨基酸的质量比

表2 香菇必需氨基酸的质量比
2.2 锌标准曲线的绘制
锌标准曲线如图1所示,锌质量比在0~7μg范围内线性关系良好,相关系数r=0.9974,回归方程 y=0.0938x+0.0406.
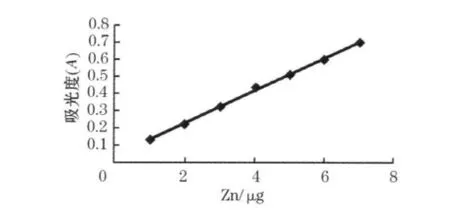
图1 锌的标准曲线
2.3 配合物的最佳合成工艺的确定
2.3.1 反应最佳温度的确定
调节溶液pH值为8.0,反应40min,改变反应的温度,取反应后离心分离得到的上清液做吸光度测定,结果如图2所示.
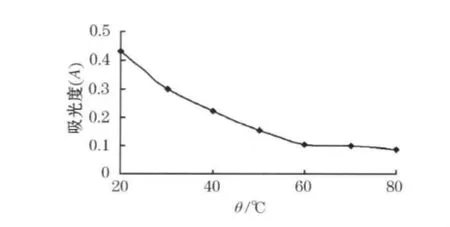
图2 温度对配合反应的影响
结果表明:当温度小于等于60℃时,吸光度随温度的升高而逐渐减小.说明在60℃前配合反应不完全,大于60℃时吸光度几乎不变,配合反应完全.
2.3.2 反应最佳时间的确定
调节溶液pH值为8.0,反应温度60℃,改变反应的时间,取反应后离心分离得到的上清液做吸光度测定,结果如图3所示.

图3 时间对配合反应的影响
结果表明:当时间小于等于40min时,吸光度随温度的升高而逐渐减小.说明在40min前配合反应不完全,大于40min时吸光度变化不大,配合反应完全.再延长反应时间没有任何意义.
2.3.3 反应最佳pH值的确定
控制反应温度60℃,反应的时间40min,调节反应的pH值,取反应后离心分离得到的上清液做吸光度测定,结果如图4所示.

图4 pH值对配合反应的影响
结果表明:pH值随着混合溶液的碱性增强,吸光度在逐渐的减小.当pH值为8.0时最小,当pH值大于8.0时吸光度上升,有副反应发生.说明螯合物部分开始解离.
2.3.4 配合物的最佳合成工艺的确定
在单因素实验的基础上,以取反应后离心分离得到的上清液测定的吸光度值为指标,以反应pH值、反应时间、反应温度为考察的因素.采用 L9(34)表进行正交实验,优化合成最佳条件.对实验结果进行方差分析,见表3、4、5.
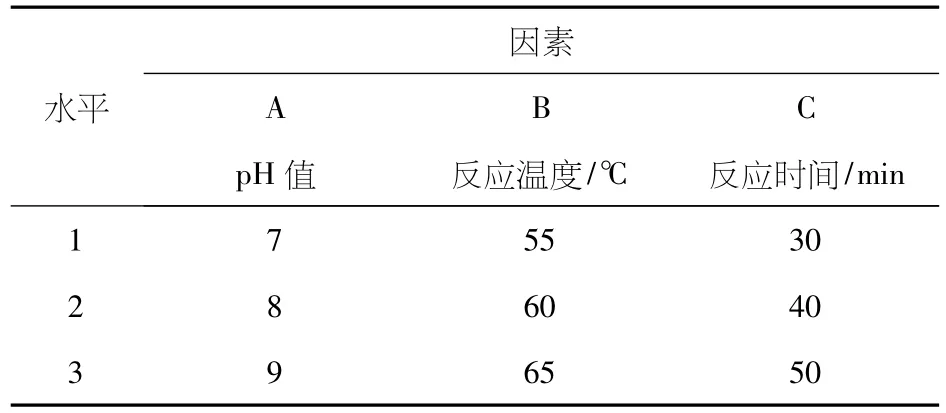
表3 因素与水平
在单因素试验的基础上,确定以配合反应pH值、配合反应温度、配合反应时间3个因素,选用L9(34)正交表进行正交试验,结果如表4所示.由表4可知,复合氨基酸-锌(II)的最佳合成工艺为:配合反应pH值为8.0,配合反应时间40min,配合反应温度为65℃.各种因素对配合反应效果影响的主次顺序依次为:反应pH值>反应温度>反应时间.通过方差分析(表5)可知,反应pH值因素对复合氨基酸-锌(II)影响均达显著水平(P<0.05),反应时间不显著.
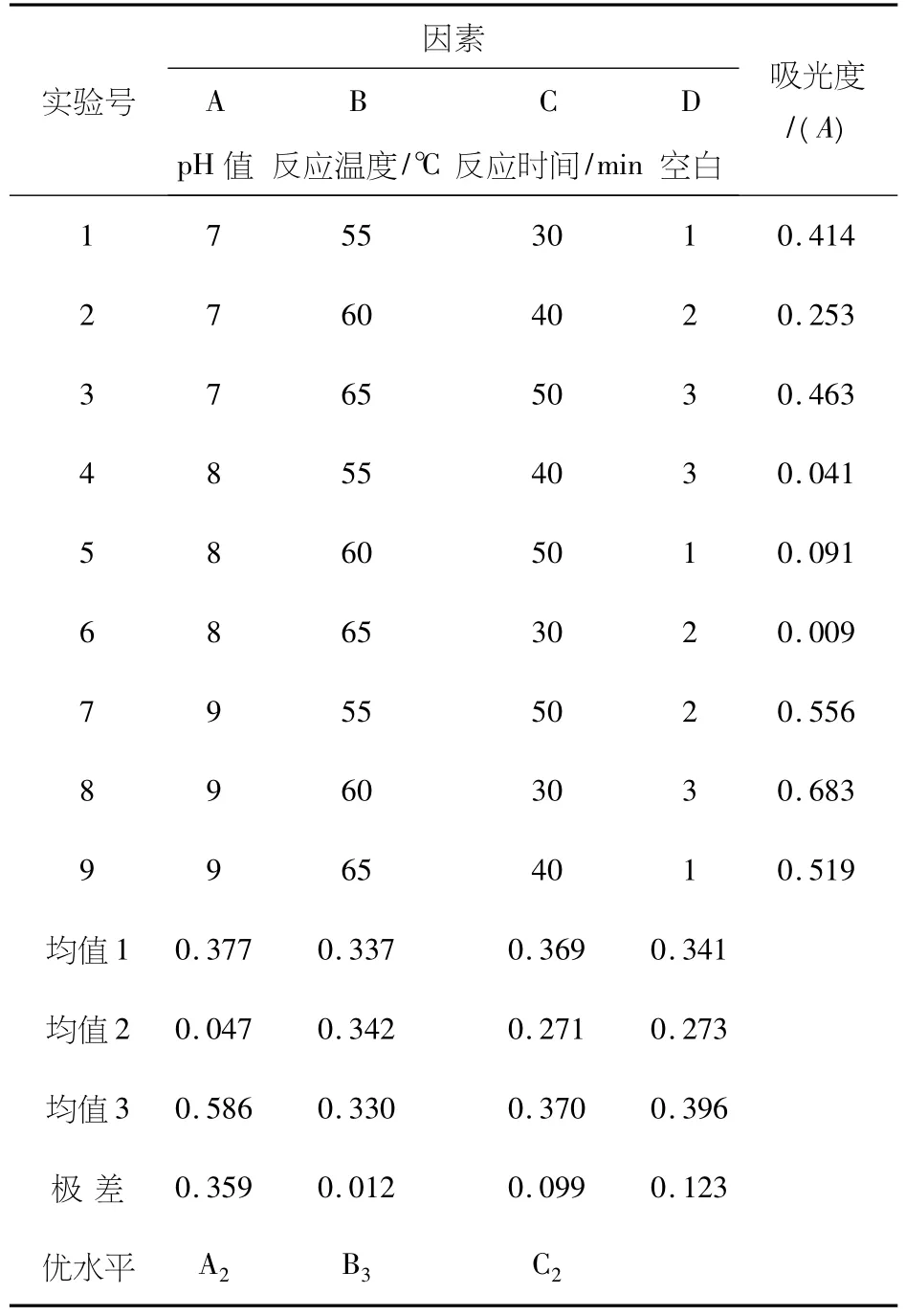
表4 正交试验表
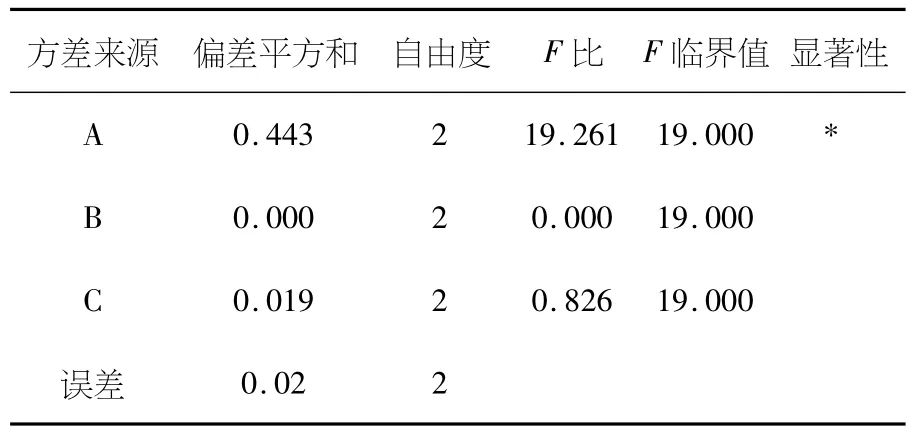
表5 正交试验方差分析表
2.4 验证实验
按正交实验确定的最佳条件,即配合反应温度65℃,反应时间40min,反应pH值为8.0,进行配合反应,测得取反应后离心分离得到的上清液的吸光度值为0.008,比正交实验结果中的较优组0.009小.所以认为此正交实验得出的优水平是可靠的.
2.5 配合物配合比的测定
等摩尔连续变化法实验结果如图5所示.
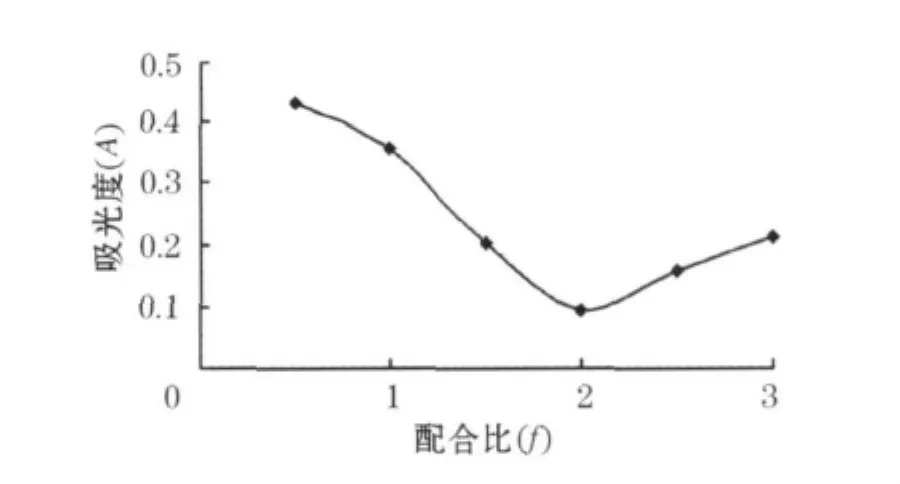
图5 复合氨基酸-锌(Ⅱ)配合比的确定
2.6 配合产物的确定
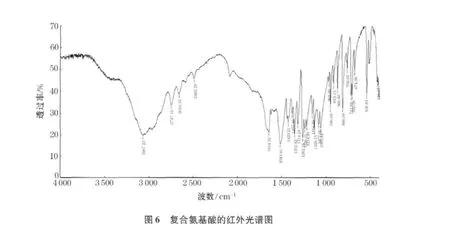
用KBr压片法测定复合氨基酸-锌(Ⅱ)在400 ~4000 cm-1的红外光谱.谱图如图6、7.
复合氨基酸与锌离子形成配合物后,它的一些主要吸收峰发生了明显位移,证实二价锌离子与复合氨基酸发生了配位作用.在复合氨基酸的红外光谱图中3067.23 cm-1的峰为-NH2和-COOH中的-OH合起来的长宽峰[8].复合氨基酸在2747 cm-1、2659 cm-1、2485 cm-1特征峰是醛类的 CH伸缩峰,说明复合氨基酸中有糖类杂质的存在,但是在配合物的IR谱图中完全消失,说明杂质没有参与锌的配合反应.复合氨基酸图谱中1644.02 cm-1由碳基(-C=O)的伸缩振动引起的特征吸峰.当复合氨基酸与锌配合后,配合物的红外光谱显示,氨基的特征吸收峰明显存在,但移至3411.92 cm-1处.同时,碳基的特征吸收移至1572.66cm-1处.这是由于复合氨基酸的氨基和羧基氧参与配位形成配合物的结果.
2.6 配合率的测定结果
配合率(%)=(配合态微量元素的质量比/微量元素的总量)×100=(CV1/CV0)×100=(V1/V0)×100
其中:C为标准EDTA溶液的浓度,mol/L;V1为滴定配合态微量元素所消耗的EDTA溶液体积,mL.V0为滴定微量元素的总量所消耗的EDTA溶液体积,mL.
复合氨基酸-锌(Ⅱ)的配合率测得结果为98.93%

3 结语
本实验研究了复合氨基酸与锌离子配合的最佳反应条件,得到最佳反应条件为:pH值为8.0,反应温度60℃,反应时间40min.通过等摩尔连续变化法并通过IR对合成产物进行了初步的表征,测得产物配合比为2∶1.配合率可达98.93%.
[1]龚 毅,胡晓波.锌氨基酸螯合物的抑菌活性研究[J].食品科学,2009,84-87.
[2]白 岚.香菇蛋白氨基酸分析[J].菌物研究,2006,4(2):21-24.
[3]钟国清,曾仁权.复合氨基酸微量元素螯和物的研究进展[J].化学世界,1996(6):286-290.
[4]徐立和.复合氨基酸螯合物的研究[J].化工科技市场,2002(12):32-40.
[5]史卫良,陈德余,吴清洲.水杨醛缩L-天冬氨酸过渡金属配合物的合成及表征[J].无机化学学报,1999,15(6):761-765.
[6]张红漫,仪明君,陆小华,等.复合氨基酸铜螯合物的研究[J].氨基酸和生物资源,2002,24(2):37-40.
[7]张大飞,照日格图,乌 云,等.熔融法合成甘氨酸锌配合物及表征[J].化学世界,2005(9):547-550.
[8]NAKAMOTO K.Infrared and Raman spectra of Inorganic and Coordination Compounds[M].4th Ed.NewYork:Wiley&Sons,1986.

