伊马替尼治疗不能切除和(或)转移性胃肠道间质瘤的系统评价
黄 雪,谭至柔,宁红健,聂海明,梁志海,陶 霖
广西医科大学第一附属医院消化内科,广西南宁530021
胃肠道间质瘤(GISTs)是胃肠道最常见的间叶源性肿瘤,估计每年的发病率为(15~20)/1 000 000[1]。GISTs目前被定义为一组独立起源于胃肠道间质干细胞的肿瘤,实质上由未分化或多能的梭形或上皮样细胞组成,免疫表型表达c-kit蛋白(CD117),遗传学上有c-kit基因突变的消化道间叶源性肿瘤[2-3]。GISTs临床表现缺乏特异性症状,大约15% ~50%的患者在就诊时就已发生转移。虽然外科手术是局限性GISTs患者的主要治疗手段。但即使肿瘤完全切除,仍有超过50%以上的患者最终肿瘤复发,且多数复发肿瘤切除后均会再次复发[4]。对于不能手术切除或复发转移的患者来说,常规的全身化疗均不敏感,有效率不足5%,而局部放疗目前还没有证实对GISTs有效[5]。分子靶向治疗的出现为GISTs的治疗翻开了崭新的一页,(甲磺酸)伊马替尼 (imatinib mesylate,商品名:格列卫)是第一个用于临床治疗恶性肿瘤的细胞信号传导抑制剂[6]。美国食品和药品管理局(FDA)在2002年2月批准伊马替尼用于不能切除和(或)转移性的GISTs,推荐的标准剂量是400 mg/d。目前用伊马替尼治疗不能切除和(或)转移性的GISTs,还存在许多疑惑,比如增加剂量会增加疗效吗?其最佳的剂量是多少?增加剂量是否会增加各种毒性反应?考虑到依马替尼价格昂贵,而且长期用药可能出现药物的毒性以及耐药克隆扩增所致的继发性耐药问题,那么何时可以停药?目前的文献尚未给出明确一致的答案,亦未见对这些试验的质量进行系统评价。我们按照Cochrane系统评价的方法对这些试验进行评价,主要目的是评价依马替尼治疗不能切除和(或)转移性GISTs的有效性和安全性。
1 材料与方法
1.1 纳入和排除标准
1.1.1 研究类型:①国内外关于应用依马替尼治疗不能切除和(或)转移性的 GISTs随机对照试验(RCT),无论是否进行了分配隐藏或采用盲法。②以摘要发表的研究,如果提供有足够的资料(包括方法学和结果),也将纳入分析。
1.1.2 研究对象:纳入标准:① 组织病理诊断为GISTs而且免疫组织化学证实有 c-kit表达(即CD117)阳性的不能切除和(或)转移性GISTs患者。②至少有一个可测量的临床或影像学观察指标。③年龄≥15岁。④ WHO体能评分为0~3分或ZPS五分法体力状况在0~3分。⑤治疗前4周内未接受过其他抗肿瘤治疗。⑥ 伴有正常的肾功能、肝功能、造血功能和心功能。排除标准:以下不能切除和(或)转移性的GISTs患者被排除:① c-kit(即CD117)表达阴性。② 怀孕、哺乳的女性患者。③ 患有严重心脏病(3~4级心功能不全);肝功能、肾功能异常的患者。④在注册4周之内接受化疗的患者。⑤同时患第二种恶性肿瘤。
1.1.3 干预措施:① 高剂量组(>400 mg/d)vs标准剂量组(400 mg/d)。②间断治疗组vs持续治疗组。
1.1.4 结局指标:主要测量指标:①无疾病进展生存率(progression-free survival rate,PFS);② 总生存率(overall survival rate,ORR)。次要测量指标:肿瘤反应(response to treatment)、毒副反应(toxic effects)、生活质量(quality of life)。肿瘤反应:分为四个等级:完全肿瘤反应(complete tumour response,CR)、部分肿瘤反应(partial tumour response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)[7-8]。毒副反应:分为0 ~Ⅳ级[9]。
1.1.5 语种限定:限制为中文和英文。
1.2 检索策略
1.2.1 计算机检索:PubMed(1989~2009.4)、EM-base(1989~2009.4)、Cochrane图书馆(2009年第3期)、中国期刊全文数据库(1989~2009.4)、万方数据库(1989~ 2009.4)、维普(1989~ 2009.4)、中国生物医学文献数据库(CBM,1989~2009.4)。同时手工检索其引文,以便发现新的可纳入文献。
1.2.2 检索词:中文检索词:“胃肠道间质肿瘤”、“胃肠道间质瘤”、“胃肠间质瘤”、“间质瘤”、“甲磺酸伊马替尼”、“伊马替尼”、“格列卫”、“STI 571”、“随机”等。英文检索词:“gastrointestinal stromal tumors”、“gastrointestinal stromal”、“ GISTs”、“Imatinib mesylate”、“ Imatinib”、“STI571”、“Glivec”、“Gleevec”、“random”等。
1.3 纳入试验的筛选 由2名评价员独立阅读文献,在排除明显不符合纳入标准的试验后,对可能符合纳入标准的文献阅读全文,以确定是否真正符合纳入标准,排除重复发表、可疑数据、综述、同一作者不同时期发表的同一研究目的的文献等。
1.4 质量评价和资料提取 各纳入RCT的方法学质量评价采用Cochrane手册推荐的简单评估法,评价条目包括评价RCT外部与内部真实性的关键指标:①随机方法是否正确;② 是否做到分配隐藏,分配方法是否正确;③是否实施盲法;④ 是否报告失访和退出情况,如有失访或退出是否采用意向治疗(ITT)分析;⑤是否有选择性报告;⑥其他潜在影响真实性因素。对于分配隐藏,将试验评为A(完全隐藏)、B(不清楚是否隐藏)、C(隐藏不充分)和D(没有使用隐藏)4个等级。在其他方面将试验评为A(是)、B(不清楚)、C(否)三级。如各评价条目均为A级,则为低度偏倚,发生各种偏倚的可能性最小,质量评为A级;若有一条目或多个条目为B,则该试验有发生相应偏倚的中等度可能性,质量评为B级;如其中有一条目或多个条目为C,则该试验有发生相应偏倚的高度可能性,质量评为C级。按照本研究专门的资料提取表信息,主要资料包括:① 试验的基本情况、干预措施、结局指标、失访及处理;② 反映研究质量的指标。如临床试验的资料不全,尽可能与原文作者联系获得。
1.5 统计学分析 由2人独立输入数据,采用Cochrane协作网提供的专用软件RevMan5.0进行meta分析。
1.5.1 异质性检验:首先对纳入研究进行临床异质性和方法学异质性分析,按照临床同质性和方法学同质性对各研究进行亚组分析,然后分析各亚组内的统计学异质性。统计学的异质性采用χ2检验,检验水准α=0.1;用I2评估异质性大小,I2<25% 时则异质性较小,25% <I2<50% 则为中等度异质性,I2>50%则研究结果间存在高度异质性。
1.5.2 按意向治疗分析原则对纳入试验进行meta分析:所有分类变量资料以相对危险度 (RR)表示,所有连续变量资料以加权均数差(WMD)表示,单个连续变量资料以均数差(MD)表示。效应量采用率差及其95%CI。如某指标率差为0,提示两种治疗方法在该指标上无差别,用Z检验合并率差。如果P≤0.05则认为差异有统计学意义。若研究间无异质性,则采用固定效应模型进行合并分析;若研究间存在异质性,则采用随机效应模型,并从试验质量、纳入对象、药物疗程及剂量、结果的测量等方面进行亚组分析以探讨产生异质性的原因。如果异质性明显,不宜使用meta分析,则采用描述性分析。采用漏斗图分析是否存在发表偏倚。
1.5.3 敏感性分析:对质量低、权重特别大或结果与其他研究不同的研究的影响性进行敏感性分析。
2 结果
2.1 文献检索结果 初检获得1 485篇文献,其中,中文文献2篇,英文文献1 483篇。通过阅读标题和摘要,筛选出可能符合纳入标准的RCT文献18篇。进一步阅读全文,排除重复文献3篇,不符合纳入标准文献10篇,最后,在本系统评价之初,纳入5篇RCT文献(4个研究)进行分析。
2.2 纳入研究的基本特征 见表1。
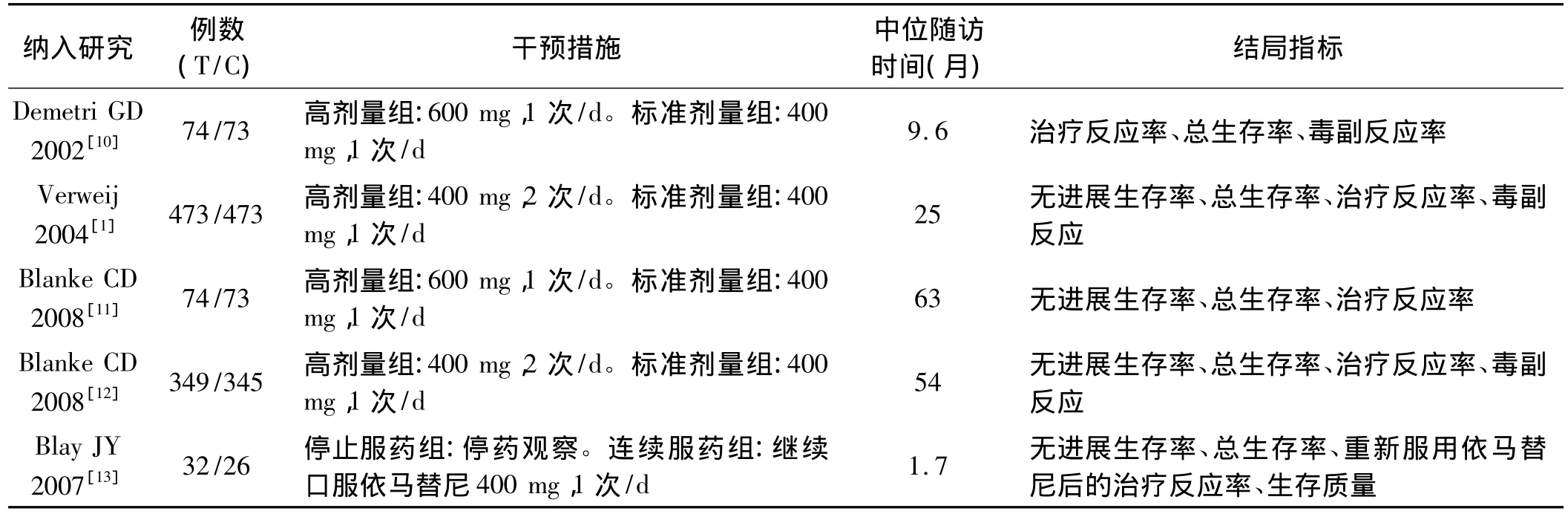
表1 纳入研究的基本特征Tab 1 Basic feature of Integrered literature
2.3 纳入试验的方法学质量评价
2.3.1 随机方法:有4篇[1,10-12]明确提到采用“中央随机”的方法,有一篇[13]仅提及“randomized”,但未描述具体的随机方法。
2.3.2 分配隐藏:有4篇[1,10-12]明确提到采用“中央随机”的方法,通过中心电话通知随机分配方案,分配隐藏充分。有一篇[13]未描述具体的分配隐藏方法。
2.3.3 盲法:有3 篇[10-11,13]提到“open-label”,明确说明未采用盲法。有 2 篇[1,12]分别提及“Treatment allocation was not masked”和“There was no blinding of drug administration”,表明对病人和医生未设盲,但未描述对结果测量者是否采用盲法。
2.3.4 对失访、退出和意向性分析的描述:5篇文献均报告了受试者有退出、失访的情况,并对具体原因和人数进行了详细的说明,退出、失访比例均<15%,对疗效指标均采用了ITT分析。
2.3.5 依从性评价:5篇文献均明确说明与试验的受试者均签订了知情同意书,并且详细说明试验组和对照组当病情恶化时允许改变治疗方案或退出试验的保证和评价的方法。
2.3.6 基线情况:有1篇文献[13]指出两组基线情况具有可比性,统计学分析无显著性差异。有2篇文献[1-12]对临床基线情况虽然未做统计学计算,但有详细的资料,显示很好的可比性。另有2篇文献[10-11]只给出两组病人总的临床基线情况,无法显示两组的基线是否有可比性。
本研究纳入的5篇文献方法学质量评价,2篇为B级(有发生偏倚的中度可能性),3篇为C级(有发生偏倚的高度可能性)。因纳入文献质量不高,未进行敏感性分析。由于纳入的文献数目有限,故无法使用漏斗图对发表性偏倚进行评价。
2.4 无疾病进展生存率
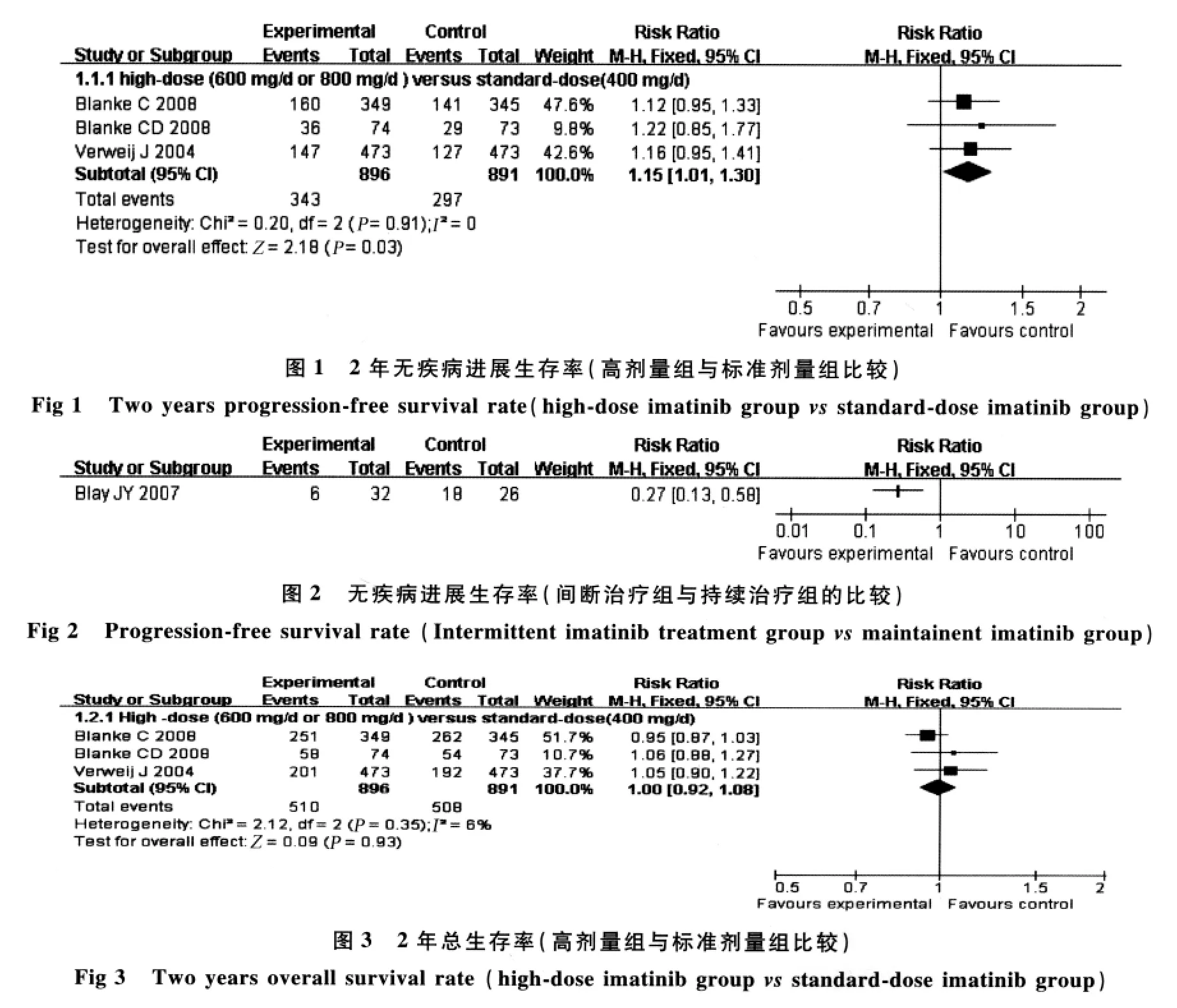
2.4.1 高剂量组(>400 mg/d)和标准剂量组(400 mg/d)的比较:有3 个研究[1,11-12](共1 787 例患者)均报道了2年无疾病进展生存率的资料,meta分析结果显示,3个试验间异质性小(χ2=0.20,P=0.91,I2=0),故采用固定效应模型进行合并,结果显示差异有统计学意义(RR=1.15,95%CI=1.01~1.30,P=0.03),提示与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者能提高2年无疾病进展生存率(见图1)。
2.4.2 依马替尼间断治疗组和持续治疗组的比较:有一个研究[13]报道了用依马替尼(400 mg/d治疗12个月)控制病情(达到CR、PR或SD)后,58例无疾病进展的患者随机接受持续治疗或间断治疗。结果发现:间断治疗组的无疾病进展生存率明显低于持续治疗组(RR=0.27,95%CI=0.13~0.58)。提示依马替尼间断治疗的患者出现疾病进展的风险明显增高(见图2)。
2.5 总生存率
2.5.1 高剂量组和标准剂量组的比较:有3个研究[1,11-12](共1 787 例患者)均报道了 2 年总生存率的资料,meta分析结果显示,3个试验间异质性小(χ2=2.12,P=0.35,I2=6%),故采用固定效应模型进行合并,结果显示差异无统计学意义(RR=1.00,95%CI=0.92~1.08,P=0.93),提示与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者不能提高2年生存率(见图3)。
2.5.2 依马替尼间断治疗组和持续治疗组的比较:有一个研究[13](58例患者)报道了用依马替尼控制病情后,间断治疗组的1年生存率与持续治疗组比较差异无统计学意义(RR=0.91,95%CI=0.59~1.41)(见图4)。
2.6 肿瘤反应率
2.6.1 完全肿瘤反应率(CR):有 3 个研究[1,11-12](共1 787例患者)均报道了CR的资料,meta分析结果显示,3 个试验间异质性小(χ2=3.26,P=0.20,I2=39%),故采用固定效应模型进行合并,结果显示差异无统计学意义(RR=1.02,95%CI=0.66~1.59,P=0.93),提示与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者不能提高完全肿瘤反应率(见图5)。
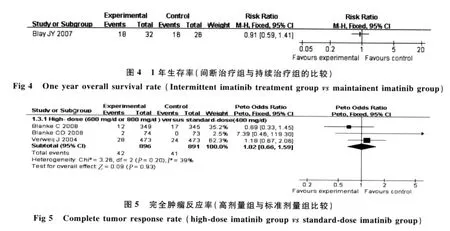
2.6.2 部分肿瘤反应率(PR):有 3 个研究[1,11-12](共1 787例患者)均报道了PR的资料,meta分析结果显示,3 个试验间异质性小(χ2=0.96,P=0.62,I2=0),故采用固定效应模型进行合并,结果显示差异无统计学意义(RR=1.06,95%CI=0.96~1.17,P=0.28),提示与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者不能提高部分肿瘤反应率(见图6)。
2.7 毒副反应
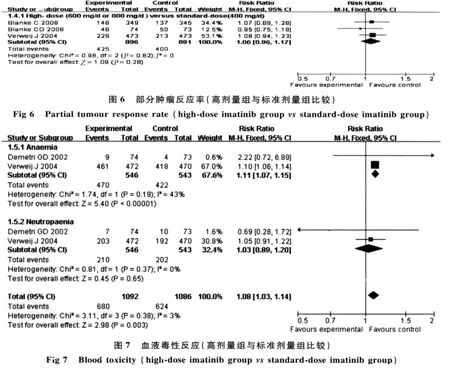
2.7.1 血液毒性反应:有 2 个研究[1,10](共 1 304 人次)均报道了血液毒性反应(包括贫血和粒细胞减少)的资料,meta分析结果显示,2个研究间异质性小(χ2=3.11,P=0.38,I2=3%),故采用固定效应模型进行合并,结果显示差异有统计学意义(RR=1.08,95%CI=1.03~1.14,P=0.003),提示与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者增加了血液毒性反应(见图7)。
2.7.2 非血液毒性反应:有3个研究[1,12-13](共3 767人次)均报道了非血液毒性反应(包括胃肠道反应、水肿、皮疹、疲怠、出血、心脏毒性)的资料,meta分析结果显示,对各项非血液毒性反应,3个研究间异质性均较小(χ2:0.11~1.38,P 均 >0.1,I2:0~28%),故采用固定效应模型进行合并,结果显示:与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者增加了以下各项非血液毒性反应,差异均有统计学意义。① 恶心 (RR=1.22,95%CI=1.09~1.36,P=0.0004)。② 呕吐 (RR=1.40,95%CI=1.17~1.69,P=0.0003)。③ 腹泻 (RR=1.19,95%CI=1.06~1.34,P=0.003)。④ 水肿(RR=1.20,95%CI=1.13~1.28,P <0.00001)。⑤ 皮疹(RR=1.72,95%CI=1.45~2.03,P <0.00001)。⑥ 疲怠(RR=1.18,95%CI=1.09~1.27,P <0.0001)。⑦ 出血(RR=1.97,95%CI=1.53~2.55,P <0.00001)。⑧心脏毒性(RR=2.07,95%CI=1.29~3.32,P=0.003)(见图8)。
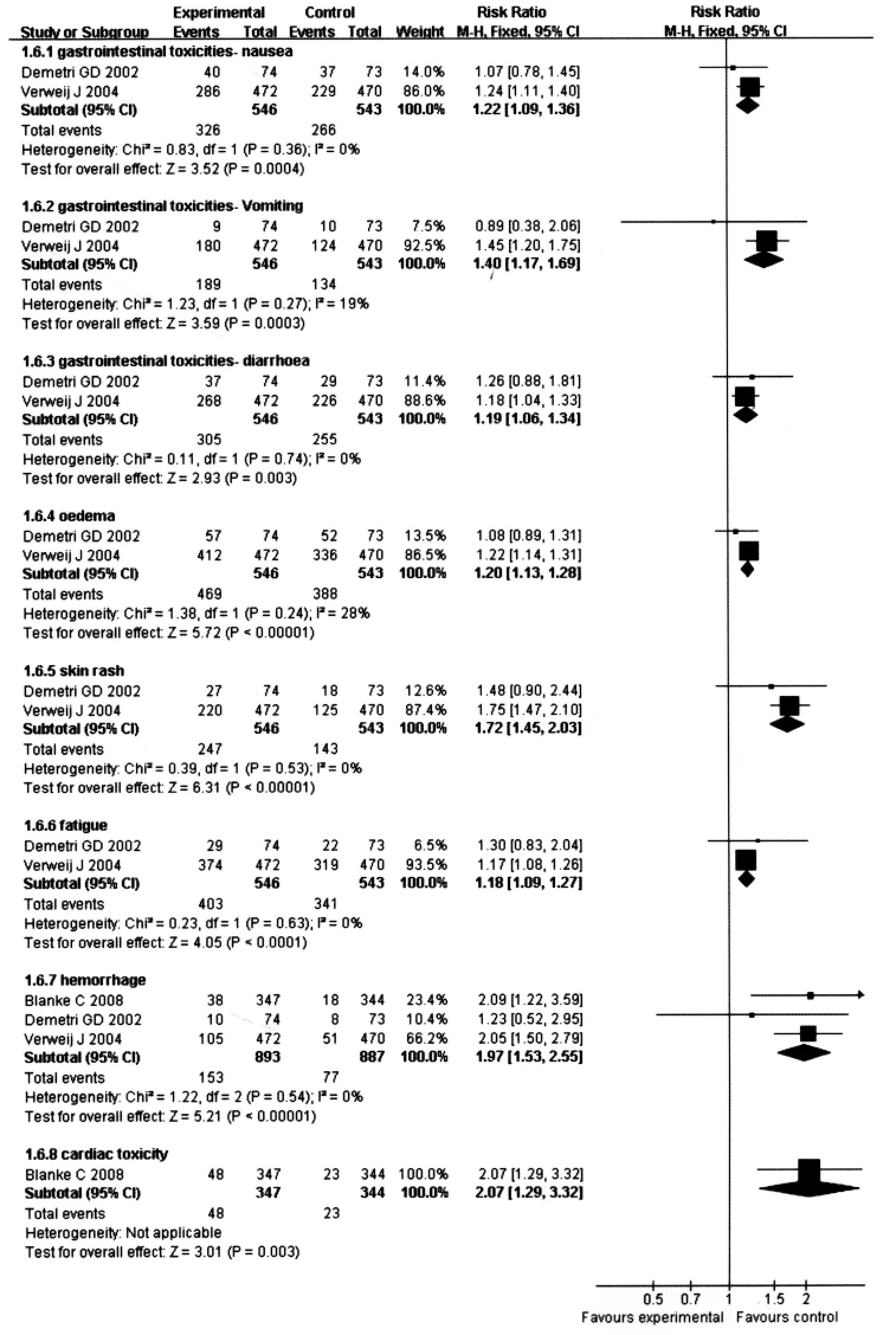
图8 非血液毒性反应(高剂量组与标准剂量组比较)Fig 8 Non-blood toxicity(high-dose imatinib group vs standard-dose imatinib group)
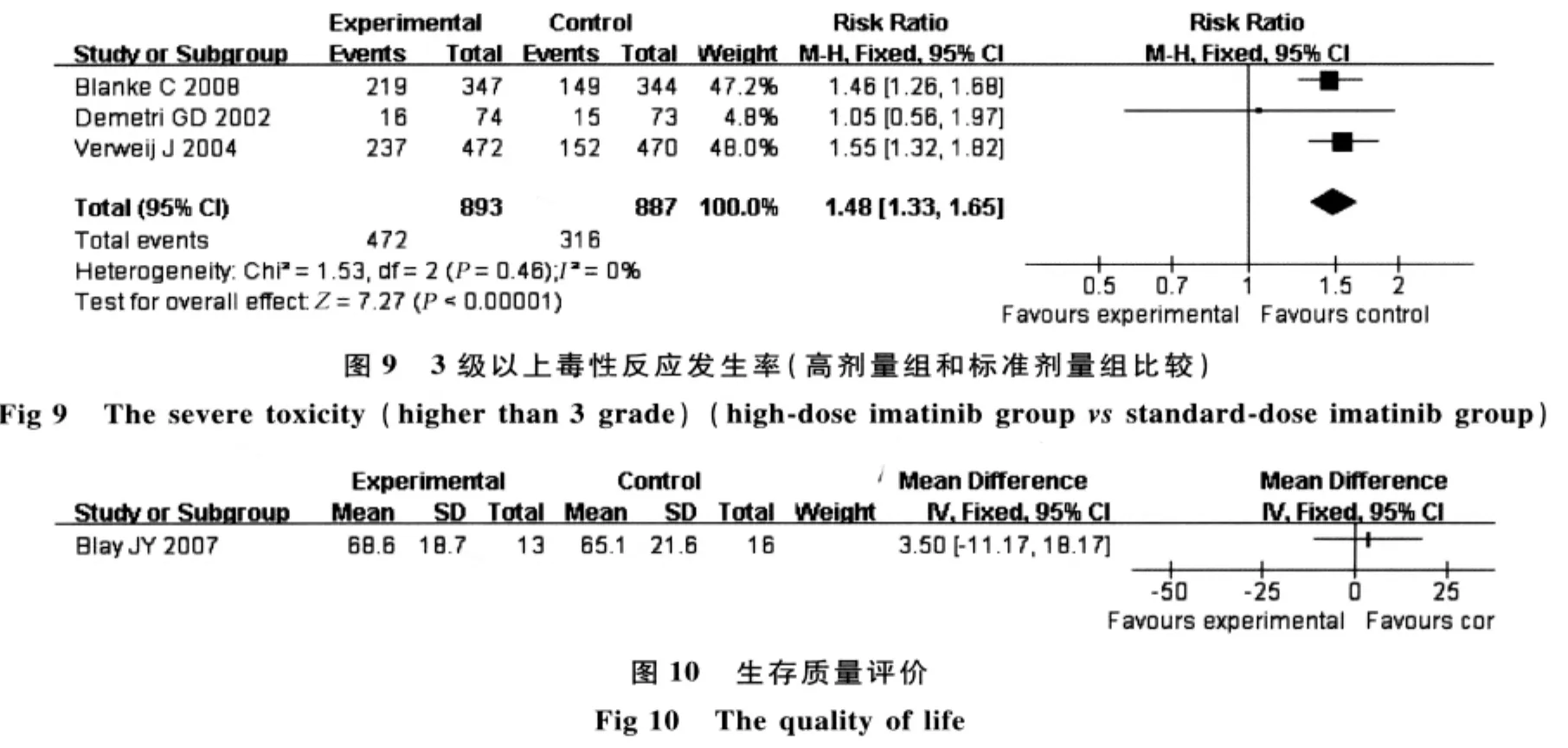
2.7.3 3 级以上毒性反应发生率:有 3 个研究[1,10,12](共788例患者)报道了3级以上毒性反应发生率的资料,meta分析结果显示:3个研究间异质性较小(χ2=1.53,P=0.46,I2=0),故采用固定效应模型进行合并,结果显示差异有统计学意义(RR=1.48,95%CI=1.33~1.65,P <0.00001),提示与标准剂量组比较,高剂量组治疗不能切除和(或)转移性的GISTs患者增加了3级以上毒性反应发生率(见图9)。
2.8 生存质量 有1个研究[13]对用依马替尼控制病情后停止服药组和继续服药组进行了生存质量评价:采用QLQC30评分系统,结果提示两组病人在总的健康状况、功能状况和症状评分方面差异无统计学意义(MD=3.50,95%CI=-11.17 ~18.17,P >0.05)(见图10)。
3 讨论
3.1 有效性和安全性分析 通过本研究,我们发现:与标准剂量400 mg/d比较,高剂量组(600 mg/d或800 mg/d)依马替尼虽然增加2年无疾病进展生存率,但在2年总生存率、完全肿瘤反应率、部分肿瘤反应率方面两组相似。在安全性方面,高剂量组依马替尼不良反应的发生率及严重度均较400 mg/d组高。综上所述,对不能切除和(或)转移性的GISTs患者,增加剂量,病人未见明显临床获益,还大大增加了不良反应的发生率及严重度。说明对不能切除和(或)转移性的GISTs患者,依马替尼的治疗未显示出明显的量效依赖关系,高剂量的疗效未优于标准剂量。有一个研究[13]报道了用依马替尼(400 mg/d治疗12个月)控制病情(达到CR、PR或SD)后,其中58例患者随机接受持续治疗或间断治疗。结果发现:间断治疗组的无疾病进展生存率明显低于持续治疗组。在总的健康状况、功能状况和症状评分方面差异无统计学意义。提示依马替尼间断治疗的患者出现疾病进展的风险明显增高,而生存质量未见改善。因此,依马替尼治疗GISTs取得疗效后,应持续服药,以免引起疾病进展的风险增加。但仅纳入一个研究,例数太少,方法学质量评价亦不高,需要今后更多符合循证医学设计标准的RCT研究以增加证据的强度。
3.2 纳入研究的局限性 本系统评价纳入5篇文献(4个研究),虽然是多中心多国家的研究,但依然存在方法学质量和报道结果不足的问题:① 随机的影响:有1个研究[13]仅提及“randomized”,但未描述具体的随机方法和分配隐藏,有可能导致选择性偏倚。②盲法的影响:有3个研究[10-11,13]明确说明未采用盲法,另2个研究[1,12]提及“对治疗过程不设盲法”,但未描述对结果测量者是否采用盲法。因此可能存在选择性偏倚、实施偏倚和测量性偏倚的可能性。③不同基因型对本研究结果的影响:现有研究已表明[14]:表达不同基因突变型的GISTs患者对依马替尼的疗效差异很大,在c-kit阳性的GISTs患者中,主要突变位点位于外显子11(占67%),这部分患者对伊马替尼治疗反应良好,还有约10%的GISTs患者c-kit突变位点在外显子9,目前认为这部分患者对伊马替尼的治疗反应不如外显子11突变的患者好,通常预后较差。而纳入的4个研究,有3个研究[1,11-12]在随机分组前,均未对纳入的c-kit阳性GISTs患者进行不同基因突变型的分层分析。因此,两组发生不同基因突变型的风险高低可能存在较大差异,其基线的可比性受到质疑,从而可能影响本研究结果的准确性。④ 根据CT和PET判定依马替尼对GISTs的治疗反应对本研究结果的影响:对实体肿瘤的治疗反应传统上是根据肿瘤的大小来判定的,比如“SOGC”的判断标准或“RECIST”的判断标准。但是用这些标准来评估依马替尼治疗GISTs的反应是不敏感的。因为依马替尼治疗GISTs后肿瘤体积的变化往往发生较晚。有的患者治疗有效仅表现在肿瘤密度的下降变为囊性,而肿瘤大小无明显改变。另外一些患者在原先存在的病灶内出现了新的增强结节病灶,也就是“耐药克隆结节”,肿瘤大小无任何改变[15]。所以单纯依靠CT根据病灶大小评价疗效可能会出错。正电子发射断层显像(PET)是目前公认可以早期评价伊马替尼治疗GISTs疗效的影像学手段,但价格昂贵,以及约20%的病灶不能显示,成为制约PET评价的不利因素[16]。而纳入的4个研究中,均应用CT或MRI,极少数病人应用PET根据肿瘤的大小来判定依马替尼的治疗反应,从而可能影响本研究结果的准确性。⑤ 所有的研究均排除了伴有严重心、肝、肾功能不全患者;年龄 <15岁的患者;c-kit(即CD117)表达阴性的患者;怀孕、哺乳的女性患者;在注册4周之内接受化疗的患者;同时患第二种恶性肿瘤的患者。所以在这类病人应用依马替尼时,其安全性及有效性有待进一步研究。
3.3 本系统评价的局限性 ①未手工检索杂志。②未进行经济学的评价。③纳入本系统评价分析的研究数目有限(5篇文献,4个研究),无法使用漏斗图对发表性偏倚进行评价。
3.4 本系统评价结果的意义和对未来研究的启示本系统评价结果提示:①对不能切除和(或)转移性的GISTs患者,增加剂量,病人未见明显临床获益,还大大增加了不良反应的发生率及严重度。依马替尼的治疗未显示出明显的量效依赖关系,高剂量的疗效未优于标准剂量。②依马替尼治疗GISTs取得疗效后,应持续服药,以免引起疾病进展的风险增加。鉴于纳入的临床试验方法学质量偏低,存在多种局限性。间断治疗组和持续治疗组纳入的研究只有一个,样本含量亦少,可能对本研究的结果有影响,故对上述结果的解释应持谨慎态度。建议今后的研究应致力于提高研究质量,充分随机分组,并切实做好分配隐藏,对可实施盲法的试验,尽量采用有效的盲法,如果实施过程设盲困难,也应尽可能做到单盲,盲法评价疗效(对结果测量者实施盲法)。研究报告应采用国际通用的“随机对照试验报告标准(CONSORT)”,详尽清楚地描述研究的设计和实施过程。关注伴有肝、肾功能和心功能不全的GISTs患者。随机分组前,对纳入的GISTs患者基因突变型进行分层分析,有助于临床进行疗效评估和预后判断。评估依马替尼治疗GISTs的反应采用目前公认较好的根据CT对比增强扫描为基础的Choi标准[17],该标准综合考虑肿瘤密度和大小的变化,可以更敏感、准确地评估伊马替尼的早期疗效。
[1]Verweij J,Casali PG,Zalcberg J,et al.Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib:randomised trial[J].Lancet,2004,364(9440):1127-1134.
[2]Schubert ML,Moghimi R.Gastrointestinal stromal tumor(GIST)[J].Curr Treat Options Gastroenterol,2006,9(2):181-188.
[3]Morey AL,Wanigesekera GD,Hawkins NJ,et al.C-kit mutations in gastrointestinal stromal tumours [J].Pathology,2002,34(4):315-319.
[4]Vander Z,wan SM,De Matteo RP.Gastrointestinal stromal tumour:5 years later[J].Cancer,2005,104(9):1781-1788.
[5]Dematteo RP,Heinrich MC,El Rifai WM,et al.Clinical management of gastrointestinal stromal tumors:before and after STI-571[J].Hum Pathol,2002,33(5):466-477.
[6]Rutkowski P,Symonides M,Zdzienicki M,et al.Developments in targeted therapy of advanced gastrointestinal stromal tumors[J].Recent Patents Anticancer Drug Discov,2008,3(2):88-99.
[7]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors.European Organization for Research and Treatment of Cancer,National Cancer Institute of the United States,National Cancer Institute of Canada [J].J Natl Cancer Inst,2000,92(3):205-216.
[8]World Health Organization.WHO hand book for reporting results of cancer treatment[J].World Health Organization Offset Publications,1979,48:1-45.
[9]Cancer therapy evaluation program:Common toxicity criteria manual:Common toxicity criteria,version 2.0[J].Bethesda,MD,National Cancer Institute,1999,4:1-35.
[10]Demetri GD,von Mehren M,Blanke CD,et al.Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors[J].N Engl J Med,2002,347(7):472-480.
[11]Blanke CD,Demetri GD,Mehren MV,et al.Long-term results from a randomized phase II trial of standard-versus higher-dose Imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT [J].J Clin Oncol,2008,26(4):620-625.
[12]Blanke CD,Rankin C,Demetri GD,et al.Phase III randomized,intergroup trial assessing Imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine Kinase:S0033[J].J Clin Oncol,2008,26(4):626-632.
[13]Blay JY,Cesne AL,Ray-Coquard I.et al.Prospective multicentric randomized phase III study of Imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year:the french sarcoma group[J].J Clin Oncol,2007,25(9):1107-1113.
[14]Rychtera MD,Sciotb R,Cesned AL,et al.KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours [J].European Journal of Cancer,2006,42(8):1093-1103.
[15]Desai J,Shankar S,HeinrichMC,et al.Clonal evolution of resistance to imatinib in patients with metastatic gastrointestinal stromal tumors[J].Clin Cancer Res,2007,13(18 Pt 1):5398-5405.
[16]Choi H,Charnsangavej C,Faria SC,et al.Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate:proposal of new computed tomography response criteria[J].J Clin Oncol,2007,25(13):1753-1759.
[17]Choi H.Critical issues in response evaluation on computed tomography:lessons from the gastrointestinal stromal tumour model[J].Curr Oncol Rep,2005,7(4):307-311.

