胰岛素受体及胰岛素样生长因子Ⅰ 在多囊卵巢综合征患者子宫内膜的表达及意义
张慧英 韩玉崑 宋学茹
天津医科大学总医院妇产科(300052)
多囊卵巢综合征(PCOS)是一种以卵泡发育障碍、胰岛素抵抗和雄激素过多为特征,病因复杂的神经内分泌、代谢性综合征。PCOS患者长期无排卵或稀发排卵,子宫内膜长期受单一雌激素的刺激可使子宫内膜异常增生并可发展成为子宫内膜癌。但同样长期单一雌激素影响下的PCOS患者并不都发生子宫内膜癌。有些患PCOS多年的患者子宫内膜无异常增生及不典型增生,所以不能完全用长期单一的雌激素对内膜的刺激来解释。近年来对子宫内膜的研究发现,子宫内膜不仅仅是卵巢分泌甾体激素的靶器官,它还表达其他一些激素及生长因子的受体,如胰岛素和胰岛素生长因子(IGF)及其受体,影响子宫内膜的增殖与分化,而这些激素及生长因子与卵巢甾体激素相互影响。本研究通过测定血清胰岛素水平、检测子宫内膜局部胰岛素受体(IR)及IGF-Ⅰ的表达,探讨及与PCOS子宫内膜增生的关系。
1 对象与方法
1.1 研究对象
收集2006年11月~2007年12月于天津医科大学总医院妇科就诊,因出血或闭经行诊刮的PCOS患者34例,年龄29.41±5.56(21~40)岁,PCOS诊断依据2003年鹿特丹诊断标准,根据子宫内膜病理检查结果分为A组(内膜增生和癌变组)16例和B组(子宫内膜病理正常改变组)18例;同期就诊的月经正常、因其他因素不孕或卵巢良性肿瘤行诊刮患者32例为对照组,年龄31.56±3.48(24~41)岁。分别观察各组的空腹血糖及空腹胰岛素水平、血清雌二醇(E2)水平、子宫内膜组织病理学改变,检测子宫内膜IR及IGF-Ⅰ的表达。
1.2 实验方法
1.2.1 空腹血糖及胰岛素测定 收集空腹静脉全血4ml,离心后取血清,化学发光法测定E2、放射免疫法测定空腹血清胰岛素(FIns),氧化酶法测定空腹血糖(FPG);采用稳态模型(HOMA)法计算胰岛素抵抗指数(HOMA-IR)。HOMA-IR=[FIns(mU/L)×FPG(mmol/L)]/22.5。
1.2.2 子宫内膜病理学诊断标准 根据镜下特点将子宫内膜分为增生期、分泌期、子宫内膜增生及子宫内膜癌,根据国际妇科病理学会(ISGP,2007)分型将子宫内膜增生分为单纯型增生、复杂型增生及不典型增生[1]。
1.2.3 采用免疫组化法测定子宫内膜中IR、IGF-Ⅰ的表达 ①标本制作:子宫内膜经福尔马林固定、石蜡包埋,切制成4μm的组织切片数张,用于免疫组化染色。②IR、IGF-Ⅰ的免疫组化检测:鼠抗人IR单克隆抗体购自NewMarker公司,鼠抗人IGR-Ⅰ单克隆抗体及SP免疫组化试剂盒购自天津灏洋生物制品科技公司。一抗稀释度为1:50。以胎盘组织作为IR的阳性对照,胰腺组织作为IFG-I的阳性对照,以PBS代替一抗作为阴性对照,以免疫组化SP法检测IR、IGF-Ⅰ的表达。③结果判定:IR主要定位于细胞膜,IGF-Ⅰ主要定位于细胞浆,相应部位出现黄色或棕黄色颗粒为阳性细胞。为了兼顾染色强度(SI)和阳性细胞的百分比(PP),采用半定量法计算其相对含量,即采用免疫反应数(IRS)表示其表达水平。具体方法如下:低倍镜下(×100)随机选择5个视野,高倍镜下(×400)计数,每个视野下至少计数100个细胞。评分标准为:IRS=SI×PP。(SI:阴性为0,淡黄色为1,黄色为2,棕黄色为3;PP:<5%为0,5% ~25%阳性为1,25% ~50%阳性为2,50% ~75%阳性为3,75% ~100%阳性为4。)每例的IRS为5个视野的平均值。
1.3 统计学方法
采用SPSS11.5软件包进行统计学处理。组间均数比较采用方差分析,两两比较采用LSD-t方法,不符合方差分析的数据采用秩和检验分析,两两比较采用Nemenyi方法。变量间的相关关系采用Pearson相关分析。检验水准均为双侧α=0.05。
2 结果
2.1 各组子宫内膜病理改变
A组16例PCOS患者中,单纯型增生8例,复杂型增生1例,不典型增生5例,癌变2例。B组18例中,增生期17例,分泌期1例。对照组32例中,子宫内膜呈分泌期9例,增生期21例,单纯性增生2例。
2.2 研究对象各指标情况
2.2.1 血清E2A组、B组、对照组血清E2含量分别为 55.13 ± 40.38pg/ml、52.49 ± 26.20 pg/ml、79.26±46.91pg/ml,3组间差异无统计学意义(P=0.233)。
2.2.2 血清下胰岛素比较 血清下胰岛素浓度A组(16.61±9.48mU/L)>对照组(11.47±6.48mU/L)>B组(10.63±6.09mU/L),组间差异有统计学意义(F=2.805,P=0.070)。经两两比较,A组与B组及对照组之间差异有统计学意义(P值分别为0.033,0.044),B组与对照组之间无统计学差异(P=0.715)。
2.2.3 IR IR主要在子宫内膜腺上皮细胞表达,间质细胞部分表达。表达强度A组(5.12±3.58)>B组(1.83±1.96)>对照组(1.37±1.54),组间差异有统计学意义(P=0.004)。经两两比较,A组IR表达高于 B组及对照组(P值分别为0.012,0.002),B组与对照组之间差异无统计学意义(P=0.415)。
2.2.4 IGF-Ⅰ IGF-Ⅰ在子宫内膜腺上皮细胞及间质细胞均有表达,表达量相似。组间表达量A组(9.74±2.11)>B组(7.61±2.98)>对照组(7.22±2.30),组间差异有统计学意义(P=0.006)。经两两比较,A组IGF-Ⅰ表达高于B组及对照组(P值分别为0.039,0.001),而B组与对照组之间差异无统计学意义(P=0.395)。
2.3 PCOS子宫内膜不同病理改变时IGF-Ⅰ、IR的表达比较
2.3.1 IR PCOS子宫内膜IR表达,不典型增生及癌变期>单纯及复杂型增生期>增生或分泌期,各组间差异有统计学意义(P=0.048)。不典型增生及癌变期IR表达高于增生或分泌期,差异有统计学意义(P=0.030)。单纯及复杂型增生期与增生期或分泌期、不典型增生及癌变期与单纯及复杂型增生期之间IR表达差异无统计学意义(P=0.070,P=0.791)。
2.3.2 IGF-Ⅰ 不典型增生及癌变期单纯及复杂型增生期各组间PCOS子宫内膜IGF-Ⅰ表达差异无统计学意义(P=0.168)。各组IR、IGF-Ⅰ的表达比较见表1。不同病理改变的子宫内膜IR、IGF-Ⅰ表达见图1。
表1 PCOS不同病理改变子宫内膜IR、IGF-Ⅰ的表达(±s)
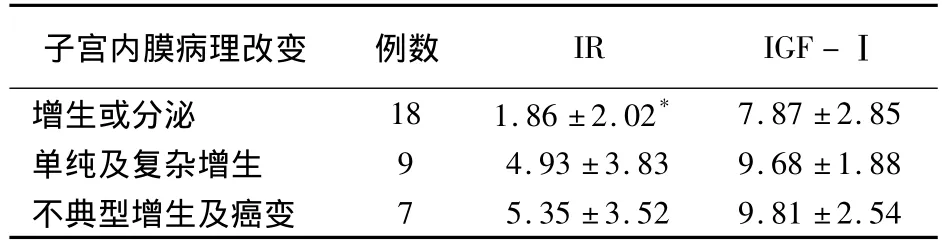
表1 PCOS不同病理改变子宫内膜IR、IGF-Ⅰ的表达(±s)
*与不典型增生及癌变组比较P<0.05
增生或分泌 18 1.86±2.02*7.87±2.85单纯及复杂增生 9 4.93±3.83 9.68±1.88不典型增生及癌变7 5.35±3.52 9.81±2.54
2.4 子宫内膜IR、IGF-Ⅰ表达与FIns、E2水平的关系
相关分析结果显示子宫内膜IR表达与血清胰岛素水平呈正相关(r=0.428,P<0.01);子宫内膜IGF-Ⅰ表达与Ins水平呈弱的正相关(r=0.286,P<0.05);子宫内膜IR、IGF-Ⅰ表达与E2水平无相关性(P>0.05)。
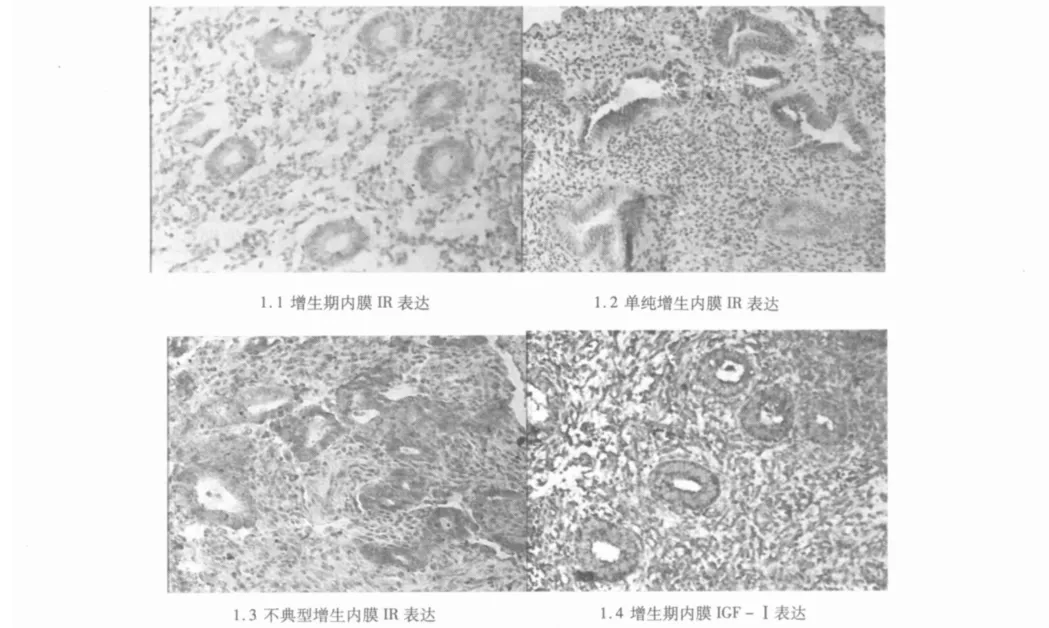
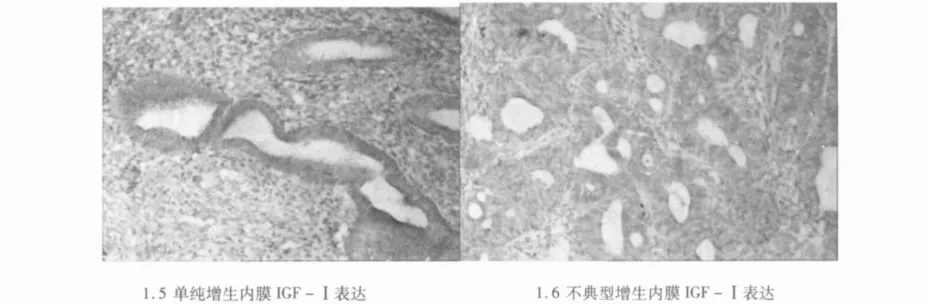
图1 IR及IGF-Ⅰ在不同子宫内膜中的表达(SP,×100)
3 讨论
3.1 IR在PCOS子宫内膜的表达及其与子宫内膜病理改变的关系
IR存在于体内几乎所有的细胞膜上,在各类细胞上的受体数差异很大。Thiet等[1]用免疫组化技术证实妊娠19周胎儿子宫内膜存在IR。Strowitzki等[2]研究显示,分泌期子宫内膜IR的数量是增生期的2倍。在无胰岛素抵抗的情况下,子宫内膜IR的表达可能受雌孕激素的调控,胰岛素对子宫内膜增殖的影响是在达到一定浓度后发挥作用的。但在胰岛素抵抗的情况下,血中高水平的胰岛素可直接调控子宫内膜IR的表达,IR与子宫内膜的异常增生相关。本研究中,子宫内膜局部IR表达与血清胰岛素水平呈正相关,提示其表达受血中胰岛素水平的调控,并提示子宫内膜局部不存在胰岛素抵抗,至少不存在受体前抵抗,是否存在受体后抵抗有待进一步研究。
IR除介导胰岛素的促生殖作用外,在肿瘤的形成和发展中也起一定的作用。IR能上调胰腺癌细胞上血管内皮生长因子(VEGF)的表达,IR底物1和2(IRS-1和IRS-2)作为IR的2个主要的下游分子,在促肿瘤血管新生中起重要作用。这2种IRS蛋白可通过几种不同的途径来调节VEGF表达[3]。在本研究中PCOS A组IR表达明显增高,进一步比较发现不典型增生及癌变内膜高于单纯及复杂型增生内膜,提示IR在PCOS子宫内膜异常增生甚至癌变中起重要作用。
3.2 IGF-Ⅰ在PCOS子宫内膜的表达及其与子宫内膜病理改变的关系
IGFs在结构和功能上与胰岛素相似,是一多功能生长因子,对细胞增殖、分化和代谢起重要作用。IGFs是具有内分泌、自分泌和旁分泌的单链多肽,既有胰岛素样合成代谢作用,又有促进生长作用,有促进细胞有丝分裂、生长和分化的作用,能够传递并调节卵巢激素对子宫内膜的作用。
子宫内膜上的IGFs、IGFs受体及其结合球蛋白主要来源于子宫内膜的局部分泌,它们共同组成了子宫内膜上IGF的自分泌和(或)旁分泌系统,参与子宫内膜生长分化的调控。在正常人子宫内膜中,IGF- Ⅰ在增生期表达较丰富[4],De Cock[5]等进行的动物实验结果表明,在单纯型增生子宫内膜中存在IGF-Ⅰ的高表达,且主要集中于腺上皮和内膜间质。表明IGF-Ⅰ有促进子宫内膜增生的作用。
IGF系统对子宫内膜癌的发生也有影响。IGF-Ⅰ与其受体IGF-Ⅰ结合后,可促进子宫内膜细胞异常增生,并借助IGF-Ⅰ环路刺激肿瘤细胞无限制增殖,维持其恶性表型。Reynolds等[6]在体外培养的子宫内膜癌细胞系中检测到IGF-Ⅰ,并发现它有刺激肿瘤细胞增殖的作用。Paveliĉ[7]等研究发现内膜癌细胞有IGF表达且表达量与肿瘤进展有关。McCampbell等[8]的研究显示,在子宫内膜增殖症及子宫内膜癌组织中IGF-Ⅰ受体的表达显著高于正常,而且分化不良的肿瘤细胞中IGF-Ⅰ受体显著高于分化良好的肿瘤细胞。本研究中A组子宫内膜IGF-Ⅰ表达明显高于B组及对照组。PCOS不典型增生及癌变内膜和单纯及复杂型增生内膜IGF-Ⅰ表达差异无统计学意义,IGF-Ⅰ在PCOS子宫内膜异常增生甚至癌变中所起作用需进一步验证。
子宫内膜上IGFs的合成及其生物学效应受雌、孕激素及胰岛素的调控。实验表明,雌激素能促进子宫内膜细胞IGF-Ⅰ的表达[9]。雌激素刺激不同种属动物子宫内膜间质细胞IGF-I mRNA表达已得到证实[10],目前一致认为,子宫内膜IGF-Ⅰ的合成主要由雌激素调控,雌激素能促进子宫内膜IGF-Ⅰ的基因表达。本研究显示正常对照组子宫内膜IGF-Ⅰ表达增生期高于分泌期,表明雌孕激素对其调节作用及其对子宫内膜的增殖作用,全部资料中子宫内膜IGF-Ⅰ表达量虽与雌激素水平无相关性,但可能与雌激素长期作用有关。
胰岛素也能刺激子宫内膜间质细胞分泌IGF-Ⅰ,胰岛素的这种刺激作用与浓度有关,高浓度胰岛素(100μU/ml)的刺激作用明显高于低浓度胰岛素(20μU/ml)。培养液中同时加入E2和胰岛素时IGF-Ⅰ的浓度高于单加E2或胰岛素时的浓度,表明雌激素和胰岛素在促进子宫内膜间质细胞分泌IGF-Ⅰ上具有协同或叠加作用。提示高胰岛素可能通过促进子宫内膜间质细胞IGF-Ⅰ的分泌刺激子宫内膜生长。本研究中子宫内膜IGF-Ⅰ表达与胰岛素水平呈正相关,表明在体内高水平胰岛素通过促进子宫内膜IGF-Ⅰ表达刺激子宫内膜增生。
综上所述,PCOS患者子宫内膜长期受雌激素刺激同时受高水平胰岛素的刺激,胰岛素及雌激素、胰岛素调控下IGF-Ⅰ可能通过IR介导导致内膜过度增生甚至癌变,临床工作中除注意拮抗雌激素作用外,还应注意发现和改善胰岛素抵抗,预防子宫内膜增生及癌变。
1 Thiet MP,Osathanondh R,Yeh J,et al.Location and timing of appearance of insulin,insulin-like growth factor-I,and their receptors in the human fetal mullerrian tract[J].Am J Obstet Gynecol,1994,170:152-156.
2 Strowitzki T,Voneye HC,Kellerer M,et al.Tyrosine kinase activity of insulin like growth faetor-I and insulin recepetor in human endom etrium during the menstrual cycle:cycle variation of insulin receptor expresslon[J].Fertil Steril,1993,59:315-321.
3 Ming LU,Shiro AM,Kazuaki MI,et al.Insulin-induced vascular endothelial growth factor expression in retina[J].Invest Ophthalmol Vis Sci,1999,40(11):3281-3286.
4 Druckmann R,Rohr UD.IGF-1 in gynaecology and obstetrics:Update 2002[J].Maturitas,2002,41(Suppl 1):S65-S83.
5 De Cock H,Ducatelle R,Tilmant K,et al.Possible role for insulinlike growth factor-I in the pathogenesis of cystic endometrial hyperplasia pyometra complex in the bitch[J].Theriogenology,2002,57(9):2271-2287.
6 Reynolds RK,Hu Chzh,Baker VV.Transforming growth factorαand insulin-like growth factor-I,but not epidermal growth factor,elicitautocrine stimulation of mitogenesis in endometrial cancer cell lines[J].Gynecol Oncol,1998,70:202-209.
7 Paveliĉ J,Radakoviĉ B,Paveliĉ K.Insulin-like growth factor 2 and its receptors(IGF 1R and IGF 2R/mannose 6-phosphate)in endometrial adenocarcinoma[J].Gynecol Oncol,2007,105(3):727-735.
8 McCampbell AS,Broaddus RR,Loose DS,et al.Overexpression of the insulin-like growth factor I receptor and activation of the AKT pathway in hyperplastic endometrium[J].Clin Cancer Res,2006,12(21):6373-6378.
9 Kashima H,Shiozawa T,Miyamoto T,et al.Autocrine stimulation of IGF-1 in estrogen-induced growth of endometrial carcinoma cells:Involvement of the MAPK pathway followed by up-regulation of cyclin D1 and cyclin E[J].Endocr Relat Cancer,2009 ,16(1):113-122.
10 李儒芝,林金芳,周剑萍.胰岛素对子宫内膜间质细胞分泌IGF-1和 IGFBP-1的影响[J].现代妇产科进展,2001,10(6):411-413.

