环介导等温扩增技术及其在动物疫病诊断中的应用
杨德全,鞠厚斌,葛菲菲,刘 健,王 建,周锦萍,刘佩红
(上海市动物疫病预防控制中心,上海 201103)
环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)是由日本学者Notomi等[1]于2000年开发的一种新型核酸扩增技术,该技术针对靶基因的6个特定区域设计4种特异引物,利用具有链置换DNA聚合酶(Bst DNA聚合酶),在60℃ ~ 65 ℃温度范围,短时间内实现对核酸的有效扩增,LAMP反应中可形成明显的白色焦磷酸镁沉淀,可通过对浊度的观察或加入荧光染料,肉眼直接颜色变化来判定反应结果。该技术具有高特异性、高效性、快速、简便、易检测等特点,已广泛应用于细菌、病毒、寄生虫等病原体的检测研究,并取得了理想的效果。本文就该技术方法及其在动物疫病检测中的应用研究进展综述如下。
1 LAMP技术原理
LAMP技术利用具有链置换活性的Bst DNA聚合酶和根据不同靶序列设计的两对特殊的内、外引物,即正向内侧引物(forward inner primer,FIP)、 正 向 外 侧 引 物(forward outer primer,F3)、反向内侧引物(backward inner primer,BIP)、 反 向 外 侧 引 物(backward inner primer,B3),特异性识别靶序列上的6个独立区域,启动循环链置换反应。在LAMP反应中,内引物杂交在目标DNA区,启动互补链合成,导致哑铃状DNA产生。这种结构很快以自身为板,进行DNA合成延伸,形成茎-环DNA结构,然后以此结构作为LAMP循环的起始结构。由于内引物杂交在茎-环的环上,引物链置换合成的DNA产生一个有缺口的茎-环DNA中间媒介,在茎上附有目标序列。再通过外引物,在茎的末端形成环状结构,结果在同一链上互补序列周而复始形成有很多环的花椰菜结构的茎-环DNA混合物,见图1。
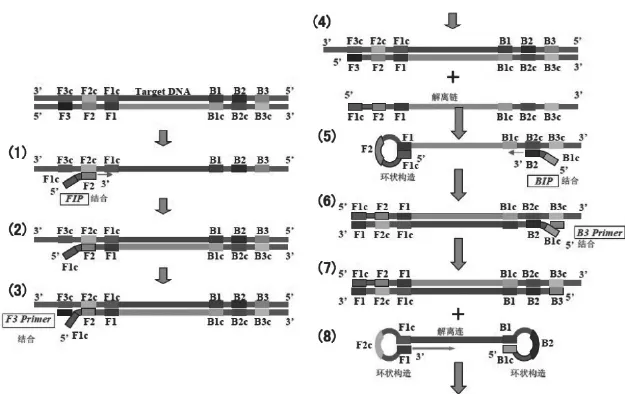
图1 LAMP反应原理图(引自北京蓝谱生物科技有限公司)Fig.1 The principle of LAMP(from BeiJingLanPu Biotech Co.,Ltd.)
2 LAMP方法在检测动物疫病中的应用
2.1 在细菌检测中的应用 Iwamoto等[2]根据分支杆菌属的保守序列16 S rDNA,设计了通用引物,还根据gyrB基因序列分别针对结核分支杆菌复合群(Mycobacterium tuberculosis Complex)、禽分支杆菌(Mycobacterium avium)和胞内分支杆菌(Mycobacterium intracellulare)设计了特异性的引物,用LAMP技术对唾液样本中的结核分枝杆菌、禽分支杆菌、胞内分支杆菌进行了检测,通过检测24株分枝杆菌和7株非分枝杆菌证实了LAMP的特异性和敏感性。
Song等[3]用LAMP技术检测了志贺菌属(Shigella)和侵入性大肠杆菌(Enteroinvasive Escherichia coli, EIEC),结果提示LAMP的敏感性高于传统PCR,扩增时间比PCR缩短一半,敏感性是PCR的100倍。
Han等[4]用LAMP技术进行牡蛎弧菌(Vibrio vulnificus)病原体的快速检测。结果表明,LAMP可检出约20 CFU的纯培养,当直接用牡蛎匀浆,LAMP检测限大约为107CFU/g,比常规的PCR敏感10倍。对包括多种弧菌属和其他细菌属在内的50株菌进行LAMP扩增,未发现假阳性或假阴性结果。
徐芊等[5]将LAMP应用于副溶血弧菌(Vibrio parahaemolyticus)的快速检测,结果表明该方法检测副溶血弧菌特异性强、灵敏度高,并且操作简便、检测成本低,在1 h内即可完成。
Maruyama等[6]将LAMP和原位杂交结合,用于检测大肠埃希菌(Escherichia coli)O157:H7的stx2基因,结果认为LAMP技术检测肠出血性大肠杆菌特异性高,敏感性好。刘全英等[7]采用LAMP技术扩增大肠杆菌O157特异性基因,并与PCR方法进行比较,结果表明建立的LAMP方法比PCR方法灵敏1000倍。用该方法检测金黄色葡萄球菌(Staphylococcus aureus)和痢疾志贺菌属,未发现假阳性,LAMP法特异性高达100%。
Hara-Kudo[8]建立了沙门氏菌(Salmonella)的LAMP检测体系,检测灵敏度达到了2.2 CFU/test tube,对鸡蛋中沙门氏菌的模拟实际检测灵敏度达到了2.8 CFU/test tube。
陈杨[9]建立了检测猪胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)的LAMP方法,针对apv Ⅳ基因序列设计引物,以APP 1~13血清型菌株以及猪产毒多杀性巴氏杆菌(Toxigenic pasteurella multocida,T+Pm)、猪源支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)、副猪嗜血杆菌(Haemophillus parasuis)制备模板,进行检测,并与Nested PCR比较。结果显示LAMP法是一种简便、灵敏、高度特异性的基因扩增法。
2.2 在病毒检测中的应用
2.2.1 对RNA病毒的检测 Dukes等[10]建立了检测口蹄疫病毒(foot-and-mouth disease virus,FMDV)的RT-LAMP方法,针对FMDV的3D蛋白聚合酶区设计引物,在同一反应管内65 ℃等温扩增1 h,在22 min内即可检测出10个拷贝的FMDV。李伟等[11]建立了快速检测小反刍兽疫病毒(peste des petits ruminants virus,PPRV)的RT-LAMP方法,结果表明,该方法比普通RTPCR灵敏性高10倍,与荧光RT-PCR的灵敏度相当。Anne-Lie等[12]应用RT-LAMP法对收集的28株猪水疱病病毒(Swine vesicular disease virus,SVDV)样本进行检测,30~60 min即可检测出阳性结果,而异种病毒FMDV和水疱性口炎病毒(vesivular stomatitisvirus,VSV)为阴性。与荧光RT-PCR比较,RT-LAMP对鼻拭子和血清的检测敏感性和荧光RT-PCR大致相当;而对粪便样本,RT-LAMP检测比荧光RT-PCR更加敏感。Chen等[13]用RT-LAMP法针对开放阅读框架的高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic porcine reproductive and respiratory syndrome,HPPRRSV)基因组进行了检测。选用10个参考株、1个临床分离株和122个阳性标本进行了测试。结果表明,该方法比套式RT-PCR(Nested PCR)法更可靠、更快捷、更灵敏。陈蕾等[14]建立了检测猪瘟病毒(Classical swine fever virus,CSFV)的RT-LAMP方法,与RT-PCR进行灵敏度试验,结果前者的灵敏度比后者高100倍,同时提取牛病毒性腹泻病毒(Bovine viral diarrhea virus, BVDV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)、猪伪狂犬病病毒(Porcine pseudorabies virus,PRV)、猪圆环病毒(Porcine circovirus , PCV)、猪细小病毒(Porcine parvovirus, PPV)等基因组进行RT-LAMP,结果均为阴性。Zhang等[15]也建立了野生型猪瘟病毒的RT-LAMP检测方法,检测最低限度为2.5 TCID50,LAMP提供了一种简便、快捷、敏感的野外检测猪瘟病毒的工具。Cho等[16]采用RTLAMP方法检测犬血液标本中犬瘟热病毒(Canine distemper virus, CDV)的NP基因,可迅速判断是否患病。CDV RT-LAMP的灵敏度是RT-PCR的100倍,最低可检测到浓度为10-1TCID50/mL的样本。
Masahiro等[17]用RT-LAMP技术检测A型和B型流感病毒的敏感性(85.5%)高于免疫层析法(75.9%),并且选择的引物可以对新型流感病毒亚型进行区分。Poon等[18]利用RT-LAMP技术建立了禽流感病毒检测方法,结果显示该方法简便快速,成本低,不需要特殊试剂而且敏感性比PCR高。Imai等[19]用RT-LAMP检测了H5N1型高致病性禽流感病毒,敏感性比一步法RT-PCR高100倍。国内李启明等[20]建立一种便捷、灵敏的RTLAMP检测方法,用于H5N1亚型AIV基因检测,结果显示,该方法可成功检测到H5N1禽流感病毒的HA、NA基因区,其灵敏度可检测到10个拷贝的RNA分子水平,与荧光RT-PCR结果呈现很好的一致性。Pham等[21]采用两步法RT-LAMP对38份新城疫病毒(Newcastle disease virus,NDV)样品进行了检测,同时与Nested PCR进行比较,结果提示,两步法RT-LAMP具有与Nested PCR同样的敏感性和特异性。Xu等[22]建立了传染性法氏囊病毒(Infectious bursal disease virus,IBDV)的RT-LAMP检测方法,通过临床样本检测,发现RT-LAMP的敏感性是RT-PCR的100倍,可广泛用于IBDV的快速诊断。
2.2.2 对DNA病毒的检测 En等[23]建立了一种快速、简便和可靠的检测伪狂犬病病毒(Porcine pseudorabies virus,PRV)LAMP方法,针对PRV DNA结 合 蛋 白(DNA-binding protein,DBP)基因设计引物,对PRV DNA样本进行10倍稀释,在63 ℃等温扩增1 h进行LAMP反应,其敏感性是PCR的100 ~ 1000倍。何逸民等[24]利用LAMP技术建立了检测猪圆环病毒2型(Porcine circovirus type 2,PCV2)的检测方法,通过临床样品的检测初步证明LAMP与PCR的检出结果符合率为100%。James等[25]用建立的LAMP方法检测非洲猪瘟(African swine fever virus,ASFV),并和荧光PCR方法比较,结果两种方法检测的结果具有一致性,而LAMP方法因易于操作、便宜等特点,更适合于有非洲猪瘟的非洲贫困地区的检测。Chen等[26]设计了针对猪细小病毒(PPV)非结构蛋白1(Nonstructural 1 protein,NS1)的4条特异性引物,建立了PPV的LAMP检测方法,实验证明,LAMP是一种简便、敏感、快速、可靠的PPV检测方法。Su等[27]建立了检测羊痘(Capripox virus,CPV)的LAMP检测方法,并与PCR和Nested PCR的检测结果进行比较,结果LAMP的敏感性是PCR的100倍,是Nested PCR的10倍。杨慧等[28]建立了一种特异性强、敏感性高的检测犬细小病毒(Canine parvovirus,CPV)的LAMP技术,其敏感性是PCR的100倍 。
此外,应用LAMP技术对流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)、对虾传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus,IHHNV)、对虾黄头病病毒(Yellow head virus,YHV)、对虾白斑综合征病毒(White spot syndrome virus,WSSV)、腮腺炎病毒(Mumps virus,MV)等也进行了检测。可见,LAMP作为一种新型核酸诊断技术,具有快速、敏感、特异、简便、结果易于判断等特点,在病毒性病原的诊断方面有着良好的应用前景。
2.3 在寄生虫检测中的应用
2.3.1 对蠕虫的检测 Nkouawa等[29]根据L组织蛋白酶样半胱氨酸肽酶(cathepsin L-like cysteine peptidase,CLP)建 立 的 绦 虫(Taenia)LAMP诊断法可以从猪带绦虫(Tenia solium)、牛带绦虫(Taenia saginata)、亚洲带绦虫(Taenia asiatica)中区分出猪带绦虫,再用限制性酶消化扩增产物,可区分牛带绦虫和亚洲带绦虫。根据细胞色素c氧化酶亚基1(cytochrome C oxidase subunit 1,COX1)基因建立LAMP可以区分3个种。实验证实,LAMP能检测到单一拷贝的目标基因,或5个亚洲带绦虫卵,其敏感度与已建立的PCR方法检测结果相似。
杨秋林等[30]用LAMP法建立一种检测日本血吸虫(Schistosoma japonicum)尾蚴的方法,该方法可检测到尾蚴的最低数量为1条。
2.3.2 对原虫的检测 Bakheit等[31]用LAMP对来自南非牛、羊、马的共270份粪检样本分别进行隐孢子虫(Cryptosporidium)检测,并与已建立的18S rRNA Nested PCR检测方法进行比较。结果发现,LAMP检测效率明显高于Nested PCR。Karanis等[32]用LAMP方法检测粪便及水样中微小隐孢子虫(Cryptosporidium parvum)的60 kDa的糖蛋白基因gp60,LAMP可检测到微小隐孢子虫卵囊的最低数量为1个,DNA水平的最低检测限为400 fg/μL,均高于PCR的灵敏度。
Kuboki等[33]建 立 了 非 洲 锥 虫(African trypanosomes)的LAMP检测方法,首次将该技术用于非洲锥虫多个亚种的检测,其敏感性是PCR方法的100倍。杨帆等[34]建立了骆驼伊氏锥虫病(Trypanosomatosis)的LAMP诊断方法,并与血液涂片检测法对比,发现LAMP明显更为敏感。
Alhassan等[35,36]以马泰勒虫(Theileria)的EMA-1基因和驽巴贝斯虫(Babesia caballi)的Bc-48基因设计引物,建立了LAMP检测方法,验证了LAMP可用于马梨浆虫病(Piroplasmosis)的早期诊断及检测。Ikadai等[37]用LAMP检测了巴贝斯虫(Babesia)对犬的感染状况,并对该方法进行了评价。结果显示该方法具有与PCR和光学显微镜同样的敏感性,提示该方法用于检测犬体内巴贝斯虫是可行的。
Sotiriadou等[38]用建立的检测水中弓形虫(Toxoplasmosis)的LAMP法与Nested PCR同时检测26个水样,结果LAMP的检出率为100%,而Nested PCR为53.8%。另用52个来自不同地区的自然水样来比较LAMP、PCR和免疫荧光试验(IFT)3种检测方法,结果LAMP弓形虫检出率为48%,Nested PCR为13.5%,而IFT则全部为阴性,表明LAMP能够快速、特异且敏感地检测水样中弓形虫的污染。国内杨秋林等[39]也根据B1基因建立了弓形虫速殖子的LAMP检测方法,可检测到的弓形虫速殖子最低浓度为2 ~ 3个/mL,表明LAMP技术在弓形虫检测中具有出较好的特异性与敏感性。
2.4 在支原体检测中的应用 Saito等[40]用LAMP法对肺炎支原体(Mycoplasma pneumoniae)进行检测,并与实时定量PCR进行对比,经过60 min的反应,结果显示LAMP法检出限值为200个拷贝,而实时定量PCR法为20个拷贝。用限制性核酸内切酶AluⅠ酶切消化分析确认结果的准确性,两种方法的阳性样本检出率完全一致。
3 LAMP技术特点
作为一种新型的扩增方法,与其它常用的生物学扩增技术相比,LAMP法具有很多优点。第一,操作简便、耗时短、成本低:LAMP通常只需在恒温水浴锅中几十分钟即可完成,不需要特殊试剂,不需要预先进行双链DNA的变性。第二,特异性强:4条引物分别针对6个不同的区段,并且这6个区段的顺序也有规定。理论上LAMP法扩增的特异性很高,因此可以根据是否扩增就能判断目标基因的存在与否,即能够进行细菌或病毒的定性检测。并且LAMP能够区分同一病原体的不同血清型,如对人流感病毒和人疱疹病毒等病毒的研究结果显示,LAMP能对多血清型的同一病原体进行定型而没有出现假阳性。第三,扩增效率高:LAMP 45~60 min内可扩增109~1010倍。第四,灵敏度高:扩增模板可达10拷贝亦或更少。第五,RNA扩增步骤简单:LAMP扩增RNA只要在DNA基因扩增试剂的基础上加上逆转录酶,就能够完全像DNA基因扩增那样,一步实现RNA扩增。第六,LAMP可以直接从扩增产物中分离到单链DNA分子。第七,LAMP在检测细菌时,无需分离培养细菌,可直接提取感染动物组织基因组进行扩增。第八,LAMP结果易于判定,不需要对产物进行电泳,而直接用肉眼观察扩增管浊度,或通过向其扩增产物中添加荧光染料通过颜色变化来判定结果。
但LAMP也存在一定的局限性。首先,LAMP对于引物设计要求很高,需要设计的引物数目多,结构复杂;其次,LAMP的阳性反应并不只呈现单条带,而出现拖尾和一些低分子质量的带,一旦产生非特异性扩增,则不易鉴别。最后,LAMP扩增产物不能够进行测序,克隆和表达,最大的用途就是用于病原微生物的快速检测。
4 结语
LAMP是一种快速高效的实验技术。与PCR相比,它的整个反应过程均在恒温(一般选用60 ℃、63 ℃以及65 ℃者较多)条件下进行,不需要PCR所必需的精密温度循环装置;所用设备简单、花费少;并且由于该方法的简单易行能满足动物疫病快速检测的需要,这在很大程度上提高了LAMP的使用价值,比PCR更具推广性,特别适用于基层养殖场、区县动物疫病预防控制中心等基层单位,将会有更广阔的应用前景。目前,国内外已有包括检测禽流感病毒在内的几十种试剂盒研发成功并出售,试剂盒的商业化和国产化,使检测试剂的成本下降,更有利于该技术在基层的的推广与普及。
总之,LAMP技术作为一种便捷、高特异性、高灵敏度的新型核酸扩增方法,虽然还存在着某些不足,但伴随着它的不断发展与改进,必将在动物传染病病原学诊断方面发挥举足轻重的作用。
[1]Notomi T, Okayama H, Masubuchi H, et al. Loopmediated isothermal amplification of DNA[J]. Nucleic Acids Ices, 2000, 28(12): E63.
[2]Iwamoto T, Sonobe T, Hayashi K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex, M. avium and M.intracellulare in sputum samples[J]. J Clin Microbial, 2003,41(6): 2616-2622.
[3]Song T, Toma C, Nakasone N, et al. Sensitive and rapid detection of Shigella and enteroinvasive Escherichia coli by a loop-mediated isothermal amplification method [J].FEMS Microbiol Lett, 2005, 243(1): 259-263.
[4]Han F F, Ge B. Evaluation of a loop-mediated isothermal amplification assay for detecting Vibrio vulnificus in raw oysters[J]. Foodborne Pathog Dis, 2008, 5(3): 311-320.
[5]徐芊, 孙晓红, 赵勇, 等. 副溶血弧菌LAMP检测方法的建立[J].中国生物工程杂志, 2007, 27(12): 66-72.
[6]Maruyama F, Kenzaka T, Yamaguchi N, et al. Detection of bacteria carrying the stx2 gene by in situ loop-mediated isothermal amplification[J]. Appl Environ Microbiol, 2003,69(8): 5023-5028.
[7]刘全英, 李延武, 高霞. 环介导恒温扩增技术快速检测大肠杆菌O157特异基因的建立[J]. World Health Digest,2007, 4(7): 59-61.
[8]Hara-Kudo Y, Yoshino M, Kojima T, et al. Loopmediated isothermal amplification for the rapid detection of Salmonella[J]. FEMS microbiology letters. 2005,253(1): 155-161.
[9]陈杨. 胸膜肺炎放线杆菌血清10型弱毒株的构建和环介导的APPapxIV恒温扩增方法的建立[D]. 武汉: 华中农业大学, 2007.
[10]Dukes J P, King D P, Alexandersen S. Novel reverse transcrip tion loop-mediated isothermal am plification for rapid detection of foot-and-mouth disease virus[J].Arch Virel, 2006(6): 1093-1106.
[11]李伟, 李刚, 范晓娟, 等. 快速检测小反刍兽疫病毒RT-LAMP方法的建立[J].中国预防兽医学报, 2009,31(5): 374-377.
[12]Anne-Lie B, Mikhayil H, Scott M R, et al. A onestep reverse transcriptase loop-mediated isothermal amplification assay for simple and rapid detection of swine vesicular disease virus[J]. J Virological Methods,2008, 147: 188-193.
[13]Chen H T, Zhang J, Sun D H, et al. Reverse transcription loop-mediated isothermal amplification for the detection of highly pathogenic porcine reproductive and respiratory syndrome virus[J]. J Virological Methods, 2008, 153:266-268.
[14]陈蕾, 范学政, 王琴, 等. 中国畜牧兽医学会2008年学术年会暨第六届全国畜牧兽医青年科技工作者学术研讨会论文集[C]. 广州: 中国畜牧兽医学会, 2008, 209-213.
[15]Zhang X J, Sun Y, Liu L H, et al. Validation of a loopmediated isothermal amplification assay for visualised detection of wild-type classical swine fever virus[J]. J Virological Methods, 2010, 167: 74-78.
[16]Cho H S, Park N Y. Detection of canine distemper virus in blood samples by reverse transcription loop-mediated isothermal amplification[J]. J Vet Med B Infect Dis Vet Public Health, 2005, 52(9): 410-413.
[17]Masahiro I, Masahiro W, Naoko N, et al. Rapid detection and typing of influenza A and B by loop-mediated isothermal amplification: Comparison with immunochromatography and virus isolation[J]. J Virol Methods, 2006, 135(2):272-275.
[18]Poon L L, Leung C S, Chan K H, et al. Detection of human influenza A viruses by loop-mediated isothermal amplification[J]. J Clin Microbiol, 2005, 43 (1): 427-430.
[19]Imai M, Ninomiya A, Minekawa H, et al. Development of H5-RT-LAMP (loop-mediated isothermal amplification)system for rapid diagnosis of H5 avian influenza virus infection[J]. Vaccine, 2006, 24(44): 6679-6682.
[20]李启明, 侯云德. 逆转录环介导等温核酸扩增技术(RTLAMP)在H5N1禽流感病毒基因检测中的应用[J]. 病毒学报, 2008, 24(3): 178-207.
[21]Pham H M, Nakajima C, Ohashi K, et al. Loop-mediated isothermal amplification for rapid detection of Newcastle disease virus[J]. J Clin Microbiol, 2005, 43(4): 1646-1650.
[22]Xu J T, Zhang Z, Yin Y, et al. Development of reversetranscription loop-mediated isothermal amplification for the detection of infectious bursal disease virus[J]. J Virol Methods, 2009, 162(1-2): 261-271.
[23]En F X, Wei X, Jian L, et al. Loop-mediated isothermal amplification establishment for detection of pseudorabies virus[J]. J Virological Methods, 2008, 151(1): 35-39.
[24]何逸民, 邹国秋, 罗玉均, 等. 中国畜牧兽医学会2008年学术年会暨第六届全国畜牧兽医青年科技工作者学术研讨会论文集[C]. 广州: 中国畜牧兽医学会, 2008,335-336.
[25]James H E, Ebert K, McGonigle R, et al. Detection of African swine fever virus by loop-mediated isothermal amplification[J]. J Virol Methods, 2010, 164(1-2): 68-74.
[26]Chen C M, Cui S J. Detection of porcine parvovirus by loop-mediated isothermal amplification[J]. J Virol Methods, 2009, 155(2): 122-125.
[27]Tsai S M, Chan K W, Hsu W L, et al. Development of a loop-mediated isothermal amplification for rapid detection of or f virus[J]. J Virol Methods, 2009, 157:200-204.
[28]杨慧, 曲光刚, 赵元楷, 等. 犬细小病毒LAMP检测方法的建立[J]. 中国预防兽医学报, 2010, 32(7): 550-553.
[29]Nkouawa A, Sako Y, Nakao M, et al. Loop-mediated isothermal amplification method for differentiation and rapid detection of Taenia species[J]. J Clin Microbiol,2009, 47(1): 168-174.
[30]杨秋林, 许丽芳, 张愉快, 等. 环介导等温扩增技术检测日本血吸虫尾蚴的实验研究[J]. 中国血吸虫病防治杂志, 2008, 20(3): 209-211.
[31]Bakheit M A, Torra D, Palomino L A, et al. Sensitive and specific detection of Cryptosporidium species in PCR-negative samples by loop-mediated isothermal DNA amplification and confirmation of generated LAMP products by sequencing[J]. Vet Parasitol, 2008, 158(1-2):11-22.
[32]Karanis P, Thekisoe O, Kiouptsi K, et al. Development and preliminary evaluation of a loop-mediated isothermal amplification procedure for sensitive detection of Cryptosporidium oocysts in fecal and water samples[J].Appl Environ Microbiol, 2007, 73(17): 5660-5662.
[33]Kuboki N, Inoue N, Sakurai T, et al. Loop-mediated isothermal amplification for detection of African trypanosomes[J]. J Clin Microbiol, 2003, 41(12): 5517-5524.
[34]杨帆, 王振宝, 王常汉, 等. 骆驼伊氏锥虫病LAMP实验诊断初报[J].中国兽医寄生虫病, 2008, 16(3): 23-25.
[35]Alhassan A, Thekisoe OM, Yokoyama N, et al.Development of loop-mediated isothermal amplification(LAMP)method for diagnosis of equine piroplasmosis[J].Vet Parasitol, 2007, 143(2): 155-160.
[36]Alhassan A, Govind Y, Tam NT, et al. Comparative evaluation of the sensitivity of LAMP, PCR and in vitro culture methods for the diagnosis of equine piroplasmosis[J].Parasitol Res, 2007, 100(5): 1165-1168.
[37]Ikadai H, Tanaka H, Shibahara N, et al. Molecular evidence of infections with Babesia gibsoni parasites in Japan and evaluation of the diagnostic potential of a loop-mediated isothermal amplification method[J]. J Clin Microbiol, 2004, 42 (6): 2465-2469.
[38]Sotiriadou I, Karanis P. Evaluation of loop-mediated isothermal amplification for detection of Toxoplasma gondii in water samples and comparative findings by polymerase chain reaction and immunofluorescence test(IFT)[J]. Diagn Microbiol Infect Dis, 2008, 62(4): 357-365.
[39]杨秋林, 张如胜, 伍和平, 等. 应用环介导等温扩增技术检测弓形虫[J]. 中国寄生虫学与寄生虫病杂志,2008, 26(4): 304-306.
[40]Saito R, Misawa Y, Moriya K, et al. Development and evaluation of a loop-mediated isothermal amplification assay for rapid detection of Mycoplasma pneumoniae[J].J Med Microbiol, 2005, 54(Pt 11): 1037-1041.

