山东部分地区3型鸭疫里氏杆菌感染流行病学调查
李 婧,魏淑英,杨建伟,刘军河,朱瑞良
(1.山东畜牧兽医职业学院,潍坊261061;2. 山东省潍坊市畜牧局,潍坊 261061;3.山东省寿光市畜牧局,寿光262725; 4.山东省淄博市动物卫生监督所,淄博255026;5.山东农业大学动物科技学院,泰安271018)
鸭传染性浆膜炎是由鸭疫里氏杆菌(Riemerella anatipestifer,RA)引起的一种接触性、急性或慢性传染病,主要病理变化是纤维素性心包炎、肝周炎、气囊炎、脑膜炎等,发病率及病死率高[1],且耐过鸭多成为僵鸭,生长迟缓[2],造成极大的经济损失。山东潍坊及邻近地区肉鸭养殖量大,而鸭传染性浆膜炎对1~8周龄的雏鸭都易感[1],几乎发生于肉鸭养殖的全过程[3],是目前危害肉鸭养殖业的重要传染病之一。
本次试验选择本课题组分离鉴定的3型RA制备兔抗3型RA高免血清和平板凝集诊断抗原,采用平板凝集试验对来自山东部分地区的RA进行血清型的初步鉴定,并对养殖量较大的几个县、市、区鸭群进行3型RA感染情况的血清学调查,以了解山东省上述地区3型RA感染的发生和流行现状,为鸭传染性浆膜炎的防治提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 WC6株RA为本实验室分离、鉴定后保存的菌株,血清型鉴定为3型[2]。
1.1.2 病料 2010年3月至10月收集来自山东畜牧兽医职业学院禽病门诊的鸭传染性浆膜炎疑似病例共93份,分布于潍坊各县、市、区及临近地区,品种主要为樱桃谷肉鸭,日龄均为5~30 d。剖检有纤维素性心包炎、肝周炎、气囊炎、脑膜炎等病变,取其脑、心血、肝脏作为被检病料。
1.1.3 血清 待检血清372份,采集自寿光、昌乐、昌邑、青州、潍城、寒亭、临朐、临淄、高青等县、市、区13个鸭场,均未免疫过任何血清型RA,离心分离获得血清;RA1型、2型的阳性血清由山东省农科院家禽研究所惠赠;鸡白痢沙门氏菌阳性血清购自哈尔滨兽医研究所。
1.1.4 实验动物 实验用家兔购自潍坊某养殖场,健康、体壮。
1.1.5 主要仪器 超净工作台SW-TC-2A型购自上海博迅实业有限公司;高速台式离心机TGL-16G购自上海安亭科学仪器厂;低速台式离心机80-2B型购自上海安亭科学仪器厂;电热恒温培养箱HH.B11购自潍坊医疗器械厂。
1.1.6 主要试剂 巧克力、鲜血、TSA等琼脂平板培养基为本实验室自制;肠杆菌科细菌生化常规鉴定管购自杭州天和微生物试剂有限公司;结晶紫溶液为本实验室自制。
1.2 方法
1.2.1 RA的分离 无菌操作取病死鸭的心血、脑、肝等病料接种于巧克力营养琼脂平板,置烛缸内37 ℃培养24~48 h,观察细菌的生长情况、菌落特征,并取疑似菌落进行纯培养。
1.2.2 分离菌的鉴定
1.2.2.1 形态及染色特性 病料触片、美蓝染色后,油镜下观察;挑取巧克力琼脂平板上疑似RA菌落涂片、经革兰氏染色,油镜下观察。
1.2.2.2 培养性状观察 将疑似菌株分别接种于TSA琼脂平板、鲜血琼脂平板、普通营养琼脂平板、麦康凯琼脂平板等,置烛缸内37 ℃培养24 h,观察生长情况、菌落特征及溶血情况等。
1.2.2.3 生化试验 挑取TSA琼脂平板、鲜血琼脂平板上纯化的疑似RA菌株,分别接种于各种生化试验微量鉴定管37℃培养3~4 d。鉴定项目包括葡萄糖、乳糖、麦芽糖、蔗糖、甘露醇、卫茅醇、鼠李糖、蕈糖、水杨素、棉子糖、肌醇、侧金盏花糖、鸟氨酸脱羧酶、赖氨酸脱羧酶、精氨酸双水解酶、苯丙氨酸脱氨酶、明胶液化、尿酶。
1.2.2.4 PCR鉴定 根据Genbank公布的RA OmpA基因序列,应用Primer 5.0引物设计软件,在其保守区设计特异性引物,可扩增出412 bp的DNA片段,引物由上海生工生物工程有限公司合成, P1: 5'-ACTCAATTTCTCAGGCGTAG-3';P2: 5'-AGTGAGTTGCCCATCTC -3'。以 WC6株、大肠杆菌分别设为阳性、阴性对照。
1.2.3 标准及待检菌株抗原的制备
1.2.3.1 兔抗RA免疫原的制备 将WC6株RA接种于巧克力琼脂平板培养24 h,用灭菌生理盐水洗下制成菌悬液;稀释菌液,使其含菌数约为2×1010CFU/mL,加入0.3%福尔马林灭活,37 ℃温箱24 h后,即可作为制备高免血清的抗原。取抗原按一定比例与油相乳化成油乳剂,作为制备高免血清的油苗[4-6]。
1.2.3.2 平板凝集诊断抗原制备及检测 将WC6株RA密集划线接种于巧克力琼脂平板上,于37 ℃培养24 h。用灭菌生理盐水洗下菌苔,充分混匀后,用稀释滴种法进行细菌计数[5],然后加入终浓度0.4%福尔马林,37 ℃放置48 h,期间多次振荡使其充分灭活。6000×g离心15 min,取沉淀菌体,用灭菌生理盐水洗涤3次。加入结晶紫溶液(使终浓度为0.001%~0.002%),室温着染30 min,6000×g离心15 min。取沉淀菌体,用灭菌生理盐水洗涤5次,再以生理盐水稀释成约50亿/mL,加终浓度0.01%硫柳汞和0.2%甲醛,4 ℃保存备用[7]。
用接种环钩取一环染色抗原液,在巧克力营养琼脂培养基上划线,置37 ℃恒温箱培养24 h,观察有无细菌生长。
将一滴染色抗原滴在载玻片上,轻轻振摇几次,静置4 min,观察液滴是否均匀一致,有无自凝现象。分别将RA染色抗原与未经稀释的RA1型、2型、阳性血清、鸡白痢沙门氏菌阳性血清进行平板凝集试验,观察有无凝集现象。
1.2.3.3 琼扩抗原的制备 将WC株RA及分离获得的各待检菌株分别在巧克力琼脂平板上密集划线,分别用含0.3%甲醛的PBS洗下一个平板(9 cm)上的细菌,经沸水浴1 h后,4000×g,20 min,离心取上清液。
1.2.4 兔抗RA阳性血清的制备及检测 取4只健康青年大耳家兔,首免使用1.2.3.1制备的油乳剂苗皮下多点注射,2 mL/只;7 d后二免,油乳剂抗原皮下多点注射,3 mL/只;7 d后三免,水剂抗原肌肉注射,4 mL/只。三免后7~10 d,采血分离血清[8]。用玻片凝集试验与琼扩试验检测血清效价。
1.2.5 分离菌株血清型的鉴定 用平板凝集试验与琼扩试验进行检测。
平板凝集试验:取洁净载玻片,滴一滴蒸馏水,用接种环沾取分离获得的RA纯培养物,于蒸馏水中混匀,滴加未稀释的3型兔抗RA阳性血清一滴,将载玻片轻轻反复摇动,或用接种环涂开,3~5 min后观察结果,出现清晰的乳白色絮状凝集块者为阳性,反之则为阴性[4]。
琼脂扩散试验:琼扩板中NaCl和琼脂糖的最终浓度分别为8.5%和0.9%,打梅花孔,阳性血清加在中央,抗原加在外周孔,置37 ℃湿盒中24 h后,观察记录结果[4]。
1.2.6 血清样品中3型RA抗体的检测 将平板凝集诊断抗原与采集血清样品作平板凝集试验,测其感染率。
2 结果
2.1RA的分离鉴定结果 在收集的93份病料中,共分离获得细菌88株,其中RA39株,阳性率41.9%,占细菌总数的44.3%;此外大肠杆菌41株,与RA混合感染率为35.9%(14/39),沙门氏菌8株,与RA混合感染率为20.5%(8/39)。
RA经24 h厌氧培养后,在巧克力、TSA、鲜血营养琼脂平板上均生成直径约1 mm的乳白色半透明露滴状细小菌落,连续传代后菌落逐渐变大,在鲜血琼脂上不溶血,在普通琼脂平板不生长(见图1、2)。美蓝染色小球杆状,两端着色深,有的位于细胞浆内;革兰氏染色阴性、球杆状、多单在(见图3、4)。

图1 RA在巧克力营养琼脂上生长形态Fig. 1 The growth form of RA in chocolate agar

图2 RA在鲜血琼脂上生长形态Fig. 2 The growth form of RA in blood agar

图3 肝脏触片,美蓝染色(×1000)Fig. 3 Liver with methylene blue staining (×1000)
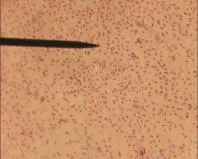
图4 RA纯养物,革兰氏染色(×1000)Fig. 4 The culture of RA with gramstaining (×1000)
各分离株生化试验结果不尽相同,其中较为一致的是苯丙氨酸脱氨酶阴性,对糖的分解活性都不强,个别的发酵一种或两种糖,表现出弱阳性,也有的在培养几天后又转阴。
PCR扩增产物经1%琼脂凝胶电泳,均得到412 bp目标片段(图5)。
2.2 平板凝集诊断抗原质量检验 无细菌污染、无自凝现象,与RA血清1型、2型阳性血清无交叉反应,特异性强,符合诊断抗原的质量标准。

图5 RA部分菌株OmpA基因片段PCR扩增结果Fig. 5 PCR for OmpA of some strains of RA
2.3 兔抗3型RA阳性血清检测 与WC6株菌液反应玻片凝集试验为强阳性,琼扩试验效价在1:16以上。
2.4 分离RA的血清型检测 在分离获得的39株RA中,其中3型19株,占RA分离总数的48.7%。
2.5 血清样品中3型RA抗体的检测 经检测在372份鸭血清样品中,抗WC6株RA抗体阳性81份,总阳性率21.7%。样品抗体阳性率检测结果见表1和表2。
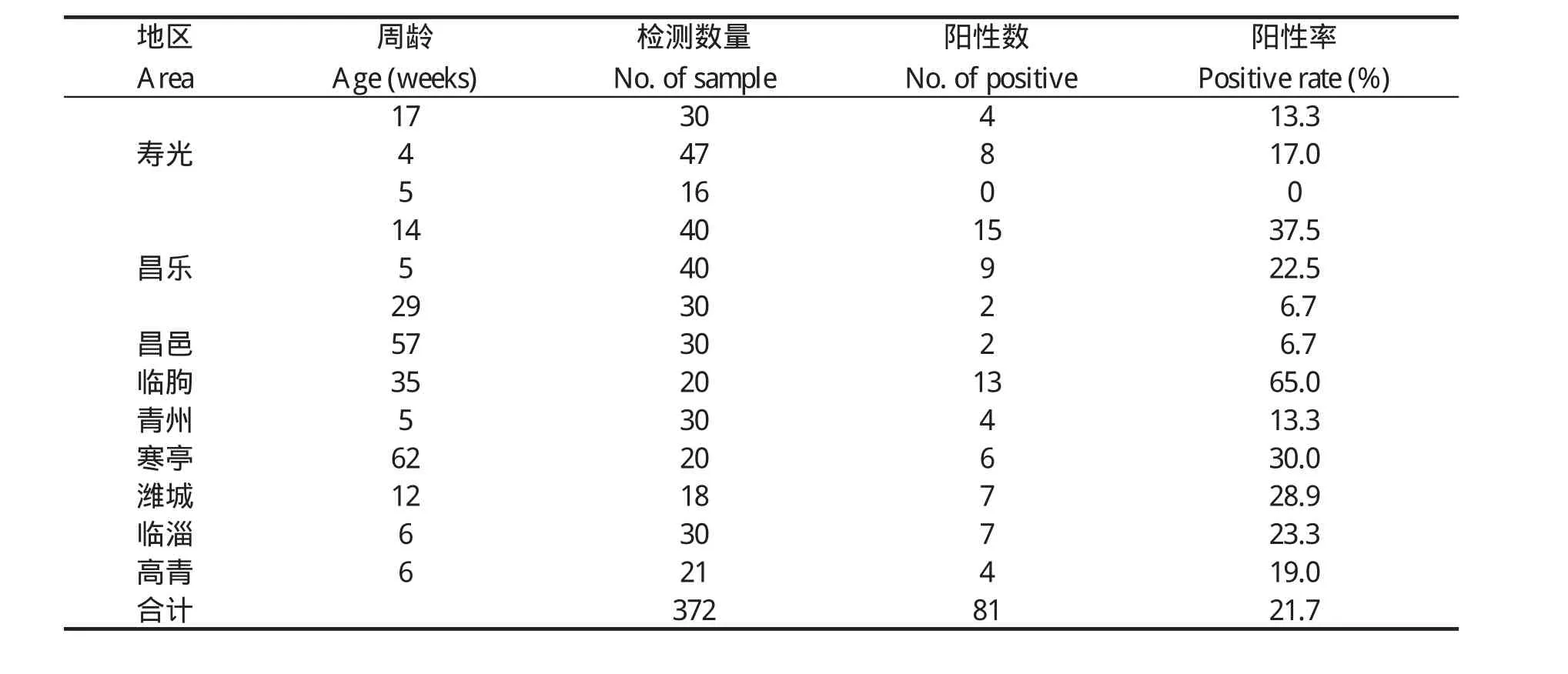
表1 潍坊部分地区鸭群3型RA抗体阳性率Table 1 The antibody positive rate against serotype 3 RA in duck from part area of Weifang, Shandong

表2 不同周龄鸭群3型RA抗体阳性率Table 2 The antibody positive rate against serotype 3 RA in duck of different ages
3 讨论
3.1 山东省已报道的RA血清型有1型、2型、3型、7型、8型等, 其中血清1型和2型为主要血清型[7],但本次试验结果显示,血清3型RA在山东潍坊地区鸭群中感染较为普遍,在发病鸭群中占细菌分离总数的29.4%(19/68),占RA分离总数的48.7%(19/39)。血清样品检测总阳性率21.7%,个别鸭群阳性率达到65.0%,感染率相对较高,且在采样的各个县、市、区的鸭群中都有分布,说明血清3型RA在潍坊及邻近地区的分布广泛,危害加重,逐渐成为山东省的优势血清型。
3.2 本次调查采用平板凝集试验,该方法操作简便快速,适于鸭群的定性检疫,常温下2~3 min即可检测结果,但反应的敏感性相对较低[2]。有报道用间接ELISA方法72 h即可检出RA抗体,而凝集试验直到d 9才出现阳性[12,13]。RA主要感染1~8周龄的雏鸭,感染后在鸭体内产生的免疫较弱,10~14 d才可产生低凝集效价[2],故雏鸭阶段的检出率(17.4%)可能会比实际感染率低。超出易感日龄的成年鸭很少再发病,但雏鸭阶段的感染及环境的污染,使部分鸭成为带菌鸭,随着免疫系统的逐渐完善及带菌状态的持续刺激,使该病的阳性率在成鸭阶段反而上升(26.1%)。
3.3 鸭传染性浆膜炎临床特征与鸭败血型大肠杆菌病相似,都表现纤维素性渗出性浆膜炎,单纯依赖临床诊断难以区别[8]。临床很多人将表现为纤维素性心包炎、肝周炎、气囊炎的病例统称为“浆膜炎”,因此,临床门诊“浆膜炎”的发病率远远高于血清学调查的结果。本次调查发现临床表现为“三炎”变化的病倒,细菌分离结果可能为大肠杆菌、RA、两者混合感染、少数还有沙门氏菌与两者的混合感染,有时甚至三重感染。其中RA与大肠杆菌混合感染的情况较为普遍,占RA分离率的35.9%(14/39),这给临床诊断与防治带来较大困难。在进行分离培养与药敏试验时,应同时考虑到这两种细菌,选择合适的培养基与药物进行试验。
3.4 很多研究表明疫苗免疫可产生有效保护[11,12],但RA血清型众多,不同血清型间交叉保护率低,对于一些鸭养殖量大、鸭苗引进途径多的地区,往往有多种血清型同时流行,故疫苗选择必须在了解当地RA血清型流行情况的基础上,选择优势血清型制备疫苗进行预防。本次调查结果提示,山东省潍坊及临近地区3型RA流行较为广泛,所以在进行鸭传染性浆膜炎的疫苗免疫时,除选择1型、2型等传统优势血清型外,还应考虑选择使用含3型RA的多价苗。
[1]卡尔尼克B W.禽病学 [M]. 高福主译. 10版. 北京: 中国农业社, 1999.
[2]李婧, 朱瑞良, 李舫, 等. 山东地区3型鸭疫里氏杆菌的分离鉴定及主要生物学特性研究[J]. 中国动物传染病学报, 2009, 17(3): 49-54.
[3]邓舜洲, 何后军, 温庆琪, 等. 鸭疫里氏杆菌(2型)灭活疫苗的研制[J]. 江西农业大学学报(自然科学版), 2002,24(5): 569-573.
[4]张大丙, 郭玉璞. 我国鸭疫里氏杆菌血清型的鉴定[J]. 畜牧兽医学报, 1999, 30(6): 536-542.
[5]姜平. 兽医生物制品学[M]. 2版. 北京: 中国农业出版社,2003.
[6]姚火春. 兽医微生物学实验指导[M]. 北京: 中国农业出版社, 2001.
[7]郑立森, 范光勤, 李舫, 等. 山东鸭疫里氏杆菌血清型鉴定及免疫防制[J].畜牧与兽医, 2005, 37(8): 46-47
[8]王红宁. 禽呼吸系统疾病[M]. 北京: 中国农业出出版社,2002.
[9]胡清海, 李刚, 郑明球, 等. 间接ELISA检测鸭疫里氏杆菌抗体的研究[J]. 中国预防兽医学报, 1998, 20(6): 352-356
[10]吴彩艳, 覃宗华, 袁建丰, 等. 广东地区鸭疫里氏杆菌的血清型及抗药性情况调查[J]. 畜牧与兽医, 2009,41(5): 22-25.
[11]田树飞, 李子平. 鸭疫里默氏杆菌病原与防治研究进展[J]. 安徽农业科学, 2007, 35(20): 6150-6151.
[12]李春芬, 李郁, 魏建忠, 等. 鸭疫里氏杆菌病研究进展[J]. 动物医学进展, 2007, 28 (8): 64-67.
[13]钟登科, 魏建超, 张训海, 等. 鸭疫里氏杆菌的分离鉴定及药敏试验[J]. 畜牧与兽医, 2008, 40(7): 86-88.
[14]吴芳, 周红, 蔡建平, 等. 1株无致病力的鸭疫里氏杆菌的分离及鉴定[J]. 畜牧与兽医, 2007, 39(9): 13-15
[15]张福官, 沈政会, 陈建红, 等. 鸭传染性浆膜炎的研究进展[J]. 安徽农学通报, 2010, 16(4): 52-55.
[16]胡桂学. 兽医微生物学实验教程[M]. 北京: 中国农业大学出版社, 2006.
[17]程安春, 汪铭书, 陈孝跃, 等. 我国鸭疫里默氏杆菌血清型调查及新血清型的发现和病原特性[J]. 中国兽医学, 2003, 23(4): 320-323.
[18]Subramaniam S, Huang B, Loh H , et al. Characterization of a predominant immunogenic outer membrane protein of Riemerella anati pesti fer [J]. Clin Diagn Lab Immunol,2000, 7 (2): 168-174.
[19]Huang B, Subramaniam S, Frey J, et al. Vaccination of ducks wit h recombinant outer membrane protein (OmpA)and a 41 kDa partial protein ( P45N’)of Riemerel la anati pesti fer [J].Vet Microbiol, 2002, 84 (3): 219-230.
[20]Tsai H J, Liu Y T, Tseng C S, et al. Genetic variation of the ompA and 16S rRNA genes of Riemerella anati pestifer [J].Avian Pathol, 2005, 34 (1): 55-64.

