日本血吸虫基因重组抗原rSj06868对小鼠的免疫保护效果
王素娟,刘金明,邢荣鹤,石耀军,金亚美,李 浩,林矫矫
(中国农业科学院上海兽医研究所 国家防治动物血吸虫病专业实验室 农业部动物寄生虫学重点开放实验室,上海 200241)
日本血吸虫病是典型的人畜共患病,迄今仍是我国重要的公共卫生问题之一。患病家畜特别是病牛是我国血吸虫病的主要传染源[1,2]。我国从20世纪50年代开始大规模的血吸虫病防治,先后实施了以灭螺为主的综合防治对策、以化疗为主结合易感地带灭螺和以控制传染源为主的综合防治策略[3]。现在,广东、上海、福建、广西、浙江等5个省(市区)已阻断了血吸虫病传播,四川省、云南省达到了血吸虫病传播控制目标。但由于影响血吸虫病流行的社会、自然因素未得到根本改变,特别是社会经济的发展,以前一些行之有效的措施如大规模的化学药物灭螺难以继续实施,加之家畜血吸虫病重复感染严重,单靠药物治疗难以根除血吸虫病,因此研制家畜抗日本血吸虫疫苗是控制血吸虫病的重要策略。目前虽然已筛选到一些有潜力的候选疫苗分子,但它们所产生的抗日本血吸虫抗性不能达到现场防治的要求[3],仍然需要继续寻找有效的候选疫苗分子。本课题组在前期工作中利用东方田鼠血清、肝脏和肺脏裂解物筛选44 d日本血吸虫噬菌体展示cDNA文库,获得多个可能与东方田鼠抗性相关靶基因阳性噬菌体克隆[5-7],并对获得的部分阳性噬菌体克隆的免疫效果进行了观察[8,9],发现日本血吸虫假想蛋白SJCHGC068068的噬菌体展示抗原诱导了24.28%的减虫率以及45.52%肝脏虫卵减少率。为进一步探索该蛋白作为抗血吸虫候选疫苗分子的可能性,本文对其编码基因(暂命名为Sj06868)进行克隆、表达,并对表达产物的免疫效果进行了实验观察。
1 材料和方法
1.1 材料
1.1.1 实验动物、质粒及菌株 感染日本血吸虫中国大陆株安徽品系的阳性钉螺购自于江苏省血吸虫防治研究所,以光照法孵出尾蚴;6~7周龄周龄SPF级雄性BALB/c小鼠购于上海斯莱克实验动物中心;新西兰白兔( 雄性, 2.5~3.0 kg )购自上海罗泾飞达实验动物养殖场;质粒pET32a、大肠杆菌Rosetta(DE3)由本实验室提供。
1.1.2 主要试剂 His Bind Kit购自Novagen公司;TRIzol Reagent为上海英骏生物公司产品;cDNA反转录试剂盒、限制性内切酶、T4连接酶、蛋白分子量标准、DNA 分子量标准DL2000/DL15000购自宝生生物工程(大连)有限公司;预染蛋白分子量标准PageR μlerTMPrestained Prorein Ladder为Fermentas产品;HRP-山羊抗鼠购自Sigma公司; 206佐剂由法国赛比克公司馈赠;DNA纯化试剂盒(Gel/Gel PCR DNA Fragments Extraction Kit) 为Geneaid Biotech公 司 产 品;Plasmid Minipreps Purification Systems质粒DNA小量快速提取试剂盒为BioDev产品,购自德普生物科技(北京)有限公司;佐剂ESSAIISA 206 CELL由Seppic公司赠送。
1.2 实验方法
1.2.1 引物设计与合成 参照NCBI登录的日本血吸虫SJCHGC06868蛋白编码基因的核苷酸序列,利用排primer 5.0软件,设计引物,分别在上、下游引物的5'端插入BamH I和Xho I酶切位点(下划线部分),上游引物为:CT GGATCC ATG CTG GAA CAA ACA CGC,下游引物为:AG CTCGAGA CTA ATC TCC TCC CCC GCG AA。引物由上海英俊生物技术有限公司合成。
1.2.2 目的基因的克隆 以腹部贴片法按2000条尾蚴感染剂量感染新西兰白兔,于感染后7、14、42 d剖检,以肝门静脉灌注法收集肝期童虫。按TRIzol试剂盒、反转录试剂盒说明书提取总RNA并合成反转录cDNA。以反转录cDNA为模板进行PCR扩增,反应条件为:94 ℃预变性 3 min;94 ℃ 变性 30 s,55 ℃ 退火 15 s,72 ℃ 延伸1 min,35个循环;72 ℃再延伸10 min。根据QIANGENE试剂盒的说明书从电泳胶中回收纯化PCR产物。将纯化的PCR产物以及质粒pET32a分别用BamH I和XhoI双酶切,分离目的基因片段和线性化载体DNA,用T4连接酶连接,构建重组质粒pET32a-Sj068068并转化大肠杆菌Rosetta(DE3)。用含有0.5 μg/mL氨苄青霉素、0.34 μg/mL氯霉素的LB固体培养基铺斑,挑取单克隆菌落,加入含相同抗生素的LB液体培养基扩大培养,小量制备质粒DNA,用BamH I和Xho I双酶切方法鉴定为阳性克隆后,送上海英骏生物技术有限公司测序验证。
1.2.3 重组质粒的诱导表达 用含有0.5 μg /mL氨苄青霉素、0.34 μg /mL氯霉素的LB培养基进行表达菌的培养和蛋白表达。将测序正确的阳性菌液接种置于5 mL 培养基中,37℃、250 r/min摇床过夜培养。次日取500 μL培养菌液接种到5 mL含培养基中,震荡培养2~3 h,再将5 mL的新鲜菌液加入到1 L培养基中,加入20% IPTG使其终浓度为1 mmoL/L,继续培养4~5 h,4 ℃、6 000×g离心15 min,弃上清,加20 mL 1×PBS重悬细菌,-80℃/室温反复冻融3次,冰浴超声30 min,其间每超5 s 停10 s。4 ℃、6 000×g离心15 min,移取上清,进行SDS-PAGE分析。
1.2.4 重组蛋白纯化及抗原性鉴定 用上述表达菌裂解上清,按说明书操作程序用Ni-NTA HisBind Resin层析柱在非变性条件下分离纯化重组蛋白(recombinant Sj068068,rSj068068),分步收集含目的蛋白的洗脱液,用SDS-PAGE电泳对纯化的重组蛋白进行鉴定,用紫外吸收法测定蛋白浓度。利用DNAStar生物学软件分析重组蛋白的抗原性以及主要抗原决定簇,以感染日本血吸虫14 d的兔血清为一抗,羊抗兔IgG-HRP为二抗,DAB为显色剂,进行Western blot分析。
1.2.5 动物免疫试验及保护效果评估 将BALB/c雄性小鼠随机分组。在新饲养环境适应1周后,随机分成3组,每组10只。以ESSAIISA 206 CELL为佐剂,分别于d 0、14、28以背部皮下多点注射方法免疫,每次注射0.1 mL。重组抗原的免疫剂量为每次30 μg /鼠,三免后2周,腹部贴片法攻击感染日本血吸虫尾蚴[(40±2)条/只],感染42 d后剖杀,以肝门静脉灌注法收集成虫,分别计数日本血吸虫总数。收集肝脏,取右叶称重后加入5 mL1×PBS,用均质器按10 000 r/min均质匀浆1 min,加入5 mL 10%NaOH,水浴56 ℃消化1~1.5 h,充分混匀后取20 μL解剖镜下计数虫卵数,每份样本计数3次后取平均值,计算每克肝脏虫卵数(eggs per gmm,EPG)。按下列公式计算减虫率和减卵率:减虫(卵)率(%)=[对照组平均虫体数(EPG平均数) 实验组平均虫体数(EPG平均数)]/对照组平均虫体数(EPG平均数)× 100%。
1.2.6 血清抗体测定 于免疫前、每次免疫后一周断尾采血,剖杀时眼眶采血,离心分离血清。以重组蛋白为检测抗原,HRP-兔抗鼠IgG为第二抗体,TMB为显色剂,用常规间接ELISA法[10]检测各组血清中的特异性抗体。检测时抗原包被浓度为10 μg/mL,每孔100μL;封闭液为含1.5%的牛血清白蛋白(BSA)的PBST(1×PBS,0.05%Tween-20);待检血清稀释度为1:100,每孔100 μL;HRP-兔抗鼠IgG工作浓度为1:1000,每孔100 μL。
2 结果
2.1 Sj06868基因的克隆及生物信息学分析从7 d、14 d童虫中扩增到500 bp左右的DNA片段(图 1),从42 d成虫中未能扩增到相应片段。序列分析显示该片段长度为492 bp,编码日本血吸虫假想蛋白SJCHGC068068 C端的163个氨基酸,推导的理论分子量为18 kDa。和Genbank中公布的日本血吸虫假想蛋白SJCHGC068068的编码基因序列(登录号:AY809313.1)相比较,同源性为98%,推导的氨基酸序列同源性为96%;和GenBank中公布的登录号为FN316908.1的日本血吸虫假想蛋白全长mRNA序列相比较,缺少N端15个氨基酸的编码序列,同源性为97.6%,推导的氨基酸序列同源性均为96%(见图2)。未发现其他物种的相似同源性序列。利用DNAStar生物学软件工具分析目的蛋白的抗原性,结果显示在11~40 aa、75~23 aa、147~164 aa等区域有良好的抗原性。

图1 日本血吸虫Sj06868基因PCR扩增Fig. 1 PCR products of Sj06868

图2 Sj06868基因的核苷酸序列及推导的氨基酸序列Fig.2 Nucleotide sequence and deduced amino acid sequence of the Schistosoma japonicum Sj06868 gene
2.2Sj068068基因的表达 重组质粒pET32a-Sj068068转化的大肠杆菌Rosetta(DE3)经0.1mmol/L IPTG诱导后,获得高效表达,表达产物为可溶性蛋白,分子量为36 kDa(图3),用His柱纯化后,纯化蛋白的获得率约为58.3 mg/L细菌培养物。
2.3 rSj068068的Western blot分析 用感染日本血吸虫14 d的兔血清为一抗,羊抗兔IgGHRP为二抗,对纯化的重组蛋白rSj068068进行Western blot分析。结果感染日本血吸虫14 d的兔血清和纯化重组蛋白rSj068068有特异性反应,和未诱导的培养菌裂解液没有反应(图4)。

图3 纯化重组蛋白rSj068068的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the purified recombinant fusion protein rSj068068

图4 重组蛋白rSj068068的western blot 分析Fig.4 Western blot analysis of purified protein
2.4 减虫率和肝脏减卵率 重组抗原rSj068068与佐剂ESSAI ISA 206 CELL混合后免疫的BALB/c小鼠,攻击感染后42 d,平均每鼠虫荷数为16.50±3.89,与佐剂对照组和PBS对照组相比差异显著(P<0.05),减虫率分别为31.63%、29.19%。免疫组平均每克肝脏组织含卵数为22 873.32±7 683.24,与佐剂对照组和PBS对照组相比,减卵率分别为55.36%、56.27%,差异极显著(P<0.01)(表1)。

表1 重组抗原rSj068068对BALB/c小鼠的诱导保护性效果Table 1 Protective level of BALB/c mice immunized with rSj068068
2.5 抗体水平的测定 间接ELISA法检测结果显示,免疫组抗rSj068068特异性抗体在第一次免疫后即逐步增加,到第三次免疫后达到高峰并一直维持到实验结束。佐剂对照组、PBS对照组在攻击感染前均未产生抗rSj068068特异性抗体;攻击感染后42 d,佐剂对照组、PBS对照组中的抗rSj068068特异性抗体也上升到免疫组水平(图5)。
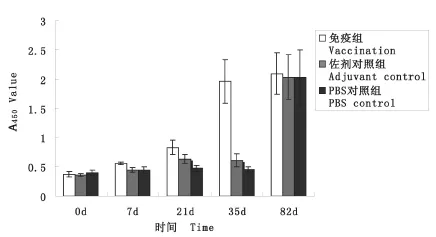
图5 抗 rSj068068特异性抗体检测Fig.5 Specific antibody response against rSj068068 in each group
3 讨论
由于血吸虫在宿主体内不增殖,其感染所致的最大危害是血吸虫排出的虫卵沉积于肝脏引发免疫病理改变导致肝功能受损,通过免疫减少宿主体内虫荷量和虫卵产量,可以达到减轻病变和减少传播机会。WHO认为只要达到40%减虫率或减卵率就有一定的应用前景[11]。在本实验室前期研究中,用含有Sj068068基因片段噬菌体展示抗原诱导了24.28%的减虫率以及45.52%肝脏虫卵减少率。在本研究中,重组抗原rSj068068免疫小鼠,与佐剂对照组相比,免疫组获得了31.63%减虫率和55.36%肝脏减卵率,与PBS对照组相比,免疫组获得了29.79%减虫率和56.27%的肝脏减卵率。可见,Sj068068基因及其产物在抗血吸虫疫苗研究方面具有进一步研究的潜质。
本研究从7 d、14 d童虫的mRNA中扩增到Sj068068基因的DNA片段,从42 d成虫中虽经多次PCR扩增亦未能得到相应片段,显示Sj068068基因是血吸虫童虫期高表达基因。对该基因的核苷酸序列及推导的氨基酸序列进行BLASTn分析,发现其只与GenBank中公布的日本血吸虫假想蛋白编码基因序列及推导的氨基酸序列有较高同源性,在其他物种中未找到相似同源性序列,也没有发现保守序列和相关功能结构域,推测该基因是日本血吸虫特有的未知基因。该基因的噬菌体展示产物能被东方田鼠肝脏裂解物识别[6],而东方田鼠抗血吸虫特性主要表现为对其体内血吸虫童虫具有杀灭作用。因此,该基因可能对血吸虫生长发育具有重要作用。
长期以来,我国家畜血吸虫病诊断主要采用以粪便虫卵孵化为主的病原学检测和以虫卵可溶性抗原为诊断抗原的血清学诊断技术,后者主要为间接血凝试验。病原学诊断费工、费时且检出率较低;虫卵抗原制备难度大,应用虫卵可溶性抗原建立的诊断技术难以开展早期诊断,也难以区分既往感染和现症感染。寻找理想的诊断抗原特别是基因工程抗原依然是当前研究的一个重点。本研究结果显示,重组抗原rSj068068能被感染日本血吸虫14 d的兔血清识别;免疫组、佐剂对照组、PBS对照组特异性抗体检测结果表明,两个对照组在感染血吸虫42 d后的特异性抗体也上升到免疫组水平。因此,应用重组抗原rSj068068开展血吸虫感染的诊断特别是早期诊断的研究可以作为下一步的尝试。
[1]郭家钢. 我国血吸虫病传染源控制策略的地位与作用[J].中国血吸虫病防治杂志, 2006, 18(3): 231-233.
[2]Wang T P, Maria V J, Zhang S Q, et al. Transmission of Schistosoma japonicum by humans and domestic animals in the Yangtze River valley, Anhui province, China [J].Acta Tropica, 2005, 96(2-3): 198-204.
[3]周晓庄, 姜庆, 汪天平, 等. 我国血吸虫病防治研究现状与发展战略思考[J]. 中国血吸虫病防治杂志, 2004,17(1): 1-3.
[4]汪世平, 陈秀春, 高冬梅, 等. 我国血吸虫疫苗研究进展和应用前景[J].中国寄生虫学与寄生虫病杂志, 2009,27(5): 402-411.
[5]孙毅, 孙焕, 贾人初, 等. 东方田鼠抗日本血吸虫抗性相关靶基因筛选[J]. 中国血吸虫病防治杂志, 2008, 20(1):26-31.
[6]孙换, 刘金明, 石耀军, 等. 东方田鼠肝脏裂解物筛选日本血吸虫成虫噬菌体展示cDNA文库[J]. 中国预防兽医学报, 2008, 30(8): 592-596.
[7]孙焕, 刘金明, 孙帅, 等. 东方田鼠肺脏裂解物筛选日本血吸虫成虫噬菌体展示cDNA文库[J]. 中国兽医寄生虫病, 2008, 16(2): 9-13.
[8]宋震宇, 刘金明, 何金桃, 等. 东方田鼠血清筛选噬菌体展示抗原对小鼠日本血吸虫病免疫效果观察[J]. 中国预防兽医学报, 2009, 31(4): 52-56.
[9]王素娟, 刘金明, 邢荣鹤, 等. 东方田鼠肝脏裂解物筛选日本血吸虫噬菌体展示抗原的免疫预防效果[J].中国血吸虫病防治杂志, 2010, 22(5): 431-436.
[10]Liu J M, Cai X Z, Lin J J, et al. Gene cloning, expression and vaccine testing of Schistosoma japonicum SjFABP[J]. Parasite Immunol, 2004, 26(8-9): 351-358.
[11]Bergquist N R. Controlling schistosomiasis by vaccination:a realistic option? [J]. Parasitol Today, 1995,11(5): 191-194.

